基于16S rRNA高通量测序分析大泷六线鱼表皮粘液及肠道内容物微生物多样性
2021-01-27樊英于晓清李乐王晓璐叶海斌胡发文刁菁刘洪军
樊英,于晓清,李乐,王晓璐,叶海斌,胡发文,刁菁,刘洪军
山东省海洋生物研究院, 山东省海水养殖病害防治重点实验室; 青岛市海洋生物种质资源挖掘与利用工程实验室, 山东 青岛 266104
鱼表皮组织是机体抵御外界病原入侵的第一道防线,可参与渗透压调节、信息传递、病害防御等重要生命活动[1]。在养殖系统中,由于自然的(如高温、高溶解氧等)或人为的(分类、捕捞等)原因都可能给养殖动物带来众多威胁,对机体生理产生负面胁迫,进而损害表皮组织系统,降低机体的存活率和对病害的抵抗力[2-3]。然而,鱼表皮粘液是表皮组织与外界环境之间的粘膜屏障[4]。粘液中栖息着的大量微生物,时刻与环境、动物机体构成生物、物理、免疫屏障,可通过免疫球蛋白、补体、溶菌酶等作用增加鱼体抵抗病原菌侵入的能力[5]。有研究报道,金头鲷(SparusaurataL.)表皮粘液中含有高水平的皮质醇和IgM,可提高其对环境胁迫的抵抗能力[2];鲫鱼(Carassiusauratusgibelio)表皮粘液可显著降低5×103CFU嗜水气单胞菌(Aeromonashydrophila)对机体的侵入[6];大菱鲆(Scophthalmusmaximus)体表粘液中的溶菌酶等水解酶类可通过溶解寄生物等作用来保护机体[7];而且,鱼类粘液中的凝集素可提高吞噬作用,同时作为免疫活性物质提高机体的防御能力[8]。
鱼肠道既是体内主要的消化器官,又是机体病害防御的又一道防线[9]。在这一开放复杂的生态系统中同样存在着大量的微生物,它们即是最简单的生命体,又具有高等生物的基本生命过程,这些微生物参与着宿主的生长发育、营养代谢、免疫调节等功能的运转,与宿主之间建立了动态平衡关系,而且一般在幼鱼阶段随肠道器官的发育成熟而达到稳定[10-12]。肠道微生物菌群的稳定性是鱼类抵抗病原体感染的一个非常重要的因素。若肠道微生态平衡失调,机体正常生理功能就会发生紊乱,因此,了解鱼类肠道微生物菌群结构将有助于了解疾病暴发前或期间所带来的干扰[13]。近年来,肠道微生物基因组计划逐步实施,宏基因组学、功能基因组学、代谢组学以及蛋白质组学不断发展,肠道微生物的研究备受关注[14-15]。樊英等[16]通过肠道菌群结构的变化来评价丁酸梭菌(Clostridiumbutyricum)和凝结芽孢杆菌(Bacilluscoagulans)对虹鳟(Oncorhynchusmykiss)的影响;孙盛明等[17]通过肠道菌群结构的变化来研究甘露寡糖(mannan oligosaccharide, MOS)对团头鲂(Megalobramaamblycephala)幼鱼的影响;Zhao等[18]通过肠道有益内源菌(如芽孢菌Bacilli、放线菌Actinobacterial)数量探讨益生菌对九孔螺(Haliotisdiversicolor)的影响。
大泷六线鱼(Hexagrammosotakii),俗称黄鱼,素称“北方石斑”,属于鲉形目(Scorpaeniformes)、六线鱼科(Hexagrammidate)、六线鱼属(Hexagrammos),适于在水温低于20 ℃、洁净无污染的流动水环境中生长,常见于黄、渤海地区,因其营养价值和经济价值深受消费者和养殖者的喜爱,具有良好的市场前景[19]。随着人们生活水平的提高,鱼类需求量逐渐增加,且在高集约化养殖环境下,细菌性疾病的发生频率呈逐年上升趋势,目前常见且集中研究的病原菌包括爱德华氏菌、副溶血性弧菌、哈维氏弧菌等[20-22]。随着生物技术的发展,微生物菌群多样性研究在健康养殖以及病害防控方面已有报道[23-26],但关于大泷六线鱼表皮粘液及肠道内容物中的微生物菌群研究还未见报道。因此,本实验通过16S rRNA高通量测序技术分析大泷六线鱼表皮粘液及肠道微生物菌群结构多样性,可为微生物基因功能预测奠定基础,为水产品的安全性评价提供参考,更为分析病害发生机理和指导合理用药提供依据。
1 材料与方法
1.1 实验材料
1.1.1实验大泷六线鱼及饲养条件 150尾大泷六线鱼来自青岛鲁海水产技术发展公司,游动活泼,体色光亮正常,食欲旺盛,未发现病症,平均体质量为(12.00±2.0)g。实验共分3个平行组,每组150尾鱼。养殖周期30 d。
实验用基础配合饲料来自北京汉业科技有限公司,其营养水平为粗蛋白质471 g·kg-1、粗脂肪174 g·kg-1、粗灰分96 g·kg-1、可溶性膳食纤维5.91 g·kg-1、水解氨基酸404.4 g·kg-1、钙1.521 0×104mg·kg-1、铁808 mg·kg-1、锌137 mg·kg-1、水分75.3 g·kg-1。
实验在山东省海洋生物研究院养殖基地循环水养殖系统(3 m×1 m×1.2 m)中进行。实验过程中每天排污、吸除残饵,每天分别在10:00、18:00投喂两次,日投喂量为鱼体质量的2%,根据摄食情况适当调整投喂量,达到饱食投喂,无残饵剩余,且饲喂饵料在2 h内摄食完。实验期间水温为(12.5±1.0) ℃,溶解氧为(7.0±0.5) mg·L-1,pH为7.2±0.3,氨氮和亚硝酸氮含量<0.1 mg·L-1。
1.1.2试剂 E.Z.N.A.©Stool DNA Kit购自美国OMEGA公司;Axyprep PCR Cleanup Kit购自美国AXYGEN, Life Science Research公司;Biowest Agarose G-10购法国BIOWEST公司;Pusion Hot start fles 2X Master Mix购自上海仪涛生物仪器有限公司;50 ×TAE Buffer购自上海生工生物工程股份有限公司。
1.1.3仪器与设备 冷冻离心机购自美国BECKMAN公司;PCR仪购自美国BIO-RAD公司;电泳仪购自北京六一仪器有限公司;数码凝胶成像仪购自美国SIM公司;超微量核酸蛋白分析仪购自五洲东方科技发展有限公司。
1.2 方法
1.2.1样品采集 对正常养殖期间大泷六线鱼进行表皮粘液和肠道内容物取样。取样前停食24 h,每组随机挑取45尾鱼,将无菌操作台置于冰上进行鱼样处理。鱼表皮组织粘液样品按照Guardiola[27]的方法进行,即通过无菌细胞刮刀轻轻地刮擦背外侧进行收集,注意避免血液和泌尿生殖道及肠道排泄物的污染;收集的粘液样品加入同体积的无菌海水进行均化,剧烈摇动后4 ℃ 2 000 g离心10 min,上清液于-80 ℃保存(分别编号为HO_S:S1、S2、S3)、备测。随后,用75%酒精将鱼肛门及周边表皮进行消毒,用无菌解剖剪沿肛门向上、前呈弧形剪开,取出肠道;然后,先用75%酒精消毒肠道组织表面,再用无菌PBS缓冲液冲洗3次,无菌棉球擦拭干燥后将中后肠肠道内容物置于无菌Eppendorf管中,-80 ℃保存(分别编号为HO_I:I1、I2、I3)、备测。本实验将15尾鱼的粘液或肠道样品混合作为一个样品进行分析,以减少个体间变异的影响。
1.2.2基因组DNA提取、扩增、纯化 采用E.Z.N.A.©Stool DNA Kit提取鱼表皮粘液及肠道内容物微生物总基因组DNA,按照操作说明方法进行。提取得到的DNA经1.5%琼脂糖凝胶电泳分析其合格性,并由超微量核酸蛋白分析仪(Biodropsis BD-1000)测定其浓度,保存于-80 ℃作为模板使用。PCR反应体系25 μL:基因组DNA模板50 ng,V3+V4区通用引物338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′) 各2.5 μL,Pusion Hot start flex 2X Master Mix 12.5 μL,补水至25 μL;反应条件为:98 ℃ 30 s;98 ℃ 10 s,54 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min;产物经回收、纯化后,备测。
1.2.3高通量测序及分析 纯化后的产物由杭州联川生物有限公司通过文库制备与库检后进行Illumina MiSeq 2×300 bp paired-end上机测序。Miseq测序完成后,得到原始的下机数据,去除Reads的Barcode和接头序列,利用Overlap将双端数据进行拼接,去除含有N(N表示无法确定碱基信息)的比例大于5%的tags,去除低质量tags (质量值Q<10的碱基数占整个tag的20%以上),通过质控和过滤后,获得高质量的Clean数据。对有效数据进行97%的相似度聚类,采用CD-HIT将序列相似性大于97%的clean tags定为一个OTU (operational taxonomy unit),过滤后获得最终的OTU丰度及代表序列,进一步进行多样性分析和差异分析等。分析数据库包括RDP、Greengenes、NCBI 16S Microbial和Customized database。分析内容包括原始数据优化及有效优质序列统计、OTU Venn图、Alpha多样性指数分析、Beta多样性PCoA分析、Rank-aboundance曲线分析、分类学丰度分析、物种差异分析。
2 结果与分析
2.1 基于16S rRNA测序的大泷六线鱼表皮粘液和肠道内容物菌群多样性
2.1.1基于16S rRNA测序的大泷六线鱼表皮粘液和肠道内容物序列数据分析 对大泷六线鱼表皮粘液和肠道内容物的16S rRNA序列数据进行分析,每个样本的有效序列如表1所示,肠道内容物样本中高质量有效序列数量均超过30 000条,明显多于表皮粘液样本中有效序列数量,说明肠道内容物样本中的细菌丰富度高于表皮粘液样本。根据97%的相似度进行OTU分类,表皮粘液不同样本OTU数目分别为13 051、12 202、17 436,其中注释到数据库的比例为99%以上;肠道内容物不同样本OTU数目分别为20 226、30 441、18 887,其中注释到数据库的比例为99%以上,其可操作分类单元数量高于表皮粘液样本。这些结果均说明不同样本测序数据量足够大,数据质量合格,可以反映样本中绝大多数的微生物多样性信息,具有说服力。

表1 大泷六线鱼表皮粘液和肠道内容物测序序列数据分析Table 1 Analysis of sequences from skin mucus and intestine content in Hexagrammos otakii
2.1.2OTU分布韦恩图(Venn) 对不同样本OTU组成的相互关系进行分析并构建Venn图。从图1中可看出,肠道内容物样本中OTUs数量与表皮粘液样本之间存在差异变化,肠道内容物样本中OTUs数量较多,说明肠道内容物样本微生物多样性和丰富度较高。肠道内容物和表皮粘液样本中共有OTUs数量为33个,分别占肠道内容物OTUs数量的16.34%、18.03%、12.04%,而占表皮粘液样本中OTUs数量的16.26%、17.28%、17.46%,这说明不同样本之间微生物多样性和丰富度既存在相似性又有差异性。
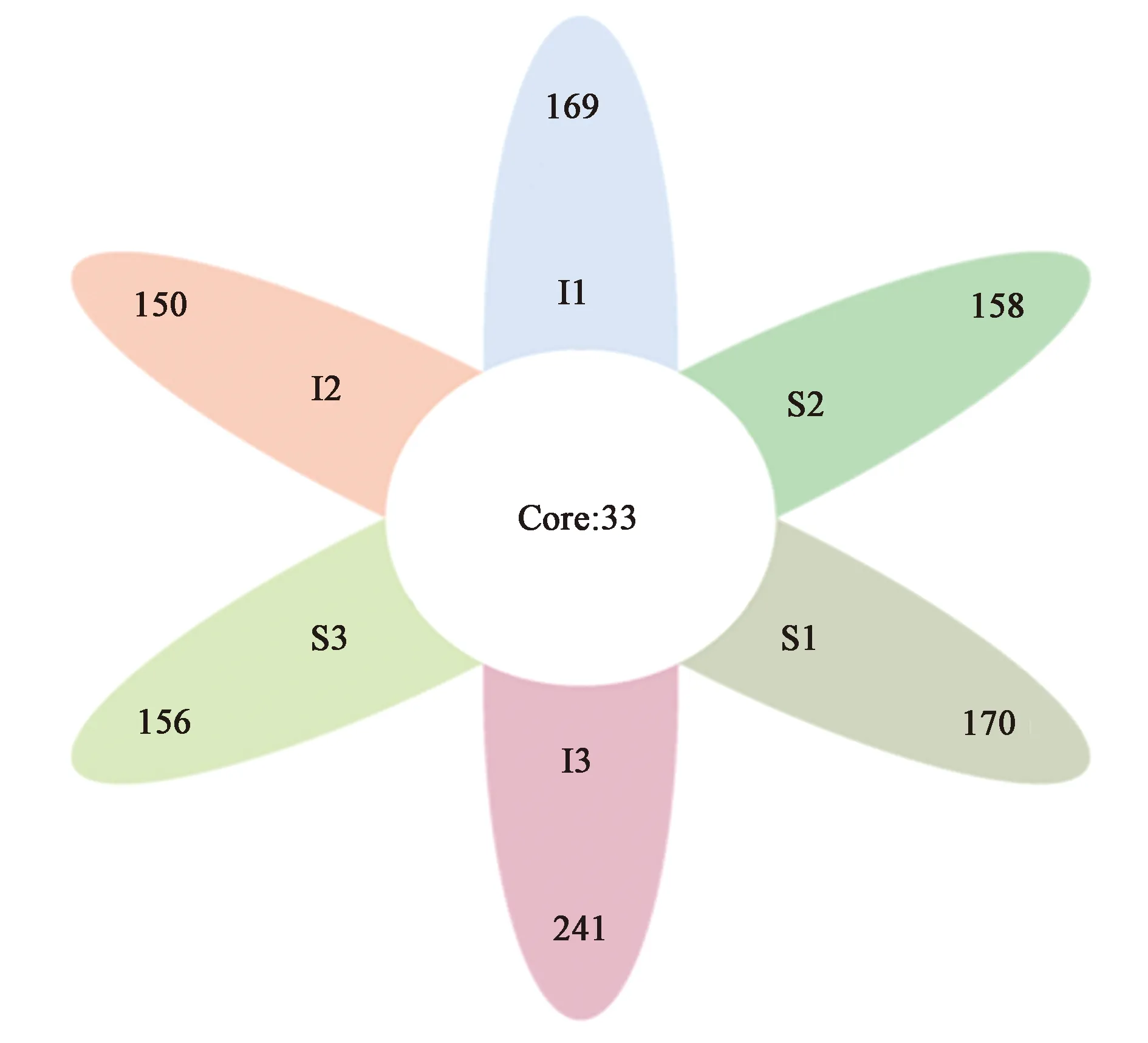
注:I1, I2, I3—大泷六线鱼肠道内容物;S1, S2, S3—大泷六线鱼表皮粘液。图1 不同样品OTU分布Venn图Fig.1 OTU Venn analysis of different samples
2.1.3Rank-abundance曲线分析 统计每个样本中每一个OTU所含的序列数后,将OTUs按丰度由大到小的等级排序,再以OTU等级为横坐标,以每个OTU中所含的序列数为纵坐标做图。从图2 Rank-abundance曲线在横坐标轴上的长度来看,大泷六线鱼肠道内容物的曲线较宽,说明其中微生物丰富度较高;从曲线的形状上看,曲线越陡峭,OTU间的丰度差异越大,均匀度越低,本研究中随着OTU等级的增加,曲线均趋平坦,说明肠道内容物和表皮粘液样本中微生物组成的均匀度均逐渐提高。
2.2 Alpha多样性分析
对不同样本在97%一致性阈值下的Alpha多样性指数(Chao1,Simpson,Shannon,Goods coverage)进行统计。由表2可见,不同样本的coverage均达到了0.999以上,说明本研究样本中序列未检出的可能性小,结果可真实地反映微生物群落多样性。其中肠道内容物样本I3和表皮粘液样本S2中的Chao1指数较高,表明样本微生物群落的丰富度较高;且表皮粘液样本S2和肠道内容物样本I3中Shannon指数(Shannon-wiener diversity index)和Simpson指数(Simpson diversity index)较高,表明样本微生物的物种多样性较高。不同样本的物种多样性存在差异,可能与大泷六线鱼的养殖环境、摄食条件等因素有关。
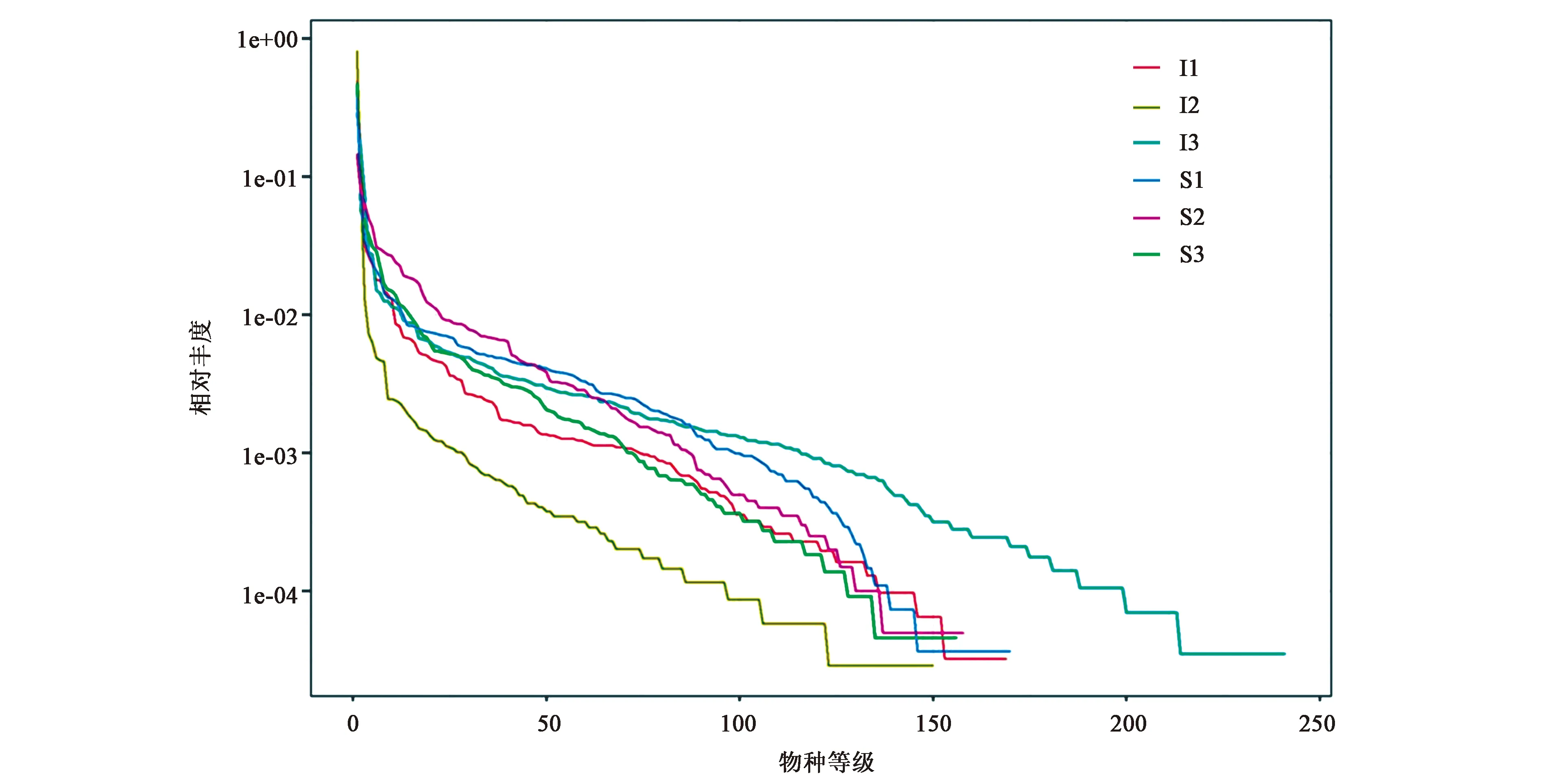
注:I1, I2, I3—大泷六线鱼肠道内容物;S1, S2, S3—大泷六线鱼表皮粘液。图2 Rank-abundance曲线图 Fig.2 Rank-abundance curve
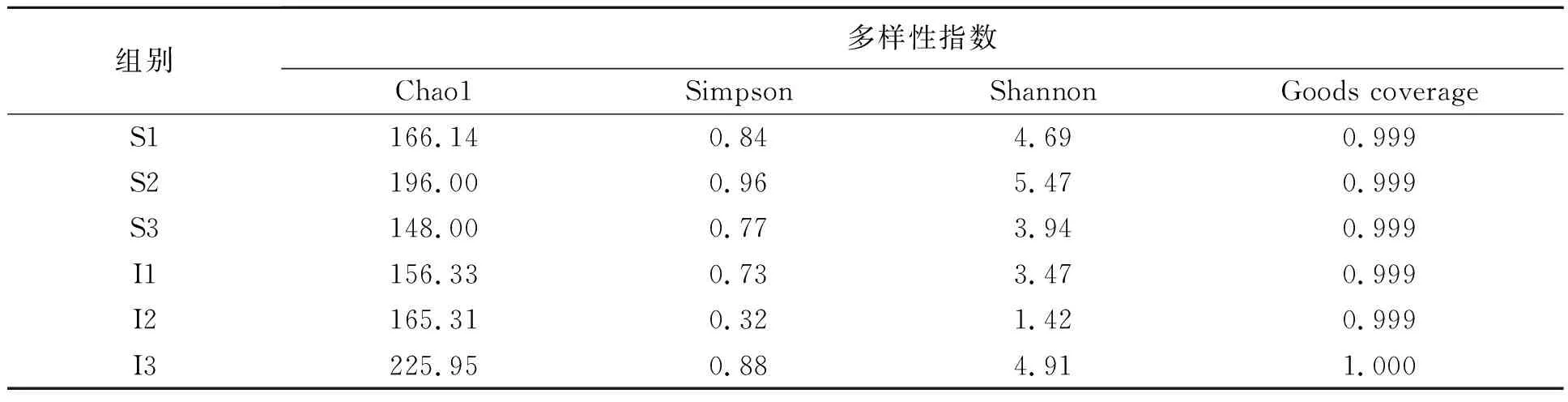
表2 大泷六线鱼表皮粘液和肠道内容物中微生物多样性统计Table 2 Diversity indexes of microbiome from skin mucus and intestine content in Hexagrammos otakii
2.3 Beta多样性分析
Beta多样性分析采用PCoA对多维数据降维后提取出数据中最主要的元素和结构进行分析,与alpha多样性一起构成了总体多样性或不同组织来源微生物物种的异质性。从图3中可知,横坐标为PCo1,贡献率值为53.43%、38.63%,纵坐标为PCo1,贡献率值为28.29%、16.46%;这2个主成分是样本微生物群落结构组成差异的主要因子。本研究中,大泷六线鱼肠道内容物和表皮粘液样本来自完全不同的环境,结果体现了不同样本中物种的异质性和多样性,同类样本距离较近,其群落组成相似。
2.4 群落结构组成分析
进一步对不同样本中的细菌类别和相对丰度进行统计。从表3~6中可得,优势菌门均为蓝菌门(Cyanobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes);其中蓝菌门丰度比例较高,可能是由于养殖环境及水质条件引起的。进一步对细菌菌属组成进行分析,肠道内容物样本中优势菌属包括Streptophyta、芽孢杆菌属(Bacillus)、未分类杆菌属(Bacillaceae_unclassified)、气单胞菌属(Aeromonas),除Streptophyta外,高丰度的芽孢杆菌属可能较多地发挥益生菌的作用,促进营养物质的消化与吸收;表皮粘液样本中优势菌属包括Streptophyta、气单胞菌属(Aeromonas)、未分类杆菌属(Bacillaceae_unclassified)、香味菌属(Myriudes)、假单胞菌属(Gemmobacter)及弧菌属(Vibrio),因其接触到复杂的外界环境,其中可能含有更多的条件性致病菌。这说明不同组织来源微生物菌群分布情况不同,不同的菌群结构发挥着不同的生物学功能。
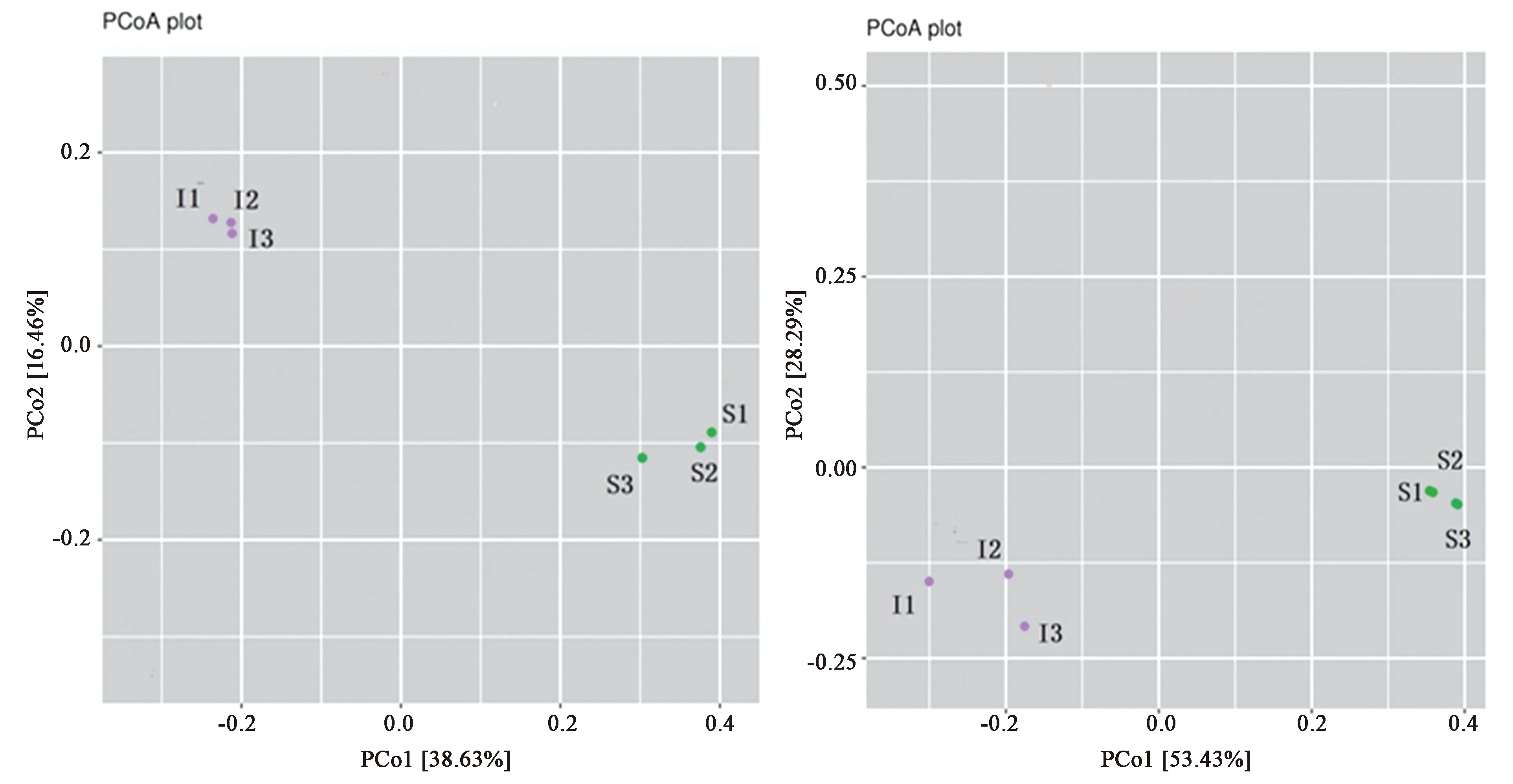
注:I1, I2, I3—大泷六线鱼肠道内容物;S1, S2, S3—大泷六线鱼表皮粘液。图3 PCoA 分析中2D PCoA 图(多样性比例)Fig.3 2D PcoA graph in PCoA anlysis (percentage of diversity)
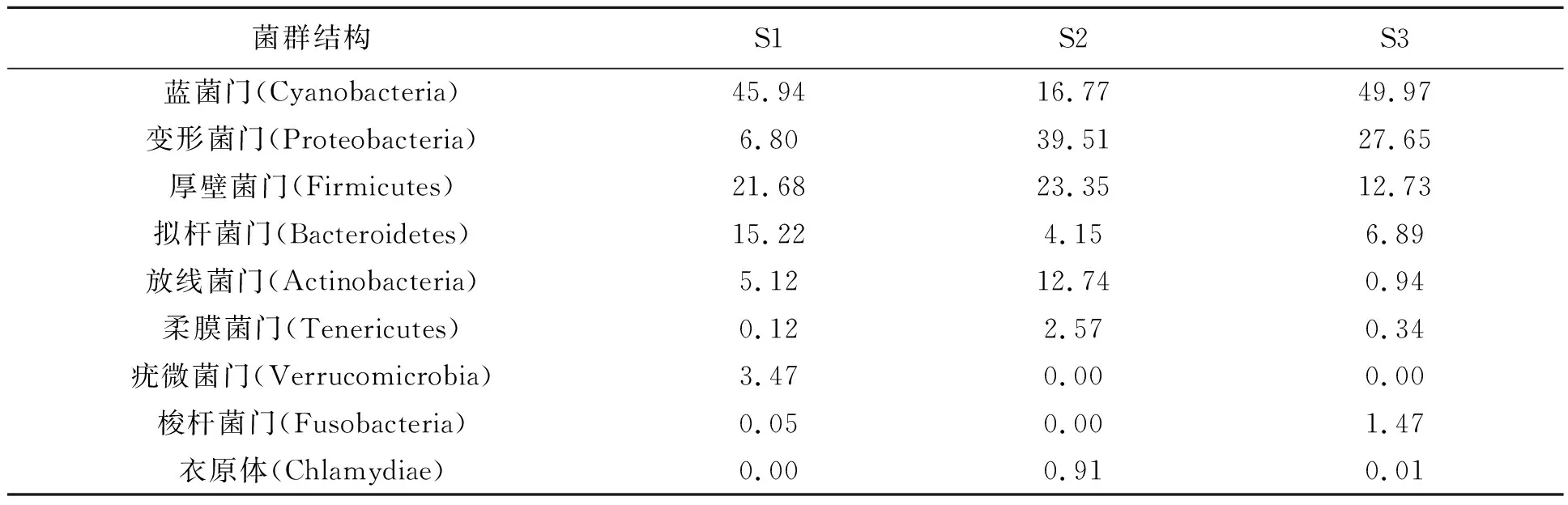
表3 大泷六线鱼表皮粘液中微生物门水平结构及相对丰度比例Table 3 Frequence and radio in microbial communities from skin mucus in Hexagrammos otakii /%
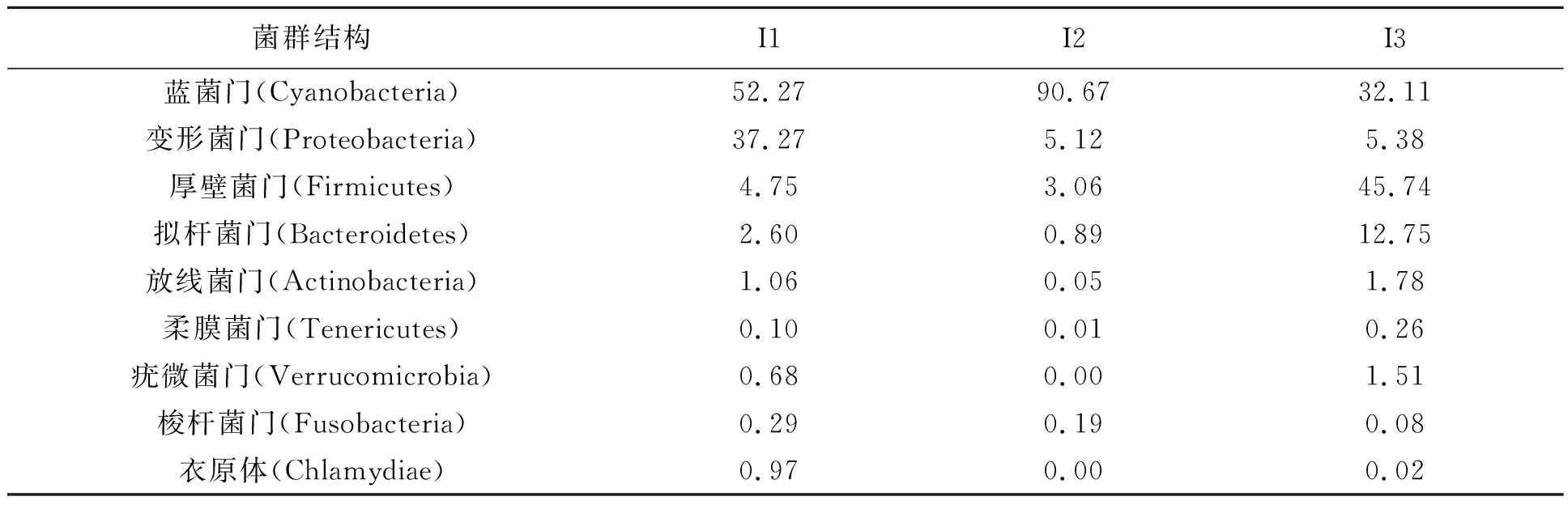
表4 大泷六线鱼肠道内容物中微生物门水平结构及相对丰度比例Table 4 Frequence and radio in microbial communities from intestine content in Hexagrammos otakii /%

表5 大泷六线鱼表皮粘液中微生物属水平结构及其相对丰度比例Table 5 Frequence and radio of genus in microbial communities from skin mucus in Hexagrammos otakii /%
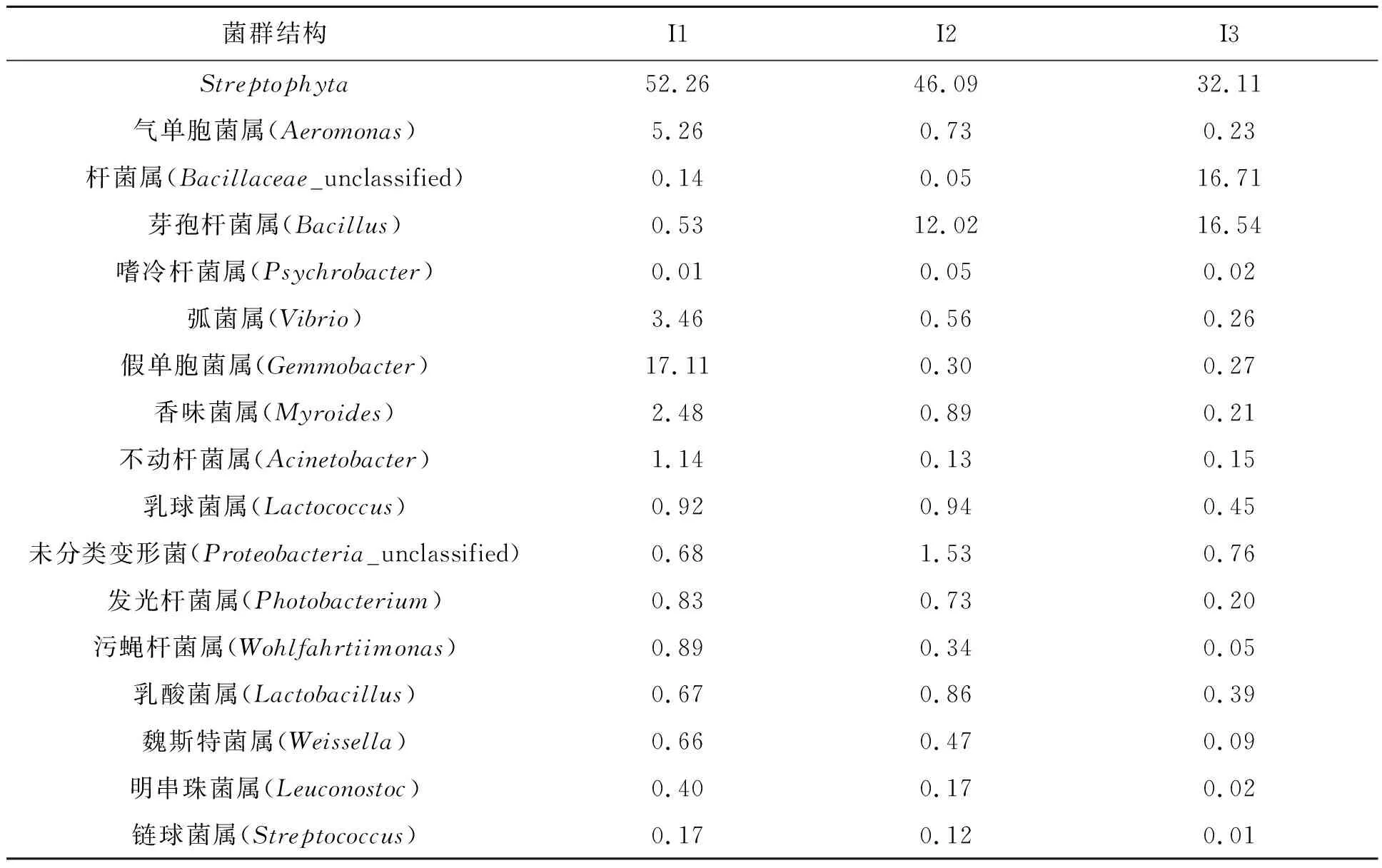
表6 大泷六线鱼肠道内容物中微生物属水平结构及其相对丰度比例Table 6 Frequence and radio of genus in microbial communities from intestine content in Hexagrammos otakii /%
2.5 不同样本微生物群落的差异分析
为了进一步探究不同来源微生物群落结构之间的关系,本实验从属水平上构建了样品聚类关系树的热图 (heatmap)。从图4可以得出,大泷六线鱼表皮粘液和肠道内容物微生物种类存在差异的同时也有很大的共同之处。微生物根据进化关系聚类为两大分支,其中样本I3和S1构成一支,另外4个样本构成一支,说明I3和S1样本中的微生物群落结果与其他样本有所不同。结构组成与功能关系相辅相成,从不同的菌群结构中可探索发现特有的或缺少的生物学功能。本研究热图中的蓝色方块,表明这种微生物含量非常低,这些结果可为后续微生态制剂或饲料添加剂的研发提供参考。
2.6 不同样本中潜在细菌类病原的分布
将大泷六线鱼表皮粘液和肠道内容物中丰度>0.1%的潜在病原菌进行统计,如表5所示,有13种潜在的病原菌及其分布特征。这些病原菌主要隶属于厚壁菌门、变形菌门,也是本研究中表皮粘液和肠道内容物中的优势菌门。各致病菌的临床意义详见表5[28-31],结果可以在依据菌群结构特征进行病害防控时提供数据参考。
3 讨论
研究微生物群落多样性的传统方法是依赖实验室纯培养技术,分离纯化得到单一菌株后进行鉴定,但在复杂的共生体系中许多微生物无法人工培养,这种方法在获得微生物的数量和种类上都存在很大的局限性,因此不能准确反映其微生物多样性[32]。近年来,DGGE、TGGE、16S rRNA高通量测序技术已经被广泛应用于不同来源微生物多样性的分析中,填补了无法在传统实验室中培养的微生物的研究空白,解决了准确率低、操作复杂等问题,拓展了对微生物资源的利用空间,也为研究微生物间的相互作用提供了有效工具[33-40]。本研究基于16S rRNA高通量测序技术对微生物V3+V4区进行测序分析,获得了大量的、全面的且深入的菌群信息,主要关注大泷六线鱼表皮粘液和肠道内容物中潜在致病菌的结构特征,为后续大泷六线鱼的病害防控及药物研发提供了依据。

注:I1, I2, I3—大泷六线鱼肠道内容物;S1, S2, S3—大泷六线鱼表皮粘液。图4 属水平上大泷六线鱼表皮粘液和肠道内容物微生物组成热图Fig.4 Heatmap of genus in microbial communities from skin mucus and intestine content in Hexagrammos otakii

表7 大泷六线鱼表皮粘液和肠道内容物微生物中潜在病原菌分布特征及临床意义Table 7 The characteristics and clinical significance of potentially pathogenic microorganisms in the intestine contents and skin mucus in Hexagrammos otakii
鱼表皮粘液和肠道微生物都是机体的重要组成部分,在维持生长发育、生理代谢及病害防御等方面发挥着重要作用[41-42]。本研究结果统计,肠道内容物中微生物丰富度较高,高丰富度的微生物是有益于宿主健康的,既能对肠道稳态产生调节效应,又能促进多种营养物质的消化;表皮粘液中微生物多样性较高,可能因为鱼表皮黏液层位于鱼体的最外层,能够接触到复杂的外界环境,因此增加了微生物的多样性。有研究报道,虹鳟肠道内容物和粘膜层中细菌多样性存在显著差异,拟杆菌门和梭杆菌门只存在于肠道内容物中,不同组织来源之间的菌群结构不同[43];洪斌等[44]研究发现,凡纳滨对虾肠道优势菌为变形菌门,而罗氏沼虾为厚壁菌门,不同宿主之间的菌群结构不同;刘文舒等[45]研究报道,黑斑蛙(Rananigromaculatahowell)肠道前、中、后不同部位的微生物组成结构同样存在显著差异。本实验结果与上述研究结果相似,大泷六线鱼表皮粘液和肠道内容中菌群结构不同,有一些细菌是容易黏附在表皮的,有一些细菌可能是定植在肠道中的。通过与RDP数据库比对发现,在门水平上占绝对优势的菌群是蓝菌门,其次是变形菌门、厚壁菌门和拟杆菌门,这与Wu等[46]对黄鲶(Pelteobagrusfulvidraco)的研究、Yang等[47]对暗纹东方鲀(Takifuguobscures)的研究结果不同,与Clements等[48]研究发现的3种不同海水鱼(Kyphosussydneyanus、Odaxpullus和Aplodactylusarctidens)后肠中优势菌是厚壁菌门和梭菌门不同,与Lyons[49]研究的虹鳟(Oncorhynchusmykiss)肠道内优势菌是柔膜菌门结果也不同,这些都说明不同组织来源的微生物因其宿主特征、养殖环境、饲料营养以及水质条件不同,其优势菌属会不同,间接反映了宿主及其微生物结构对病害抵抗能力的异质性。本研究中,大泷六线鱼表皮粘液和肠道内容物中蓝菌门高丰度存在,可能因为所处养殖环境和水质条件造成的;其次是丰度较高的变形菌门,除了由脂多糖组成外膜结构的运动型种类外,还有一些黏菌、兼性或专性厌氧型细菌等,主要参与蛋白质代谢、糖代谢、脂代谢、氨基酸代谢等各种生命活动;另有芽孢杆菌属等厚壁菌门,可通过分解纤维素,提高宿主的营养利用率,从而维持肠道微生物的生态平衡[50-52]。和肠道内容物比较,表皮粘液中的气单胞菌属含量稍高,可参与分解水环境中的碳水化合物、化能有机营养等物质;嗜冷杆菌属的存在使得鱼表皮粘液内蛋白质呈现出“抗冻能力”,保护机体在恶劣环境内免受伤害;香味菌属的存在可参与水环境的优化,可能是因为其能够降解多环芳烃类物质发挥的作用。但是,表皮粘液中的这些菌属可能也增加了表皮条件性致病菌的暴发。因此,进一步研究不同因素压力下的大泷六线鱼表皮粘液和肠道内微生物菌群结构,有助于更加全面地分析其细菌多样性,了解微生物和宿主协同进化过程中的变化。
鉴于变形菌门、厚壁菌门广泛分布于养殖动物中,在各种不同条件下均可能导致潜在的危害,故不同组织来源的潜在致病菌也是我们研究的焦点。然而,鱼类肠道、表皮都是细菌性疾病最可能的侵入点。鱼类表皮黏液层是非特异性免疫的重要组成部分,由于其位于最外层而成为抗感染的第一个屏障,了解表皮粘液微生物结构将有助于发现病害防控措施,对于健康养殖有着重要意义。例如气单胞菌可引起鱼体表面溃烂、鳍基部充血发红或肛门红肿等[53],爱德华氏菌可引起鱼体鳃丝糜烂、表皮溃烂,甚至伴随肠炎发生等[54]。本研究中表皮粘液含有的气单胞菌属、嗜冷杆菌属、弧菌属和香味菌属含量稍高,在环境胁迫、机体免疫力低下时,可能引发上述病征或其他基础性疾病,最终导致经济效益和社会效益的损失。肠道内容物中芽孢杆菌属等包含益生菌的同时也伴有条件性致病菌的存在,如低含量的气单胞菌属、弧菌属等;这些结果均为大泷六线鱼细菌性疾病的防控提供了参考,在养殖过程中了解其动态变化并对这些条件致病菌准确认知,对预防鱼类养殖疾病具有现实意义。如王纯等[55]研究报道,患病大西洋鲑鱼中弧菌科和气单胞菌科细菌丰度显著高于健康鱼,这样的研究更有助于我们在解析鱼体肠道微生物多样性的同时,深入探究相关菌群所能发挥的功能,预警养殖过程中的相关疾病及防控方法,开发新型的功能性饲料添加剂等。值得注意的是,条件致病菌不是时刻都会导致病害的发生,只有在宿主遭受免疫或生理压力等特定的恶劣环境下才会暴发,正常情况下条件致病菌的存在也是必需的、无害的[56],其机理尚待研究。
本研究团队推测,大泷六线鱼表皮粘液和肠道内容物微生物功能相似又不同。表皮粘液中微生物可通过诱导宿主固有免疫或营养交换等不同方式阻止病原菌的入侵或定植,做好第一道防线。肠道内容物中一些高产酶能力的微生物参与宿主营养物质的消化吸收,一些形成生物膜的厌氧菌参与机体的天然物理屏障,一些高营养代谢产物参与抑菌、杀菌共同抵御病原菌的入侵,协助机体完善营养代谢功能及防御功能,更详细的功能探究需要更多的研究数据来佐证。因此,利用宏基因组等多组学联合技术开展微生物研究是发展的主要方向,探究具有重要功能的微生物,良好的病害防控及预警将成为保障水产养殖业长远发展的关键。
