施氏假单胞菌氮代谢调控蛋白GlnK与碳信号分子α-酮戊二酸的体外互作研究
2021-01-27王珊珊毋少宇刘一超战嵛华柯秀彬陆伟燕永亮
王珊珊,毋少宇,刘一超,战嵛华,柯秀彬,陆伟,燕永亮
中国农业科学院生物技术研究所, 北京 100081
PⅡ蛋白广泛分布于古细菌、细菌和高等植物中,是较为古老的蛋白家族之一[1]。长期以来,PⅡ蛋白GlnB、GlnK被认为是氮代谢系统的关键信号转导蛋白,通过感知并传递细胞内的碳氮代谢信号,级联调控glnKamtB、nifLA和nifHDK等固氮相关基因表达[2-3]。谷氨酰胺是氨同化的主要产物,也是细胞内氮状态的主要指标。PⅡ蛋白在固氮网络中的信号转导功能,一方面由谷氨酰胺浓度介导,另一方面还受碳信号α-酮戊二酸浓度的影响,二者都可以改变PⅡ蛋白的构象,影响其与相应蛋白靶标的结合,最终达到级联调控固氮网络的作用[4-5]。细胞内α-酮戊二酸的浓度不仅表示细胞的碳状态,还可以衡量细胞的氮可用性,在碳氮代谢平衡中发挥重要的作用[6-7]。PⅡ蛋白可以与α-酮戊二酸结合,每个蛋白含有3个α-酮戊二酸结合位点,不同细胞状态的PⅡ蛋白结合α-酮戊二酸数量不同,具有α-酮戊二酸传感器的功能。在PⅡ蛋白稳定的三聚体内,具有序列保守、结构灵活的T环、B环与C环,三环之间可以形成亚基间的裂缝,构成了蛋白质与配体结合的位点[8]。α-酮戊二酸主要结合于相邻亚基之间的外侧裂隙中,一般需要二价阳离子(如Mg2+)的参与。
施氏假单胞菌(Pseudomonasstutzeri)A1501是γ变形杆菌中的联合固氮菌,固氮过程受到严格的调控,大多数细菌中含有GlnB与GlnK 2种PⅡ蛋白,但在该菌中仅存在唯一的PⅡ蛋白GlnK,编码该蛋白的glnK基因突变后,固氮酶活完全丧失,表明该蛋白在固氮调控中具有十分重要的作用[9]。但是A1501菌中GlnK蛋白与信号分子互作机制尚不清楚,需要进一步的研究。本研究通过异源表达GlnK蛋白并采用微量热涌动技术体外检测了GlnK及突变蛋白与碳信号分子α-酮戊二酸的互作,以期了解A1501中碳信号分子α-酮戊二酸与关键调控蛋白的信号转导过程,进一步解析固氮菌的碳氮代谢偶联机制。
1 材料与方法
1.1 菌株、质粒及培养条件
施氏假单胞菌A1501、原核表达载体pET28a为本实验室保存;高频转化受体菌株Top10、BL21(DE3)购自北京康为世纪生物技术公司。大肠杆菌培养采用LB培养基(0.5%酵母提取物,1%胰蛋白胨,1%氯化钠及蒸馏水),37 ℃培养。
1.2 主要试剂及仪器
质粒小提试剂盒、DNA凝胶回收试剂盒及细菌DNA提取试剂盒购自上海美吉生物医药科技有限公司;无缝克隆试剂盒购自中美泰和生物技术(北京)有限公司;普通Taq酶GreenTaqMix及高保真DNA聚合酶Phanta购自南京诺唯赞生物科技股份有限公司;内切酶购自美国NEB公司;His Pur Ni-NiA琼脂糖树脂购自赛默飞世尔;TGX Stain-Free丙烯酰胺免染制胶试剂盒购自美国Bio-Rad公司;α-酮戊二酸标准品购自美国Sigma公司;蛋白标记试剂盒、优化毛细管均购自德国Nano Temper公司;实验涉及到的引物合成及测序均由生工生物工程(上海)股份有限公司完成。
Eppendorf 5424低温离心机(德国Eppendorf公司);HITACHI U-3010紫外分光光度计(日本HITACHI公司);Branson Digital SFX550超声波破碎仪(美国Branson公司);Bio-Rad Gel Doc XR+凝胶成像系统(美国Bio-Rad公司);Bio-Rad Mini-Protean 3 Electrophoresis System蛋白质电泳仪(美国Bio-Rad公司);Bio-Rad GeneAmp PCR System 9700 PCR仪(美国Bio-Rad公司);Biotek Cytation 5细胞成像微孔板检测系统(美国Biotek公司);Nano Temper Monolith NT.115微量热泳动仪(德国Nano Temper公司)。
1.3 GlnK蛋白的生物信息学分析
从Uniprot(www.uniprot.org)获得施氏假单胞菌A1501中glnK基因序列和GlnK蛋白的氨基酸序列及蛋白质分子量大小,利用NCBI和软件DNAMAN、MEGA7进行多序列比对、同源性分析及系统发育树的构建;利用Swiss modle(https://swissmodel.expasy.org)进行GlnK蛋白同源建模,利用VMD软件进行特定氨基酸显示。
1.4 GlnK、GlnK-G89A蛋白表达重组载体的构建
本研究以pET28a为目的载体,通过同源重组原理设计扩增目的片段的引物,利用无缝克隆试剂盒将目的片段与pET28a载体相连,最终通过大肠杆菌BL21(DE3)外源表达GlnK与GlnK-G89A蛋白。具体构建过程如下:选择pET28a载体的BamHⅠ和NdeⅠ作为glnK基因与GlnK蛋白G89位点突变为丙氨酸(Ala,A)的基因glnK-G89A的插入位点,根据同源重组原理设计相关基因引物(表1)。GlnK蛋白的G89位点所对应的碱基序列为基因的第265~267位的GGC,为了获得glnK-G89A基因片段,需将该位点突变为A,该氨基酸的密码子有GCU、GCC、GCA、GCG,在A1501的glnk序列中GCC较多,因此本研究选择将原碱基序列GGC突变成GCC。将含有突变位点的glnK基因片段前部分命名为glnk-G89A-1基因,含有突变位点的glnK基因片段后部分命名为glnk-G89A-2基因。利用引物GlnK-G89A-F1与GlnK-G89A-R1扩增glnk-G89A-1基因,利用引物GlnK-G89A-F2与GlnK-G89A-R2扩增glnk-G89A-2基因,最终通过引物GlnK-G89A-F1与GlnK-G89A-R2融合PCR得到含有突变位点的整个基因片段。单片段PCR反应体系(共50 μL):含50~100 ng的A1501基因组1 μL,上、下游引物各1 μL,高保真DNA聚合酶25 μL,ddH2O 22 μL。融合PCR反应体系(共50 μL):扩增得到的glnK-G89A-1和glnK-G89A-2基因产物各1 μL,上、下游引物各1 μL,高保真DNA聚合酶25 μL,ddH2O 22 μL。载体构建中涉及的PCR反应程序为:95 ℃预变性5 min ;95 ℃ 变性30 s,55 ℃退火30 s(所有基因片段,包括融合PCR,退火温度与时间相同),72 ℃延伸 3 min,30个循环 ;72 ℃终延伸5 min。载体与目的基因片段连接后转化至大肠杆菌Top10中获得克隆重组载体,测序成功后,提取质粒转化至大肠杆菌BL21(DE3)获得GlnK、GlnK-G89A蛋白表达菌株。

表1 实验所用引物列表Table 1 PCR primers used in this work
1.5 GlnK、GlnK-G89A蛋白诱导表达纯化
将37 ℃过夜培养的含有GlnK、GlnK-G89A蛋白表达载体的大肠杆菌按1%的接种量接种至含50 μg·mL-1卡那霉素(kanamycin,Km)的新鲜LB液体培养基中,37 ℃培养至OD600为0.8左右,加入IPTG使其终浓度为0.1 mmol·L-1,16 ℃、200 r·min-1培养15 h,诱导蛋白表达。5 000 r·min-1离心10 min收集菌体,加入1/20体积NTA Buffer(300 mmol·L-1NaCl,50 mmol·L-1NaH2PO4,pH 7.5)重悬菌体,超声破碎细胞(超声波破碎仪工作程序:工作3 s,间隔5 s,功率为30%,工作时长为10 min),12 000 r·min-1、45 min离心收集上清。分别使用镍柱亲和层析纯化GlnK与GlnK-G89A蛋白,使用不同咪唑浓度(10、20、60、80 和200 mmol·L-1)的NTA缓冲液梯度洗脱,EP管分别收集各梯度洗脱液,SDS-PAGE电泳检测蛋白纯化情况,确定最终洗脱浓度,大量收集GlnK、GlnK-G89A融合蛋白,采用Brandford法测定蛋白浓度,-80 ℃保存备用。
1.6 GlnK、GlnK-G89A与碳信号分子α-酮戊二酸的互作分析
利用蛋白标记试剂盒进行标记已经纯化的GlnK、GlnK-G89A蛋白,首先利用试剂盒中的Labeling Buffer置换掉目的蛋白所处的缓冲液环境,利用细胞成像微孔板检测系统测定Labeling Buffer中目的蛋白的浓度,利用公式C(μmol·L-1)=蛋白(mg·mL-1)×103/分子量(kD)计算交换完Buffer的目的蛋白的浓度;根据试剂盒荧光标记体系标记各蛋白。利用微量热泳动(microscale thermophoresis,MST)仪器的Pretest模块检测蛋白的荧光标记效率,检测合适后进行蛋白与α-酮戊二酸互作体系准备。准备16个PCR小管,1~16进行标号,向各管中加入10 μL MST Buffer,取10 μL用蒸馏水稀释好的α-酮戊二酸(pH 7.8)加入1号小管中,吸吹混匀30次,再取10 μL 1号管中混好的液体加入2号管中,吸吹混匀30次,依次2倍梯度稀释配体,最后一管吸吹混匀完毕后吸取10 μL混合液丢弃。依次向稀释好的各PCR管中加入10 μL标记好的且荧光检测合格的目的蛋白,吸吹混匀30次。向1~16号小管中放入毛细管将反应体系吸入其中。将吸满液体的1~16号毛细管依次放置于检测板,最终将检测板放入MST仪器中进行检测。
2 结果与分析
2.1 GlnK蛋白的生物信息学分析
A1501中glnK基因全长339 bp,编码蛋白含有112个氨基酸,预测分子量为12.286 kD。为了分析A1501中GlnK蛋白与其他不同属菌株蛋白的亲源关系,采用Blastp程序以A1501的GlnK氨基酸序列,与NCBI的UniProtKB/Swiss-Prot(swissport)数据库进行了序列比对,选择序列一致性高于70%的13个来自不同属菌株的蛋白序列进行了进化分析,利用MEGA7软件的非加权组平均(UPGMA)方法构建系统发育树,选择步长检验方法(Bootstrap method)对构建好的进化树进行检验,检验次数设置为500次。建树结果如图1所示。结果表明,A1501中GlnK蛋白与模式固氮菌棕色固氮菌(Azotobactervinelandii)的亲源关系最近,序列一致性可达96.43%,其次为大肠杆菌(Escherichiacoli)和肺炎克雷伯菌(Klebsiellapneumoniae),序列一致性分别为78.57%和76.79%,表明A1501中GlnK蛋白与棕色固氮菌中同源蛋白在各自体内发挥的功能可能最为相似。
利用软件MEGA7中的Clustal W对GlnK蛋白系统发育树构建过程中涉及的不同属菌株的氨基酸序列进行多序列比对,结果如图2所示,A1501中GlnK蛋白与其他12个不同属菌株中的同源蛋白相似,都具有较多的保守位点。在该蛋白中也包含PⅡ蛋白最保守的TGxxGDGKI基序,大肠杆菌点突变实验表明第89位点甘氨酸(Gly,G)的突变会使PⅡ蛋白在任何条件下都无法与小分子物质α-酮戊二酸结合,而该位点位于该基序的第7位,这表明了G89位点可能在PⅡ蛋白与α-酮戊二酸结合的过程中具有十分重要的作用。
为了进一步的了解G89位点在A1501的GlnK蛋白空间结构中所处的位置,利用Swiss-model在线建模服务器(https://swissmodel.expasy.org)的简捷模式(automatic mode)对GlnK蛋白进行结构预测,将编码GlnK蛋白的氨基酸序列通过网页提交,服务器自动在蛋白质数据库(PDB)中为目标序列寻找已知结构的同源蛋白,并以此作为模板,为A1501的GlnK蛋白建立结构模型,预测得到了多个GlnK蛋白同源模型且均完全覆盖该蛋白的所有氨基酸序列。选择与GlnK蛋白序列相似性最高的1glnk.2.A(存在于大肠杆菌)为建模模板,二者序列一致性可达78.8%,可信性较高。建模结果利用VMD蛋白结构可视化软件重新显示后如图3所示,此结构表明A1501的GlnK为同源三聚体结构,由多个α螺旋、β折叠和环状结构所组成,与已经报道的PⅡ蛋白的结构相似。α-酮戊二酸可以与PⅡ蛋白结合,一般结合位点位于蛋白环与环形成的裂缝中。在同源建模所得的GlnK蛋白三维结构可知,G89位于一个β折叠之上,较接近于环状区域。可能与环与环之间含有的由共价键形成的α-酮戊二酸结合位点相关,此处氨基酸的改变可能会影响原有蛋白与α-酮戊二酸的共价结合。

图1 系统发育分析GlnK同源蛋白在不同物种中的遗传与进化距离Fig.1 Phylogenomic analysis depicting the genetic and evolutionary distances of GlnK homologous proteins in different species

注:红色框标记序列为GlnK蛋白最保守基TGxxGDGKI,黑色框标记为G89。图2 利用CLUSTAL W对不同物种中GlnK同源蛋白的序列比对Fig.2 CLUSTAL W alignment of GlnK homologous proteins from different species
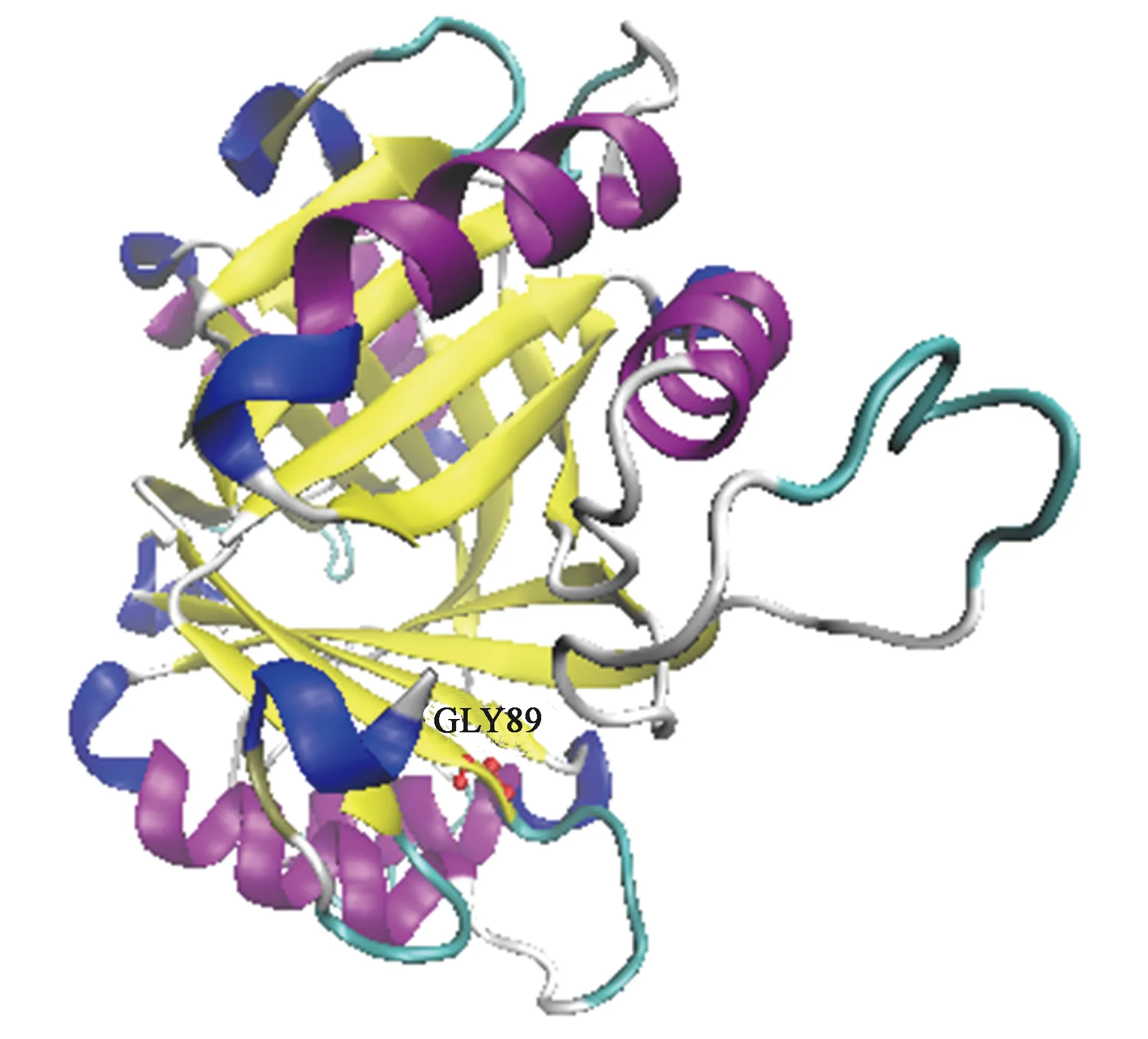
注:红色球棍为保守的GLY89。图3 侧面观察GlnK的晶体结构Fig.3 The crystal structure of GlnK viewed from the side
2.2 GlnK、GlnK-G89A蛋白的表达与纯化
为了体外得到GlnK与GlnK-G89A蛋白,构建了重组载体pET28a-glnk及pET28a-glnk-G89A,转化到宿主菌BL21(DE3)后PCR结果验证如图4、图5所示。PCR扩增片段与各目的基因片段大小一致,经测序比对为含有特定的glnK基因片段,表明表达GlnK、GlnK-G89A蛋白的菌株构建成功。随后对GlnK及GlnK-G89A蛋白进行诱导表达纯化,分别以未诱导的含有pET28a-glnK及pET28a-glnk-G89A重组载体的表达菌体为对照。SDS-PAGE凝胶电泳发现二者只有在200 mmol·L-1咪唑洗脱时分别在标准蛋白Marker的10~15 kDa处有一蛋白条带,与GlnK蛋白的分子量12.286 kDa大小较为符合,为目的条带,表明GlnK、GlnK-G89A蛋白在含有200 mmol·L-1咪唑的NTA缓冲液中被洗脱下来,并且洗脱后电泳背景清晰,没有其他的蛋白质条带,如图6、7所示,表明分离后的目的蛋白纯度较高。
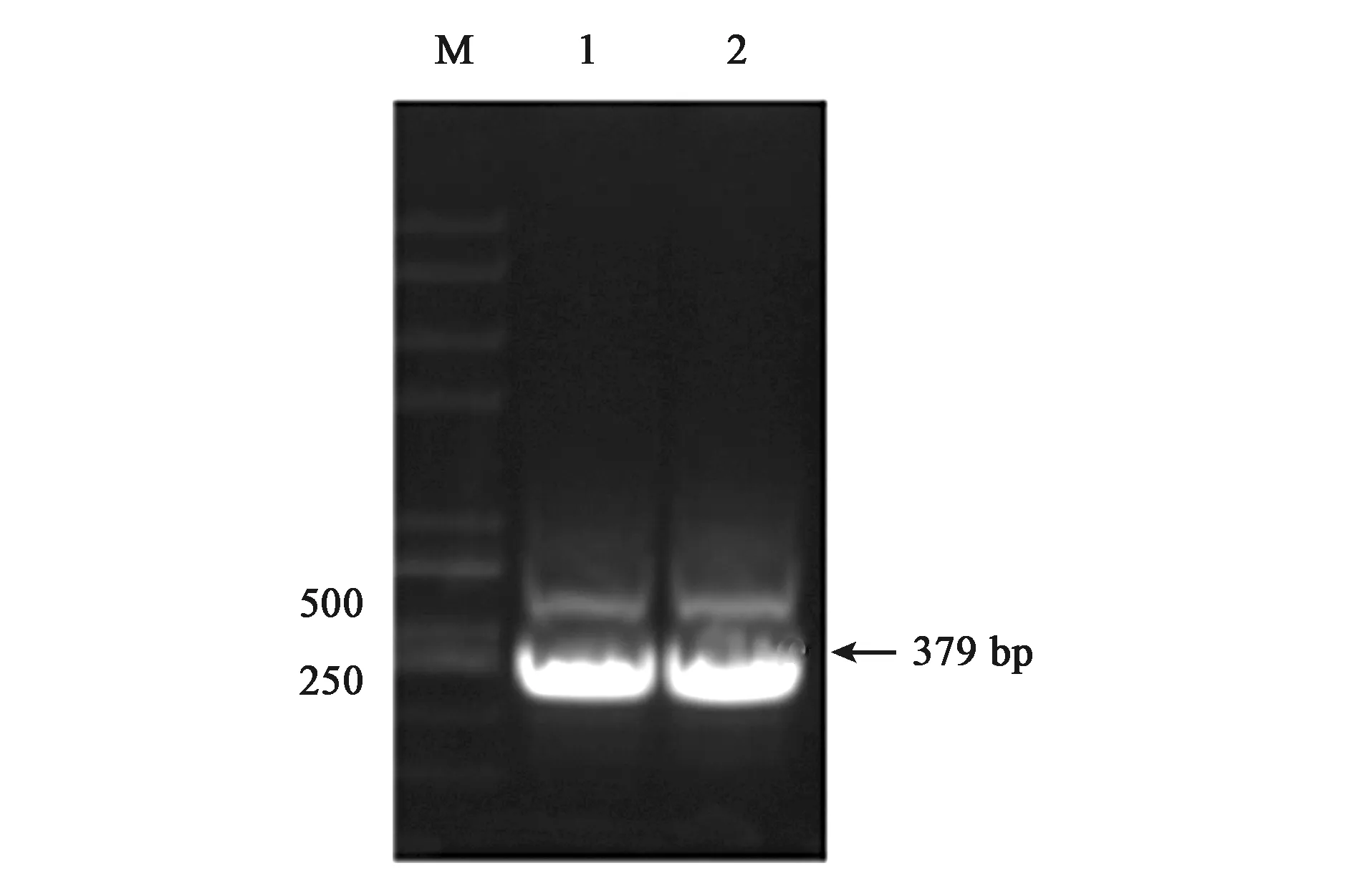
注:M—Trans2K PlusⅡ DNA Marker,1~2—全长glnk基因PCR扩增产物。图4 重组载体pET28a-glnk PCR验证Fig.4 Verification of recombinant pET28a-glnk prokaryotic expression vector
2.3 GlnK及GlnK-G89A蛋白与小分子物质α-酮戊二酸的体外互作
利用MST对GlnK、GlnK-G89A蛋白与小分子物质α-酮戊二酸的体外互作进行探索,2个蛋白在MST Buffer存在下,利用优化毛细管进行互作实验效果最好,不易发生吸附、聚集现象,可能是由于GlnK、GlnK-G89A蛋白的特殊生理特性所造成的。GlnK、GlnK-G89A蛋白与α-酮戊二酸MST互作结果如图8所示,当反应体系中GlnK蛋白浓度为1.55 μmol·L-1、α-酮戊二酸最高浓度为1.25 mmol·L-1时,可以拟合出S型曲线,信噪比为7.3,说明二者可以结合,Kd值为(9.75±4.72) μmol·L-1;而GlnK-G89A蛋白与α-酮戊二酸互作,却无法拟合出S型曲线,不能判定二者发生了结合。表明GlnK蛋白在体外可以与α-酮戊二酸结合,G89位点可能与二者互作有关,这也进一步的说明了在A1501菌中GlnK可能通过与α-酮戊二酸互作,从而参与固氮调控过程。
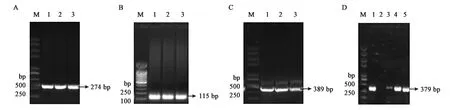
A:glnk-G89A-1基因片段扩增;B:glnk-G89A-2基因片段扩增;C:glnk-G89A-1与glnk-G89A-2片段的融合;D:重组载体pET28a-glnk-G89A PCR验证;M—Trans2K Plus II DNA Marker;图中数字均代表相应的PCR产物。图5 pET28a-glnk-G89A重组载体的PCR验证Fig.5 Verification of recombinant pET28a-glnk-G89A prokaryotic expression vector
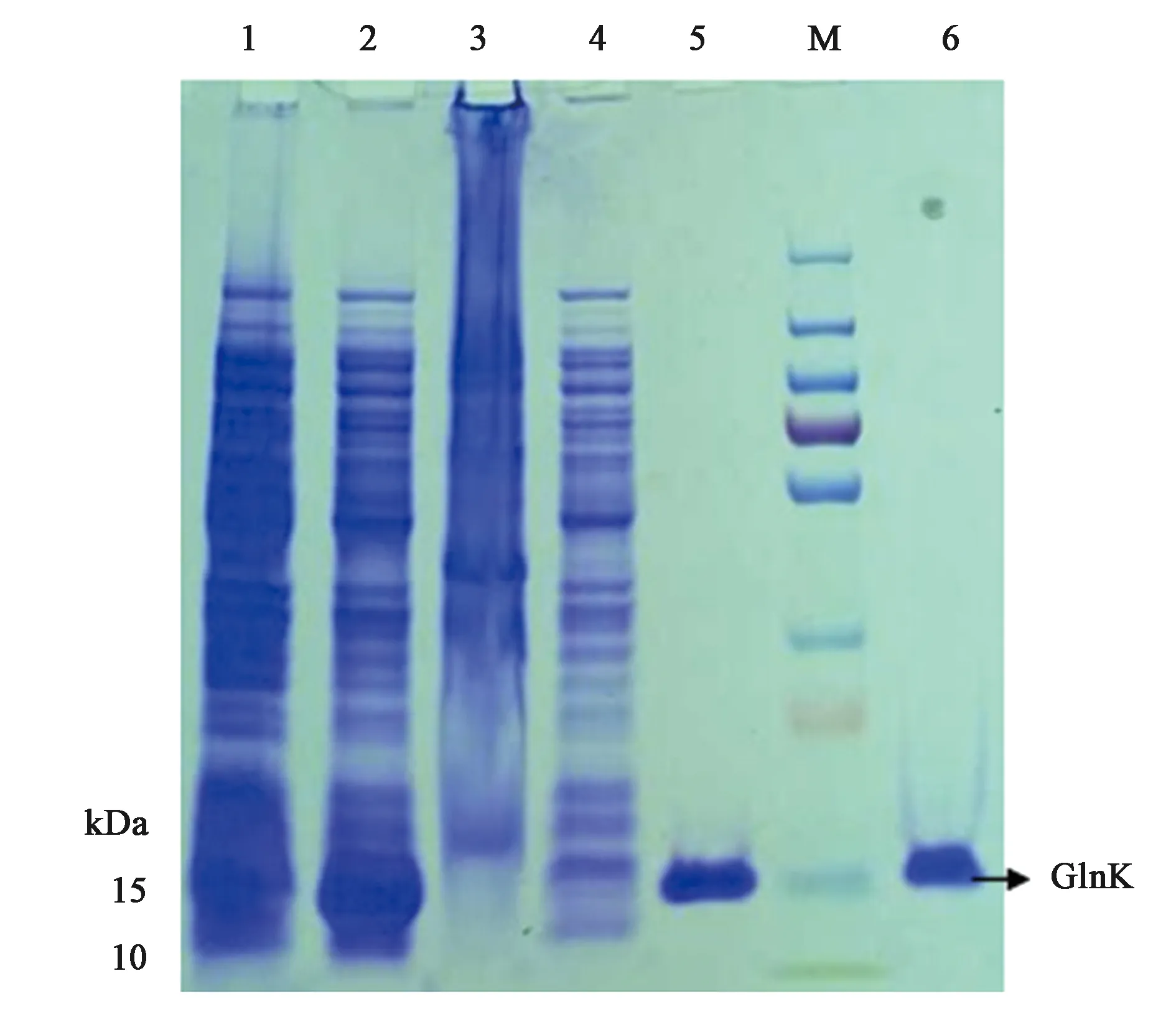
注:M—标椎蛋白分子量Marker(kD);1—未诱导细胞;2—破碎后上清;3—破碎后沉淀;4—破碎后上清第一次过分离柱滤液;5~6—洗脱液中的GlnK蛋白。图6 SDS-PAGE分析GlnK蛋白纯化Fig.6 SDS/PAGE analysis of the purification of GlnK
3 讨论
PⅡ蛋白在大多数生物中结构较为保守,在GlnB/K亚家族中,一级氨基酸序列通常含有112个氨基酸,高级结构呈现较为统一的结构构像。大肠杆菌PⅡ蛋白三聚体通常形成约30 A°的紧凑桶,每个单体包含2个α螺旋和6个β折叠,对于T环、B环与C环的稳定具有十分重要的作用[10-11]。T环是含有氨基酸最多的环,在大多数情况下,该环为PⅡ蛋白与其他靶蛋白相互作用的表面,该蛋白与小分子物质α-酮戊二酸、ATP等配体结合后会影响T环的构像,进而影响该蛋白与其他靶标蛋白的结合。B环与C环较小,B环位于中央核心位置,含有十分保守的Walker A基序,而C环的Arg101和Arg103也是PⅡ蛋白中较为保守的集团[12]。PⅡ与α-酮戊二酸的结合是该蛋白的一般特性,不同的生物体中也存在差异,研究表明枯草芽孢杆菌(Bacillussubtilis)中GlnK只能较弱的结合α-酮戊二酸,而古生菌(Archaeoglobusfulgidus)中未发现GlnK2与α-酮戊二酸的结合,但该菌的GlnK3却可以与α-酮戊二酸结合[13-14]。

注:M—标准蛋白分子量Marker(kD);1—未诱导细胞破碎后沉淀;2—未诱导细胞破碎后上清;3—诱导细胞破碎后沉淀;4—诱导细胞破碎后上清;5~7:洗脱液中的GlnK-G89A蛋白。图7 SDS-PAGE分析GlnK-G89A蛋白纯化Fig.7 SDS/PAGE analysis of the purification of GlnK-G89A

图8 α-酮戊二酸分别与GlnK蛋白、GlnK-G89A蛋白结合能力鉴定Fig.8 Determination of the binding affinity of α-ketoglutarate to GlnK and GlnK-G89A respectively by microscale thermophoresis
联合固氮菌施氏假单胞菌A1501,唯一的PⅡ蛋白GlnK在固氮调控中具有十分重要的作用,通过与其他菌株进行系统发育分析发现该菌与棕色固氮菌(Azotobactervinelandii)的亲源关系最近,其次为大肠杆菌(Escherichiacoli)和肺炎克雷伯菌(Klebsiellapneumoniae),而与巴西固氮螺菌(Azospirillumbrasilense)进化关系相对较远,可能A1501中GlnK与α-酮戊二酸结合位点与大肠杆菌的较为相似。在巴西固氮螺菌的PⅡ蛋白中,Lys58可以与α-酮戊二酸的羧基端形成盐桥,Gln39为Mg2+提供第六配体,α-酮戊二酸、ATP与Mg2+三者共同结合于PⅡ蛋白相邻亚基的裂缝及侧向裂缝中[15]。在古生菌与细长聚球藻中α-酮戊二酸与PⅡ的结合位点与之相似,在PⅡ蛋白中Gln39与Lys58都较为保守,可能与α-酮戊二酸结合有关[16-17]。大肠杆菌PⅡ蛋白突变研究表明Gln39位点突变后,虽严重的影响了该蛋白的尿苷酰化修饰,但只在一定程度上影响了与α-酮戊二酸的相互作用,而Gly89位点突变后,PⅡ蛋白在任何条件下都不能与α-酮戊二酸和ATP结合[18]。Gly89位点十分保守,处于PⅡ蛋白最保守的区域之一的Walker A基序TGxxGDGKI之中,可能与α-酮戊二酸和ATP结合有关[19]。将A1501的GlnK蛋白与其他菌的蛋白序列比对发现,GlnK也含有Walker A基序TGxxGDGKI,G89位点位于第7位。对GlnK蛋白进行同源建模,结果表明该蛋白为同源三聚体,该建模结果与模板相似度可达78.8%,表明该蛋白与已报道的PⅡ蛋白结构较为一致。
为了解析碳信号分子α-酮戊二酸在A1501中的信号传导机制,本研究采用微量热泳动技术对GlnK蛋白与碳信号分子α-酮戊二酸的体外互作进行研究,该技术与经典的研究分子互作的等温量热滴定仪(isothermal titration calorimetry,ITC)相似,灵敏度高且操作简便,并且本方法较接近天然的测定环境,可以快速的检测离子、片段、大分子等各种生物分子之间的相互作用,是一种新的检测生物分子互作技术[20-21]。微量热泳动结果表明A1501的GlnK可以与α-酮戊二酸体外结合,并且与大肠杆菌相似,G89位点在结合的过程中起关键作用。本研究将G89位点突变为了A,根据K-D法所定义的20种氨基酸疏水特性的参数表[22]发现G疏水性参数为0.4,而G89突变后的A为1.8,疏水性增加,更加容易暴露于蛋白质表面,可能对结合于环与环裂缝的α-酮戊二酸产生了空间位阻,影响了二者的结合。然而该位点突变是否影响GlnK蛋白在固氮调控中的作用,还需进一步研究证实。但该结果为进一步的解析碳信号分子α-酮戊二酸在A1501中的信号转导奠定了基础,也为深入解析不同固氮菌的碳氮代谢偶联机制提供了理论支持。
