重组猪胰蛋白酶在制备狂犬病疫苗(鸡胚成纤维细胞)中的应用
2021-01-19顾玉林牛彪阮俊程张亚静解丽霞陈磊苏波田大勇
顾玉林,牛彪,阮俊程,张亚静,解丽霞,陈磊,苏波,田大勇
上海青赛生物科技有限公司,上海201500
动物源性胰蛋白酶(简称胰酶)是从动物胰脏中分离纯化获得的,其作为重要的原料,在原代及传代细胞基质的制备过程中具有重要的作用。
目前,国内生物制品企业使用的胰酶几乎均为动物源性产品(猪源或牛源)。尽管该类产品的生产及质控过程受到了严格的监管[1-2],但由于猪及牛均可携带数种人畜共患性病原[3-4],因此,动物源性胰酶的使用仍对疫苗安全性具有潜在的风险[5]。近年来发生了多起因动物源性胰酶的使用而造成生物制品被外源因子污染的案例[6-8]。如2010 年,葛兰素史克(GSK)公司生产的口服轮状病毒疫苗被检测出含有Ⅰ型猪圆环病毒(porcine circovirusof type 1,PCV1)核酸成分,溯源调查发现,PCV1 可能来自疫苗生产使用的Vero 细胞库,胰酶则成为重点怀疑对象[9]。尽管 PCV1 对人类无致病性[10-13],但该事件仍然引起了人们对动物性产品使用的广泛思考,并逐步认识到用非动物源性产品替代动物源性原辅料是必然趋势,对于进一步提高人用生物制品安全具有重要的意义。
重组猪胰酶由基因工程菌生产,其氨基酸序列与猪胰腺来源的胰酶完全一致,特异性相同[14]。重组猪胰酶相对分子质量约为24 000,最适工作pH为7 ~10。与动物源性胰酶相比,重组胰酶杂质少,一般通过亲和层析的方式纯化,产品纯度极高,几乎不含杂蛋白成分;消化效果更好,因不含各种动物源性蛋白(尤其是糜蛋白酶等),不会对消化效果产生负面影响[14-15];生产过程中不使用任何有活性的动物源性原辅料,无外源因子污染的风险。
本文研究了原核系统表达的重组猪胰酶在原代鸡胚成纤维细胞(chicken embryo fibroblast,CEF)制备过程中的最适工作浓度,并比较了狂犬病病毒在重组猪胰酶及猪胰酶消化的CEF 细胞中的病毒滴度。
1 材料与方法
1.1 病毒、细胞及鸡胚 狂犬病病毒Flurry HEP 株工作种子(滴度:7.0 lgCCID50/ mL,批号:20171001)及BSR 细胞(代次:P 45)均由上海青赛生物科技有限公司制备和保存;SPF 级鸡胚(10 日龄,批号:2018-0810)购自浙江立华农业科技有限公司。
1.2 主要试剂及仪器 重组猪胰酶(批号:RPT171-201)购自上海雅心生物技术有限公司;猪胰酶(批号:1957852)购自美国Gibco 公司;配方营养液培养基(批号:PD201808008)及胰酶兔源多克隆抗体(批号:20190318)为上海青赛生物科技有限公司自制;胎牛血清(批号:201803015)购自兰州荣晔生物技术有限公司;牛血清白蛋白(批号:EZ241A400)购自德国BIOFROXX 公司;超敏ECL 发光试剂盒(批号:P0018S)购自上海碧云天生物技术有限公司;狂犬病病毒荧光抗体(批号:526056)购自美国FDI 公司;12% SDS-PAGE 预制胶(批号:1808170)及 DMEM培养基(批号:2004656)购自英潍捷基(上海)贸易有限公司;HRP-羊抗兔 IgG 抗体(批号:BST13C23C55)购自武汉博士德生物工程有限公司;PVDF 膜(批号:1620177)及蛋白电泳仪购自美国BIO-RAD 公司;BIO-5000Plus 凝胶扫描仪购自上海中晶科技有限公司;Amersham Imager680 发光成像仪购自美国GE 公司;R1 全自动细胞计数仪购自日本OLYMPVS公司。
1.3 重组猪胰酶及猪胰酶样品分析鉴定 采用SDSPAGE 及Western blot 法。分别取猪胰酶及重组猪胰酶检测样品2 μL,用预制胶进行SDS-PAGE,考马斯亮蓝染色30 min,去离子水脱色过夜;凝胶扫描仪拍图,使用Image J 软件分析猪胰酶及重组猪胰酶蛋白条带的灰度值,并计算胰酶蛋白条带占总蛋白条带的比例。电泳完成后,将分离的蛋白湿转至PVDF 膜,放入含1%牛血清白蛋白的TBST 中,4 ℃,30 r / min 水平摇床封闭过夜;加入胰酶兔源多克隆抗体(1 ∶2 000 稀释),常温 30 r / min 水平摇床上孵育 2 h;TBST 洗涤 3 次,10 min / 次,加入 HRP-羊抗兔 IgG 抗体(1 ∶3 000 稀释),常温 30 r / min 水平摇床孵育 45 min;TBST 洗涤 3 次,15 min / 次,加入超敏ECL 发光试剂,曝光检测结果。
1.4 消化原代CEF 的重组猪胰酶最适工作浓度筛选基于猪胰酶消化制备原代CEF 成熟的方法。用PBS配制猪胰酶浓度为1.25 mg / mL,重组猪胰酶浓度分别为 1、0.25、0.062 5 和 0.015 625 mg / mL。取活性良好的10 日龄鸡胚25 枚,胚胎用PBS 清洗3次,用剪刀将胚胎剪碎成2 ~3 mm 组织块,分别加入不同浓度的重组猪胰酶及猪胰酶,摇匀,置37 ℃水浴消化16 min(期间轻轻摇晃1 次);加入终浓度10%胎牛血清终止消化,弃上清液;PBS 洗涤2次,吸管轻轻吹打消化后的组织块,至全部形成单个细胞,细胞悬液用细胞生长液定容至400 mL,过滤后进行细胞计数并计算细胞活率。将上述细胞悬液分装至 T75 细胞瓶(30 mL / 瓶),每个消化浓度分装 3瓶,置37 ℃培养箱培养,24 h 后换液及拍照;48 h 后各取 1 瓶,用 2.5 mg / mL 猪胰酶消化细胞并计数,计算细胞增殖比;其余细胞瓶继续培养至96 h 拍照,每日观察细胞状态。试验重复3 次。
1.5 重组猪胰酶对狂犬病病毒滴度影响的检测 分别用0.062 5 mg / mL 重组猪胰酶及 1.25 mg / mL猪胰酶按1.4 项方法消化原代CEF;分别将2 种细胞悬液浓度调整为1.2×106和1.7×106个/mL,以MOI = 0.01 悬浮接种狂犬病病毒Flurry HEP 株工作种子,混匀后分装至 T225 细胞培养瓶,80 mL / 瓶,34 ℃培养24 h;换细胞维持液继续培养,分别于换液后 24、48、72、96、120、144 及 168 h 取样,0.5 mL /次,采用直接荧光免疫染色法检测病毒滴度。将病毒样品用DMEM 培养基进行10 倍系列稀释至1 ×10-6倍;每个稀释度取 10 μL 加入 96 微孔板中,每个稀释度接种6 个复孔。加入已消化制成的(1.5 ~2.5)× 105个 / mL BSR 细胞悬液,90 μL / 孔,置34 ℃,5% CO2培养箱培养 48 h;取出 96 微孔板加入丙酮,100 μL / 孔,静置 1 min 后倾倒,再加入丙酮,200 μL / 孔,-20 ℃冻存 1 h;PBS 洗涤 3 次,加入狂犬病病毒荧光抗体,50 μL / 孔,37 ℃孵育 1 h;PBS 洗涤3 次。荧光显微镜下观察并记录阳性孔数。试验重复3 次。
1.6 统计学分析 采用GraphPad Prism 6 软件进行统计学分析,实验数据以表示,组间比较采用t 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 重组猪胰酶及猪胰酶样品分析鉴定 经12%SDS-PAGE 及Western blot 分析,猪胰酶含有多条低于相对分子质量15 000 的蛋白条带,重组猪胰酶仅含1 条介于相对分子质量20 000 ~25 000 的蛋白条带,见图1。猪源胰酶及重组猪胰酶样品中胰酶占总蛋白的比例分别为33%和100%,表明重组猪胰酶的纯度更高。
2.2 消化原代CEF 的最适重组猪胰酶浓度 结果显示,随着重组猪胰酶浓度的降低,原代CEF 细胞的活率逐步升高;与1.25 mg / mL 猪胰酶比较,猪胰酶浓度为 0.062 5 mg / mL 时,CEF 细胞活率、单胚细胞收获量及体外培养48 h 的细胞增殖比差异均无统计学意义(t分别为 1.41、0.78 和 0.55,P 分别为 0.23、0.48 和 0.61)。见图 2 ~ 4。显微镜观察显示,培养 96 h 后,浓度为 1 及 0.25 mg / mL 重组猪胰酶消化的原代CEF 出现明显的脱落或拉网,浓度0.062 5 及 0.015 625 mg / mL 消化的 CEF 细胞表现为纤维拉伸及形态正常,均与1.25 mg / mL 猪胰酶消化的细胞在形态学上无明显变化,见图5。选择重组猪胰酶最适工作浓度为0.062 5 mg / mL。
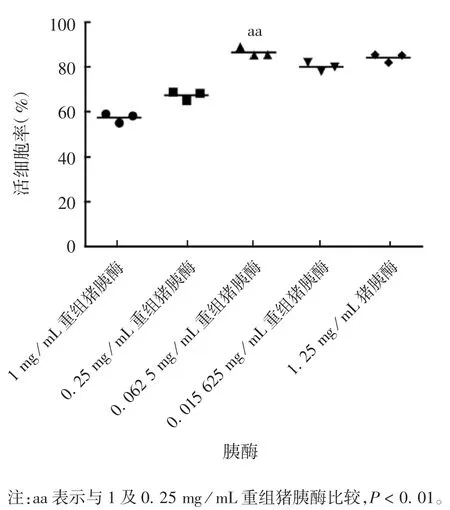
图2 重组猪胰酶及猪胰酶消化后CEF 细胞活率Fig.2 Viabilities of CEFs digested with recombinant porcine trypsin and with porcine trypsin
2.3 重组猪胰酶对狂犬病病毒滴度的影响 结果显示,狂犬病病毒在2 种胰酶制备的原代CEF 中的生长特性差异均无统计学意义(t = 0.11,P = 0.35),病毒滴度均在换液后96 h 达到峰值后迅速下降;CEF 浓度为 1.2 × 106个 / mL 组换液 96 h 后,重组胰酶制备的细胞的病毒滴度略高于猪源胰酶制备的细胞,但差异无统计学意义(t = 4.0,P > 0.05)。见图6。

图3 重组猪胰酶及猪胰酶消化后单胚细胞收获量Fig.3 Yield of CEFs in a single embryo digested with recombinant porcine trypsin and with porcine trypsin

图4 重组猪胰酶及猪胰酶消化48 h CEF 的增殖比Fig.4 Proliferation ratios of CEFs digested with recombinant porcine trypsin and with porcine trypsin

图5 重组猪胰酶及猪胰酶消化后CEF 细胞形态显微镜观察(标尺:800 μm)Fig.5 Microscopy of CEFs digested with recombinant porcine trypsin and with porcine trypsin(bar = 800 μm)
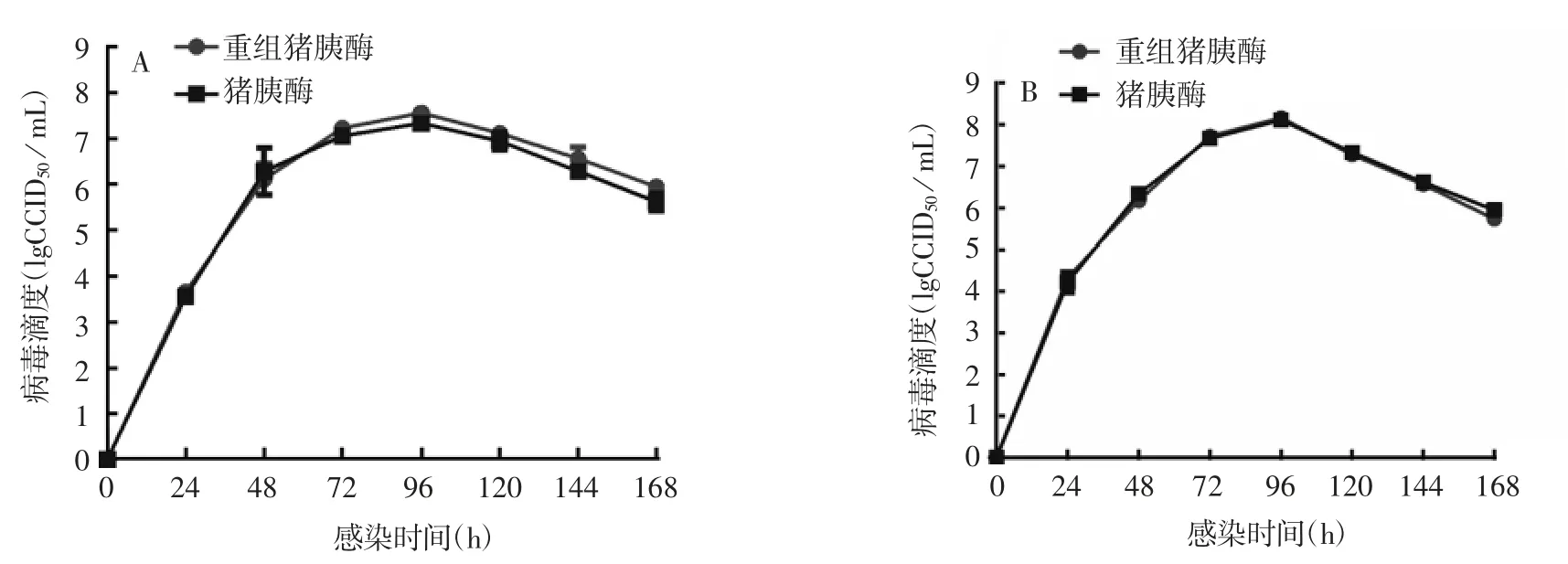
图 6 重组猪胰酶及猪胰酶制备的 1.2 × 106 个 / mL(A)和 1.7 × 106 个 / mL(B)CEF 的狂犬病病毒滴度Fig.6 Rabies virus titers in CEFs at concentrations of 1.2 × 106 cells / mL(A)and 1.7 × 106 cells / mL(B)digested with recombinant porcine trypsin and with porcine trypsin
3 讨 论
重组猪胰酶中几乎无杂蛋白成分,酶活性更高,其工作浓度远低于传统的猪源胰酶。在消化CEF的过程中,胰酶的实际使用量极大的减少,更利于胰酶残留指标的控制,对提高狂犬病疫苗产品的质量具有积极意义。
尽管目前重组猪胰酶在原代CEF 制备方面的成本远高于猪胰酶,但由于胰酶在狂犬病疫苗(CEF 细胞)的总成本中所占比例极小,使用重组胰酶并不会显著增加疫苗成本及企业负担。随着企业对重组猪胰酶需求量增加,重组猪胰酶的产能和生产工艺定会逐步提高和完善,重组猪胰酶价格下降也是必然趋势。
WHO 在生物学标准化委员会第65 号报告中指出,重组胰酶可用且应该被推荐使用[16]。《中国药典》三部(2015)版和《欧洲药典》8.0 版也明确要求,动物源胰酶用于疫苗生产时,需检测胰酶相关的外源性病毒,包括猪细小病毒、牛细小病毒、PCV等[5,17-18]。因检测方法灵敏度的限制,目前不能完全消除外源性病毒污染的风险。而对于用动物源胰酶作为原料生产的减毒活疫苗,由于最终产品未经灭活工艺处理,外源因子污染的风险始终不能忽视。
重组胰酶或许应在减毒活疫苗生产中先行推广,并逐步全面应用到基于组织培养的疫苗生产过程中。本研究为重组猪胰酶在狂犬病疫苗(CEF 细胞)生产中的应用提供了数据支持。
