同型半胱氨酸致神经管畸形小鼠模型的建立及其作用机制
2021-01-19高亚杰张建林张蘋王振东李佰一张晓敏王文卓牛勃
高亚杰,张建林,张蘋,王振东,李佰一,张晓敏,王文卓,牛勃,2
1.山西医科大学基础医学院,山西太原030001;2.首都儿科研究所儿童发育营养组学北京市重点实验室,北京100020
神经管畸形(neural tube defect,NTD)是一种常见的严重中枢神经系统先天性畸形,包括脑膜(脑)膨出、无脑、脊柱裂、颅脊柱裂等多种不同的临床类型,该病在中国北方发病率较高,可达12‰[1]。NTD 的病因较复杂,包括遗传因素、生活方式和环境因素[2-4]。同型半胱氨酸(homocysteine,Hcy)为人体必需氨基酸甲硫氨酸的中间代谢物,是一种含硫氨基酸,主要经两条途径进行代谢,一是经甲硫氨酸循环进行再甲基化:在蛋氨酸合酶作用下,Hcy 接受5-甲基四氢叶酸提供的甲基,以VB12为辅酶重新合成甲硫氨酸;二是转硫化途径:在胱硫醚-β-合成酶(cysta-thionine-βsynthase,CBS)的催化下,Hcy 与丝氨酸缩合成胱硫醚,该过程以VB6作为辅酶。Hcy 的两条代谢途径互相协调制约,其中涉及的酶与辅酶活性下降均会导致体内Hcy 水平异常。有报道表明,NTD 患儿的母亲血浆Hcy 水平明显升高,还有部分NTD 患儿羊水中的Hcy 含量比正常胎儿高[5],高Hcy 血症与NTD的发生密切相关,孕期母体Hcy 水平的升高会干扰胎儿神经管的闭合[5-7],但关于Hcy 导致NTD 的具体机制尚未明确。
目前,已建立了 Hcy 致 NTD 的鸡胚模型[8-9],大多数相关研究均是在该基础上进行的。小鼠作为哺乳动物,其胚胎发育较鸡胚更接近人类胎儿发育模式,且遗传学背景清楚。有研究证明,高热[10]、高血糖[11]、环磷酰胺[12]或甲氨蝶呤[13]可诱导 NTD 动物模型神经细胞的无序增殖和凋亡。因此,在神经管的形成过程中,细胞的增殖和凋亡必须保持动态平衡,维持神经上皮的适当增殖对神经管的闭合至关重要。由于Hcy 易氧化分解,因此本研究用同型半胱氨酸硫代内酯(homocysteine thiolactone,HTL)代替Hcy,以单独使用HTL 及联合CBS 抑制剂氨基氧乙酸(aminooxyacetic acid,AOAA)两种方法进行 NTD 小鼠建模,选择最优方案进行后续试验,并探讨NTD形成的作用机制。
1 材料与方法
1.1 主要试剂 HTL 购自美国Sigma-Aldrich 公司;羧甲氧基胺半盐酸盐及二硫苏糖醇购自中国Aladdin 公司;小鼠S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)ELISA 试剂盒及小鼠 S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH)ELISA 试剂盒购自上海通蔚生物科技有限公司;小鼠Hcy ELISA 检测试剂盒购自中国Yad 公司;5-乙炔基-2′-脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)及 YF®555 Click-iT EdU Stain Kits 购自中国 US Everbright®Inc.;兔抗小鼠增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)多克隆抗体、兔抗 β-tubulin 多克隆抗体及HRP 标记的山羊抗兔IgG 购自武汉三鹰生物科技有限公司;RIPA 裂解液购自上海雅酶生物科技有限公司。
1.2 实验动物 SPF 级 C57BL / 6J 小鼠,7 ~ 8 周龄,体重20 ~23 g,购自山西医科大学实验动物中心,动物合格证号为:SCXK(晋)2015-0001。
1.3 动物模型的建立 将 C57BL / 6J 小鼠置 22 ℃,12 h 光照 / d 适应性饲养 1 周。雌雄小鼠按 1 ∶1 比例合笼过夜;次日早8 点检查雌鼠阴栓,有阴栓者确定为孕0.5 d,将孕鼠随机分为8 组,每组8 只。将HTL 与AOAA 分别溶解于生理盐水,HTL 组的给药剂量分别为 100、300、500、700 mg /(kg·d),HTL +AOAA 组 HTL 剂量分别为 400、500、600 mg /(kg·d),AOAA 剂量为 30 mg /(kg·d),同时设正常对照组(等量生理盐水)。给药途径均经腹腔注射,于孕6.5 ~10.5 d 连续给药,每日1 次。于孕11.5 d 脱颈处死小鼠,取胚胎,测量顶臂长度、称重,并观察胚胎发育情况。选择单独及联合给药建模的最佳剂量组,分别进行3 次重复试验,以验证NTD 发生率的稳定性。发育迟缓定义为整个胚胎体重、顶臀长度显著降低或形态特征显著落后。4%多聚甲醛固定胚胎标本用于脑部连续切片,切片HE 染色观察神经管。采用最佳剂量建立的孕鼠模型(55 只)进行后续试验(NTD 组)。
1.4 代谢物含量的检测 于末次给药后0、2、4、8、12、24 h 收集NTD 组及正常对照组孕鼠的血液和胚胎脑组织样本(不同时间点每组取8 只孕鼠,每只孕鼠取3 个胚胎脑组织,混为1 个样本)。血液于室温放置 20 min,4 ℃,200 × g 离心 10 min,取上清 20 μL,与 20 μL 的 10 mmol / L 二硫苏糖醇溶液混匀,37 ℃温育30 min;采用小鼠Hcy ELISA 试剂盒进行检测。胚胎脑组织在匀浆缓冲液中进行超声粉碎,4 ℃,17 530×g 离心5 min,取上清,采用小鼠SAM 及SAH ELISA 试剂盒进行检测。
1.5 胚胎神经上皮细胞增殖的检测 于末次给药后11 h,取 NTD 组及正常对照组孕鼠各3 只,经腹腔注射 EdU,5 mg / kg。注射 13 h 后脱颈处死,每只孕鼠取1 个胚胎,用4%多聚甲醛固定,脑部连续切片,每个胚胎随机选择3 张切片,采用YF®555 ClickiT EdU Stain Kits 进行EdU 荧光增殖检测。每张切片随机选取6 个相同大小的视野,计数阳性细胞的平均数。
1.6 胚胎增殖相关蛋白表达水平的检测 采用Western blot 法。于末次给药后24 h,取NTD 组及正常对照组各4 只,每只孕鼠取其5 个胚胎脑组织,混合作为1 个样本。用RIPA 裂解液提取总蛋白,BCA 法测定蛋白浓度。经10% SDS-PAGE 分离蛋白后,转移至PVDF 膜上,用5%BSA 室温封闭1 h;加入兔抗小鼠PCNA 多克隆抗体(1 ∶8 000 稀释)及兔抗β-tubulin多克隆抗体(1 ∶1 000 稀释),4 ℃孵育过夜;TBST 洗涤 3 次,加入 HRP 标记的山羊抗兔 IgG(1 ∶5 000 稀释),室温孵育 2 h;TBST 洗涤 3 次,ECL 显色。
1.7 统计学分析 应用SPSS 20.0 统计学软件进行统计分析,建模中最佳剂量重复试验及EdU、Western blot 结果的比较均采用 t 检验,Hcy、SAM、SAH 含量的组间比较采用单因素方差分析(ANOVA),均以P <0.05 为差异有统计学意义。
2 结 果
2.1 动物模型的建立 对照组胚胎表型正常,HTL 组与HTL+AOAA 组随着剂量的升高,吸收胎与发育迟缓胚胎的比例均增高。HTL 组剂量达 500 mg /(kg·d)时,NTD 胚胎比例达最高(28.3%),且该剂量的吸收胎比例相对较低,因此500 mg /(kg·d)为 HTL 单独造模的最佳剂量;同理确定 500 mg /(kg·d)HTL +30 mg /(kg·d)AOAA 为联用组的最佳造模剂量。见表1。联用组3 次重复试验间差异无统计学意义(t =1.157,P > 0.05),HTL 组 3 次重复试验间差异有统计学意义(t = 4.976,P < 0.05),重复性不佳,NTD 发生率不稳定,见表2。因此选择500 mg/(kg·d)HTL+30 mg /(kg·d)AOAA 作为 Hcy 致 NTD 的最佳造模剂量。孕11.5 d 正常对照组胚胎外形完整,头部前、中、后脑泡饱满圆润,眼泡发育正常,神经管闭合完全。畸形胚胎中,中后脑畸形发生率最高(67.4%),偶见颅面部畸形、无眼畸形、小眼畸形;发育迟缓的胚胎表型未见任何畸形,但其顶臀长度及形态特征显著落后于正常发育胚胎。见图1。

表1 不同给药剂量对小鼠胚胎发育的影响Tab.1 Influence of dosage of HTL on embryonic development of mice
表2 最佳剂量诱导NTD 的重复试验结果Tab.2 Repeat test result of induction of NTD by optimal protocol

图1 正常及Hcy 所致异常发育胚胎的表型观察Fig.1 Phenotype of normal embryo and abnormal embryonic development caused by Hcy
2.2 组织病理学检测 正常对照组胚胎神经管已闭合,发育良好,管腔规则,内外界膜光滑,神经上皮细胞排列紧密整齐。NTD 胚胎端脑虽形成但管腔不规则,管壁厚薄不均,内外界膜不平整;后脑顶板并未完全融合,周围间充质细胞分布不均。见图2。
2.3 孕鼠血液及胚胎脑组织中代谢物的水平 给药后2 h,孕鼠血液中Hcy 含量显著升高(F=17.251,P < 0.01),24 h 基本恢复正常。胚胎脑组织 SAH 含量给药后 4 h 达峰值(F = 10.183,P < 0.01),24 h未恢复正常;SAM 于给药后2 h 显著升高(F = 5.562,P < 0.01),24 h 时略高于正常水平。给药后 2 h,SAM / SAH 比值与对照组差异无统计学意义(F =0.538,P > 0.05),8 h 时最低(F = 4.719,P < 0.01)。见图3。
2.4 胚胎神经上皮细胞的增殖情况 正常对照组及 NTD 组 EdU 阳性细胞百分比分别为 68%和25%,与对照组相比,NTD 组胚胎神经上皮细胞增殖受到显著抑制(t = 8.25,P < 0.05),见图 4。
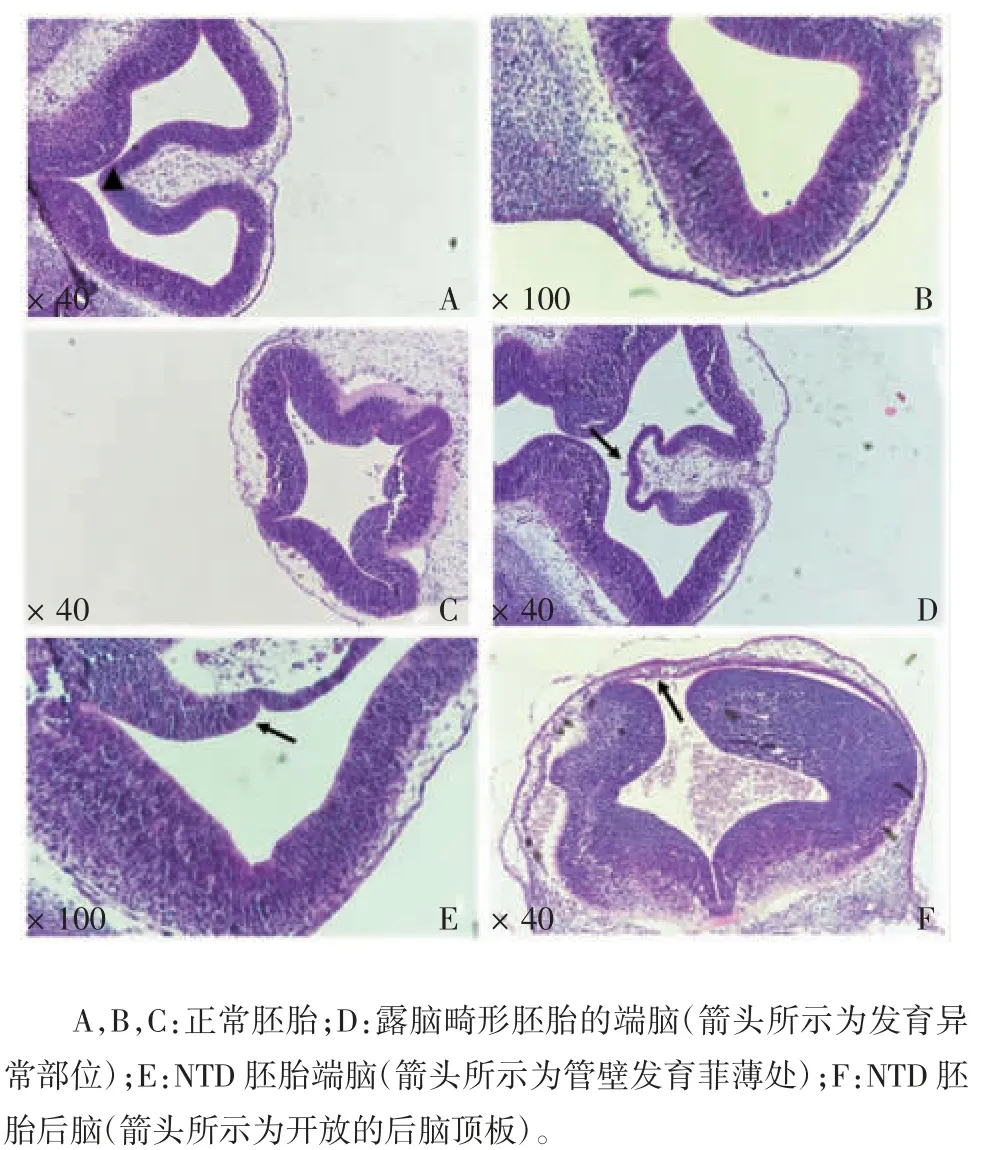
图2 正常对照组和NTD 组胚胎神经管组织病理学检测结果(HE 染色)Fig.2 Histopathological examination of neural tubes in normal embryos and embryos with NTD(HE staining)
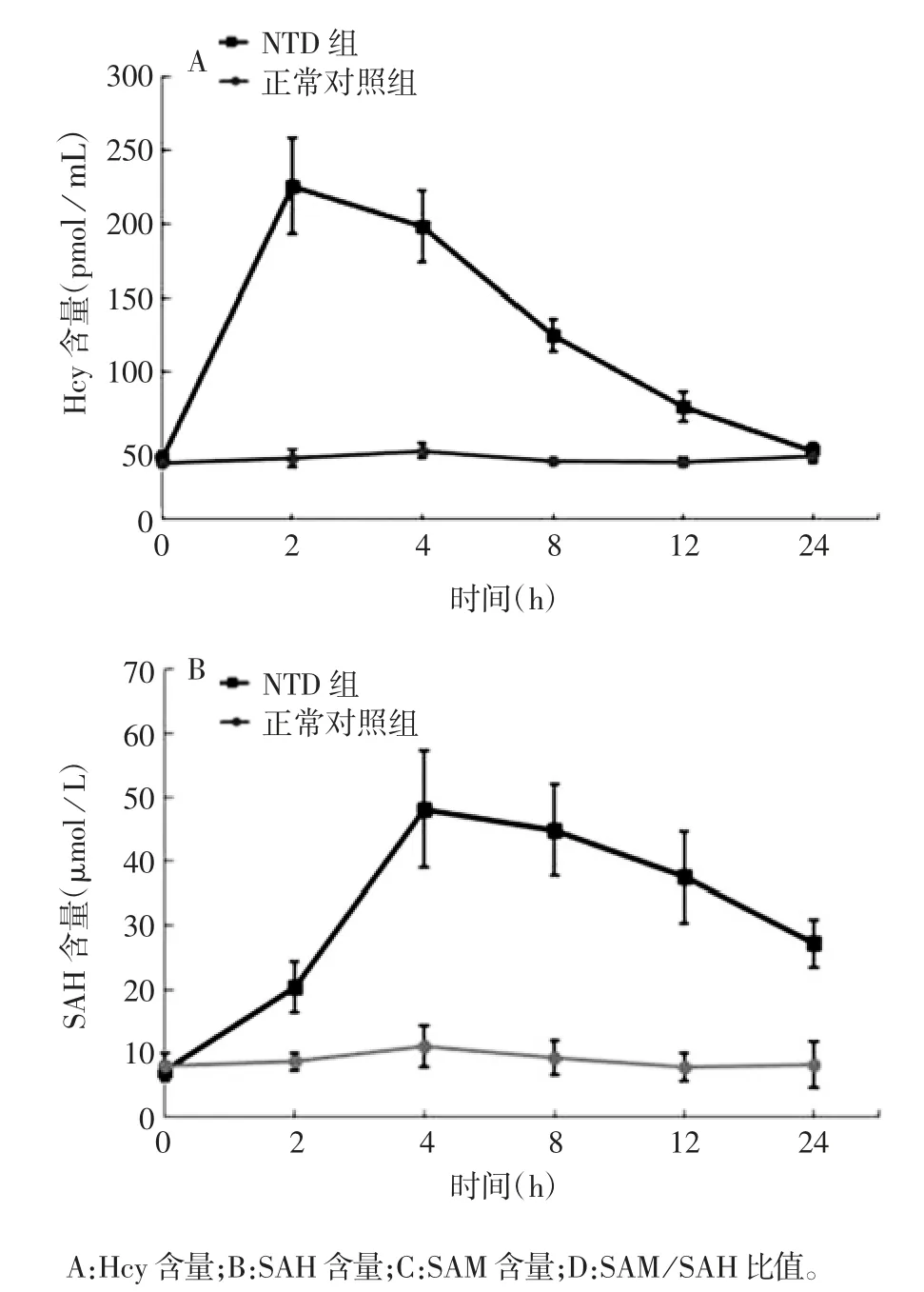
图3 孕鼠血液及胚胎脑组织中代谢物的检测结果Fig.3 Determination results of metabolites in blood of pregnant mice and embryonic brain tissue

续图3 孕鼠血液及胚胎脑组织中代谢物的检测结果Fig.3 (Continued)Determination results of metabolites in blood of pregnant mice and embryonic brain tissue

图4 各组小鼠胚胎神经上皮细胞的增殖情况(× 100)Fig.4 Proliferation of embryonic neuroepithelial cells of mice in various groups(× 100)
2.5 胚胎增殖相关蛋白的表达水平 正常对照组及NTD 组PCNA 的相对表达量分别为0.96 和0.28。与正常对照组比较,NTD 组PCNA 的表达量显著下降(t = 12.47,P < 0.05),见图 5。表明 NTD 胚胎脑组织细胞增殖减少。
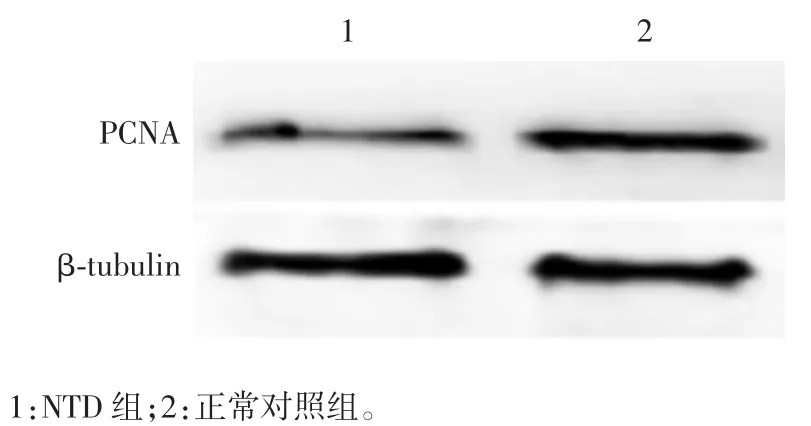
图5 Western blot 法检测小鼠胚胎脑组织PCNA 蛋白的表达Fig.5 Western blotting of PCNA expression in embryonic brain tissue of mice
3 讨 论
NTD 是一种由遗传和环境因素共同作用而产生的严重神经系统疾病,可导致胎儿及围生儿的死亡。调查发现,生育过或怀有NTD 胎儿的孕妇其血Hcy水平明显高于正常值[5,14],提示母体高 Hcy 可能是NTD 的危险因素之一。
Hcy 虽不参与蛋白质的合成,但可将叶酸、维生素B6及维生素B12等代谢相互联系起来。Hcy 及其氧化产物大部分经由二硫键与蛋白质结合形成混合二硫化物,其他皆以游离形式存在。结合及游离Hcy 统称为血中总Hcy。目前研究认为,引起高Hcy 血症的原因主要有遗传和营养因素,遗传因素指由Hcy代谢相关酶的基因突变或缺陷所引起的相关酶活性的下降而导致的Hcy 蓄积[15];营养因素主要指营养不平衡所致的高Hcy,如维生素B6、B12或叶酸缺乏所致的Hcy 升高。另外,吸烟、饮酒、药物、性别、年龄等因素也会影响体内Hcy 的含量[16-18]。当体内Hcy 升高后,可经氨基酰-tRNA 合成酶(MetRS)编辑矫正形成HTL[19-20],HTL 的结构较 Hcy 更加稳定。蓄积的 Hcy及其衍生物,对神经管的发育具有毒性作用[21]。
本实验选择HTL 与CBS 抑制剂AOAA 联合作用进行建模,结果显示,与HTL 单独造模比较,联用组NTD 的发生率更高且更稳定,表明血浆Hcy 主要通过甲硫氨酸循环相关途径引起NTD。孕6.5 ~10.5 d 给药期覆盖小鼠神经管发育的整个过程,多数胚胎即使表型正常,其切片神经管也可看到不同程度的发育受损。ELISA 检测结果显示,NTD 组Hcy显著升高;SAH 的升高明显于SAM,导致SAM / SAH比例下降。Hcy 可通过调节甲基化发挥其致病作用[22-24]。SAM 是甲基化反应的底物和主要甲基供体,而SAH 则是甲基化反应的产物和有效抑制剂,SAM / SAH 比值被认为是判断甲基化程度的有用指标[25],其比率的降低与细胞中低甲基化水平相对应。DNA 甲基化障碍将干扰基因对神经管闭合的调节[5,21]。EdU 是一种胸腺嘧啶核苷类似物,其能代替胸腺嘧啶渗入正在合成的DNA 分子中,因此借由荧光染料与EdU 的特异反应可以直接检测Hcy 对神经上皮细胞增殖的影响。PCNA 只存在于正常增殖细胞与肿瘤细胞中,是反映细胞增殖状态的良好指标。本研究结果显示,NTD 胚胎细胞增殖明显减少,表明Hcy 可通过抑制细胞增殖诱导NTD 的发生。
本实验以HTL 联合AOAA 给药,成功诱导了NTD 小鼠模型,操作方法简单,实验重复性好,致畸率较高,为研究人体内Hcy 致NTD 的机理提供了良好的动物模型,为后续研究奠定了基础。
