胆固醇在高脂高胆固醇诱导非酒精性脂肪性肝炎发生发展过程中的动态作用
2021-01-19胡鑫丽张文慧王瑞君王博文陈星旭宋维芳
胡鑫丽,张文慧,王瑞君,王博文,陈星旭,宋维芳
山西医科大学汾阳学院,山西汾阳032200
非酒精性脂肪性肝病(non-alcoholic fattyliver disease,NAFLD)已成为世界范围内最常见的慢性肝脏疾病,且正迅速成为终末期肝病及肝移植的主要原因[1-2]。非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是一种严重 NAFLD 的进展形式[2],以肝细胞脂肪变性、肝细胞损伤、不同程度的肝脏炎症及纤维化为特征[3],其病死率高,若不干预治疗,将不可逆地进一步发展为肝纤维化、肝硬化甚至肝癌[4],因此,控制NASH 的发生发展逐渐引起临床治疗的重视。目前导致进行性NASH 发生发展的因素尚不清楚,临床发现NASH 患者肝脏中的胆固醇含量明显升高[5],另外,有研究表明,过量的膳食胆固醇升高会导致动物模型实验性NASH 的发生[6-7],表明胆固醇稳态的改变及肝内胆固醇的积累在NASH 发生发展过程中起重要作用[8]。固醇调节元件结合蛋白-2(sterol regulatory elementbinding protein 2,SREBP-2)是胆固醇稳态的重要调节因子,其活性形式n-SREBP-2 直接调控的下游基因分别为3-羟基 3-甲基戊二酰辅酶 A 还原酶(3-hydroxy-3-methyl-glutaryl-CoA reductase,HMGCR)和低密度脂蛋白受体(low-density lipoproteins receptor,LDLR),其中,HMGCR 是肝脏内源性胆固醇合成的限速酶[9],LDLR 主要负责将载脂蛋白低密度脂蛋白(lowdensity lipoproteins,LDL)结合的外源胆固醇转运至胞内[10]。研究表明,NALFD 与 SREBP-2 成熟及HMGCR 增加有关[11-12]。但动态观察高胆固醇摄食破坏肝脏胆固醇代谢稳态并促使NASH 发生发展的作用尚未见报道。
本研究通过建立高脂高胆固醇诱导的NASH模型,在动物水平及细胞水平探讨胆固醇在高脂高胆固醇诱导NASH 发生发展过程中的动态作用,为NASH 的防治提供思路。
1 材料与方法
1.1 实验动物 清洁级SD 大鼠100 只,雄性,体重180 ~200 g,6 周龄,购自山西医科大学实验动物中心,合格证号:SCXK(晋)2015-0001。
1.2 细胞 人肝脏正常细胞HL-7702 系由清华大学医学院医学系统生物学研究中心惠赠。
1.3 主要试剂 丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)活性测定试剂盒、总胆固醇(total cholesterol,TC)及甘油三酯(triglyceride,TG)含量测定试剂盒均购自苏州科铭生物技术有限公司;Masson 三色染色液试剂盒及油红O 染色试剂盒购自北京索莱宝科技有限公司;兔抗鼠SREBP-2 及HMGCR 多克隆抗体购自武汉爱博泰克生物科技有限公司;兔抗鼠LDLR 多克隆抗体购自武汉三鹰生物技术有限公司;兔抗鼠GAPDH 多克隆抗体购自上海斯信生物科技有限公司;胎牛血清(FBS)、HRP标记的羊抗兔IgG 及RPMI1640 培养基均购自武汉博士德生物工程有限公司;油酸(oleic acid,OA)购自上海易恩化学技术有限公司;LDL-胆固醇(LDLC)购自北京协生生物科技有限责任公司。
1.4 动物试验 100 只SD 大鼠适应性喂养1 周后,随机分为 5 组:CON 组(正常饮食)、HFC0 组(20%脂肪)、HFC1 组(20%脂肪 + 1%胆固醇)、HFC2 组(20%脂肪+ 2%胆固醇)和HFC5 组(20%脂肪+ 5%胆固醇),每组 20 只。于饲喂第 4、6、8、12 周末,各组分别处理5 只大鼠。大鼠禁食24 h,自由饮水,麻醉后暴露腹腔经腹主动脉采血,常温4 000 × g 离心10 min,分离血浆,检测血浆中ALT 及AST 含量;剖解取出肝脏冲洗干净,取肝右叶相同部位组织,用4%多聚甲醛溶液固定,制备切片,HE 及Masson 染色,观察肝脏组织病理情况;检测肝脏组织中TC、TG含量;提取肝脏组织蛋白,进行Western blot 检测。剩余肝脏组织经液氮速冻后,-80 ℃保存。
1.5 细胞实验 将对数生长期的HL-7702 细胞接种至6 孔板,随机分为3 组:对照组(含10% FBS RPMI1640 培养基)、OA 组(添加 200 μmol / L OA 的含 10% FBS RPMI1640 培养基)、OA + LDL-C 组(添加 200 μmol / L OA 及 50 μg / mL LDL-C 的含 10%FBS RPMI1640 培养基)。同时再设3 个平行对照组,在细胞培养5 d 后,检测细胞培养液中ALT 及AST 含量;第1 平行对照组细胞进行油红O 染色,观察细胞内脂滴堆积的位置、形态及大小;第2 平行对照组细胞进行菲律宾菌素染色,观察细胞内游离胆固醇的分布及含量;第3 平行对照组细胞用RIPA裂解法提取蛋白,进行Western blot 检测;第4 平行对照组检测细胞内TC、TG 含量。
1.6 各项检测
1.6.1 ALT、AST、TC、TG检测 均按试剂盒说明书操作。
1.6.2 HE 及 Masson 染色 HE 染色:切片常规脱蜡至水后,苏木素染液染色3 ~5 min;自来水冲洗1 ~2 min;1%盐酸酒精溶液分化数秒,自来水冲洗回蓝5 ~ 10 min;切片入伊红溶液 10 ~ 30 s;再经 95%乙醇Ⅰ、Ⅱ中各调色约10 s;将切片放入无水乙醇Ⅰ、Ⅱ中各脱水1 ~2 min;二甲苯Ⅰ、Ⅱ中各透明1 ~2 min;中性树胶封片,镜检。Masson 染色:切片常规脱蜡至水后,按Masson 三色染色液试剂盒说明书进行切片染色,封片后显微镜下观察。
1.6.3 油红O 及菲律宾菌素染色 细胞诱导5 d 后弃去培养基,PBS 洗涤,用4%多聚甲醛固定30 min;弃去固定液,PBS 洗涤,油红O 染液染色20 min;60%异丙醇漂洗除去多余染料,苏木素染液复染1 min;自来水冲洗至变蓝,加入PBS,显微镜下观察。同理,细胞弃去固定液,经PBS 洗涤后,用1.5 mg/mL 甘氨酸室温培养10 min;PBS 洗涤3 次,避光条件下菲律宾染液染色2 h;加入PBS,荧光显微镜下观察。
1.6.4 Western blot 蛋白经8% ~10% SDS-PAGE分离,转膜2 h;加入5%脱脂牛奶,室温封闭2 h;分别加入 SREBP-2 抗体(1 ∶1 000 稀释)、HMGCR 抗体(1 ∶1 000 稀释)、LDLR 抗体(1 ∶1 000 稀释)及GAPDH 抗体(1 ∶5 000 稀释),4 ℃孵育过夜;TBST洗涤 3 次,加入 HRP 标记的羊抗兔 IgG(1 ∶5 000 稀释),室温孵育 2 h;TBST 洗膜 3 次,采用化学发光法显影,ImageLab 分析条带灰度值。
1.7 统计学分析 采用SPSS 25.0 软件进行统计学分析。实验结果以表示,多组间比较采用单因素方差分析(One-Way ANOVA),两独立样本比较采用t 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 动物试验
2.1.1 血浆中 ALT、AST 及肝脏组织中 TC、TG 的含量结果显示,饲喂 12 周后,与 CON 组比较,HFC0 组、HFC1组、HFC2 组及HFC5 组血浆中ALT 含量均显著升高(t 分别为 -12.892、-17.712、-23.038 和 -48.790,P均 < 0.01),AST 含量均显著升高(t 分别为-5.391、-6.407、-6.702 和-9.905,P 均 < 0.01)。与 CON 组比较,HFC1 组、HFC2 组和 HFC5 组肝脏组织中 TC 含量均显著升高(t 分别为 -39.450、-19.232 和 -98.024,P 均 < 0.05),HFC0 组、HFC1 组、HFC2 组、HFC5 组肝脏组织中TG 含量均显著升高(t 分别为-4.732、-4.498、-15.780 和-16.909,P 均 < 0.05)。见表 1。
2.1.2 肝脏组织病理学观察 12 周末,HE 染色观察显示,CON 组肝细胞形态正常,胞质均匀,肝小叶结构规则,HFC0 组、HFC1 组表现为散在的肝细胞浆内脂滴空泡的形成,HFC2 组及HFC5 组以大脂滴为主的脂肪变性肝细胞和气球样变性肝细胞增多,肝细胞肿胀,胞质疏松化;Masson 染色观察显示,HFC2 组肝细胞周围有散在分布的细丝状淡蓝色纤维出现,HFC5 组可见分布较广、较粗的蓝色胶原纤维沉积。见图1。
2.1.3 Western blot 分析 4 周末,与 CON 组比较,HFC2 组及HFC5 组LDLR 蛋白表达水平均显著升高(t 分别为-3.748 和-4.001,P 均 < 0.05)。6 周末,与 CON 组比较,HFC1 组、HFC2 组、HFC5 组LDLR蛋白表达水平均显著升高(t 分别为-7.617、-5.575和 -5.390,P 均 < 0.05);与 HFC0 组比较,HFC1组、HFC2 组、HFC5 组均显著升高(t 分别为-9.247、-7.530和-7.689,P 均 < 0.05)。8 周末,与 CON 组比较,HFC1 组、HFC2 组、HFC5 组 LDLR 蛋白表达水平均显著升高(t 分别为-3.529、-4.916 和-3.950,P 均 <0.05);与 HFC0 组比较,HFC1 组、HFC2 组、HFC5组均显著升高(t 分别为-3.711、-5.306 和-4.222,P 均 < 0.05)。12 周末,HFC5 组较 CON 组 LDLR蛋白表达水平均显著降低(t=8.065,P < 0.05)。4、6及8 周末,所有高脂组与CON 组比较n-SREBP-2 蛋白表达水平差异均无统计学意义(t 为0.043 ~1.532,P 均 > 0.05)。12 周末,与 CON 组比较,HFC0 组、HFC2 组及HFC5 组n-SREBP-2 蛋白表达水平均显著升高(t 分别为 -7.288、-4.120 和 -5.550;P 均 <0.05);与 HFC0 组比较,HFC1 组、HFC2 组及 HFC5组均显著降低(t 分别为 7.446、3.422 和 2.912,P均 < 0.05)。4、6 及 12 周末,所有高脂组与 CON 组比较,HMGCR 蛋白表达水平差异均无统计学意义(t为-4.919 ~ 9.192,P 均 > 0.05)。8 周末,HFC5组较CON 组HMGCR 蛋白表达水平显著降低(t =21.079,P < 0.05)。见图 2 ~ 9。
2.2 细胞试验
2.2.1 培养液中 ALT、AST 及细胞内 TC、TG 的含量 结果显示,与对照组比较,OA 组及OA+LDL-C 组细胞培养液中ALT 含量显著升高(t 分别为-6.675和-3.834,P 均 < 0.05),OA + LDL-C 组 AST 含量显著升高(t = -2.663,P < 0.05),见图 10。与对照组及OA 组比较,OA + LDL-C 组细胞内TC 含量显著升高(t 分别为-135.682 和-201.249,P 均 < 0.01);各组细胞中TG 含量差异无统计学意义(t 均为-0.06,P 均 > 0.05),见图 11。
表 1 12 周末各组大鼠血浆中 ALT、AST 及肝脏组织中 TC、TG 的含量(,n = 5)Tab.1 Contents of ALT and AST in plasma and TC and TG in liver of rats in various groups at the end of week 12 after feeding(,n = 5)

表 1 12 周末各组大鼠血浆中 ALT、AST 及肝脏组织中 TC、TG 的含量(,n = 5)Tab.1 Contents of ALT and AST in plasma and TC and TG in liver of rats in various groups at the end of week 12 after feeding(,n = 5)
注:与 CON 组比较,a 表示 P < 0.05;aa 表示 P < 0.01。
ALT[nmol /(min·mL)]AST[nmol /(min·mL)]TC(mg / g) TG(mg / g)162.90 ± 1.56 51.52 ± 0.84 7.83 ± 0.03 31.14 ± 1.16 HFC0 186.21 ± 0.91aa 56.29 ± 0.66aa 9.55 ± 0.74 45.10 ± 2.51a HFC1 200.60 ± 1.45aa 56.32 ± 0.34aa 14.14 ± 0.16aa 45.41 ± 2.97a HFC2 252.10 ± 3.41aa 57.68 ± 0.66aa 19.32 ± 0.61aa 49.58 ± 1.00aa HFC5 274.80 ± 1.68aa 60.81 ± 0.61aa 21.90 ± 0.14aa 46.76 ± 0.75aa

图1 12 周末各组大鼠肝脏组织病理学显微镜观察Fig.1 Microscopy of histopathology of livers of rats in various groups at the end of week 12 after feeding

图2 4 周末各组大鼠肝脏组织中LDLR、n-SREBP-2 及HMGCR 蛋白表达水平的Western blot 检测Fig.2 Determination of expression levels of LDLR,n-SREBP-2 and HMGCR in liver of rats in various groups at the end of week 4 by Western blot

图3 4 周末各组大鼠肝脏组织中LDLR(A)、n-SREBP-2(B)及HMGCR(C)蛋白的表达水平Fig.3 LDLR(A),n-SREBP-2(B)and HMGCR(C)levels in livers of rats in various groups at the end of week 4 after feeding
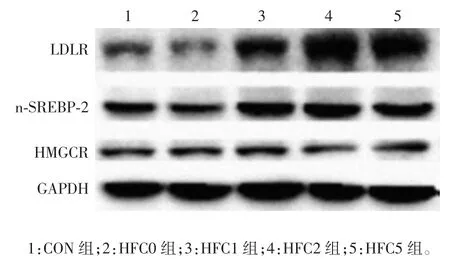
图4 6 周末各组大鼠肝脏组织中LDLR、n-SREBP-2 及HMGCR 蛋白表达水平的Western blot 检测Fig.4 Determination of expression levels of LDLR,n-SREBP-2 and HMGCR in livers of rats in various groups at the end of week 6 after feeding by Western blot

图5 6 周末各组大鼠肝脏组织中LDLR(A)、n-SREBP-2(B)及HMGCR(C)蛋白的表达水平Fig.5 LDLR(A),n-SREBP-2(B)and HMGCR(C)levels in livers of rats in various groups at the end of week 6 after feeding

图6 8 周末各组大鼠肝脏组织中LDLR、n-SREBP-2 及HMGCR 蛋白表达水平的Western blot 检测Fig.6 Determination of expression levels of LDLR,n-SREBP-2 and HMGCR in livers of rats in various groups at the end of week 8 after feeding by Western blot

图7 8 周末各组大鼠肝脏组织中LDLR(A)、n-SREBP-2(B)及 HMGCR(C)蛋白的表达水平Fig.7 LDLR(A),n-SREBP-2(B)and HMGCR(C)levels in livers of rats in various groups at the end of week 8 after feeding

图8 12 周末各组大鼠肝脏组织中LDLR、n-SREBP-2 及HMGCR 蛋白表达水平的Western blot 检测Fig.8 Determination of expression levels of LDLR,n-SREBP-2 and HMGCR in livers of rats in various groups at the end of week 12 after feeding by Western blot

图9 12 周末各组大鼠肝脏组织中LDLR(A)、n-SREBP-2(B)及 HMGCR(C)蛋白的表达水平Fig.9 LDLR(A),n-SREBP-2(B)and HMGCR(C)levels in livers of rats in various groups at the end of week 12 after feeding

图 10 各组细胞培养液中ALT(A)及AST(B)的含量Fig.10 ALT(A)and AST(B)contents in media of various groups

图 11 各组 HL-7702 细胞中 TC(A)及 TG(B)的含量Fig.11 TC(A)and TG(B)contents in HL-7702 cells of various groups
2.2.2 油红O 染色 OA + LDL-C 组较对照组及OA 组富含脂滴的HL-7702 细胞数量增多,细胞内脂滴增大,见图12。

图 12 油红O 染色的对照组(A)、OA 组(B)及 OA+LDL-C组(C)HL-7702 细胞内脂滴的显微镜观察(× 400)Fig.12 Microscopy of lipid contents in HL-7702 cells in CON(A),OA(B)and OA + LDL-C(C)groups with oil red staining(× 400)
2.2.3 菲律宾菌素染色 OA + LDL-C 组细胞质内散在分布的荧光亮点较对照组及OA 组显著增加,见图13。
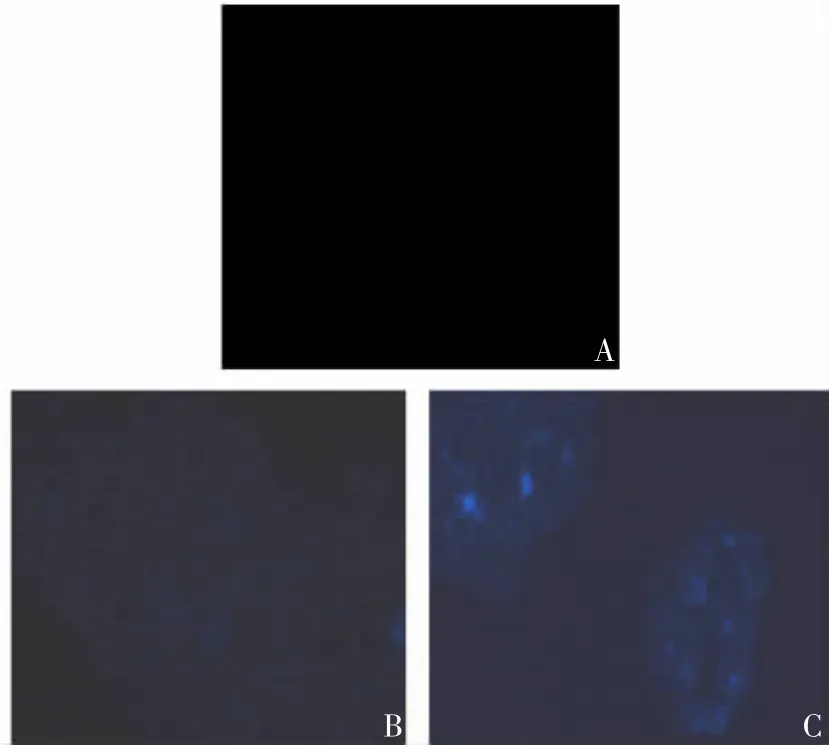
图 13 菲律宾菌素染色的对照组(A)、OA 组(B)及 OA +LDL-C 组(C)HL-7702 细胞内胆固醇的荧光显微镜观察(× 400)Fig.13 Fluorescent microscopy of cholesterol contents in HL-7702 cells in CON(A),OA(B)and OA+LDL-C(C)groups with Filipin staining(× 400)
2.2.4 Western blot 分析 结果显示,OA + LDL-C组较对照组及OA 组n-SREBP-2 蛋白表达水平均显著升高(t 分别为-11.307 和-6.420,P 均 < 0.05);OA + LDL-C 组较对照组及OA 组HMGCR 蛋白表达水平均显著升高(t 分别为-2.649 和-3.074,P均 <0.05)。见图14 和图15。与对照组比较,OA组及OA + LDL-C 组LDLR 蛋白表达水平均显著降低(t 分别为 12.319 和 18.797,P 均 < 0.05),见图 16 和图 17。

图 14 各组 HL-7702 细胞内 n-SREBP-2、HMGCR 蛋白表达水平的Western blot 检测Fig.14 Western blotting of expression levels of n-SREBP-2 and HMGCR in HL-7702 cells of various groups

图 15 各组 HL-7702 细胞内 n-SREBP-2(A)及 HMGCR(B)蛋白的表达水平Fig.15 Expression levels of n-SREBP-2(A)and HMGCR(B)in HL-7702 cells of various groups

图 16 各组HL-7702 细胞内 LDLR 蛋白表达水平的Western blot 检测Fig.16 Western blotting of expression level of LDLR in HL-7702 cells of various groups

图17 各组HL-7702 细胞内LDLR 蛋白的表达水平Fig.17 Expression levels of LDLR in HL-7702 cells of various groups
3 讨 论
NAFLD 是全球常见的慢性代谢性临床综合征,为肝硬化及肝癌等终末期肝病的重要病因,且还显著增加2 型糖尿病、动脉粥样硬化及结直肠肿瘤的发病风险,成为日益严峻的公共健康问题[13]。目前,我国NAFLD 患者占全国各类肝病患者的49.3%,NAFLD 已超过慢性乙型肝炎成为第一大肝病。NALFD 疾病谱分为单纯性脂肪肝(Nonalcoholic simple fatty liver,NASFL)、NASH、脂肪性肝纤维化及肝硬化等[14]。NASFL 进展缓慢,而 NASH 可进展为肝硬化甚至肝癌、导致2 型糖尿病及心血管疾病的风险显著增大[15-16]。
研究发现,胆固醇代谢与NASH 发生发展密切相关[17]。在NASH 进展中,胆固醇在肝细胞内的堆积较TG 更具有细胞毒性[18-19],使用他汀类药物能有效改善肝脂肪变性、炎症及纤维化[20]。2019 版《欧洲血脂管理指南》明确指出“坏胆固醇”即LDL-C 越低越好,并将其绝对值降至 < 1.4 mmol / L(<55 mg /dL)[2018 版 < 1.8 mmol/L(< 70 mg /dL)][21]。MALHOTRA 等[6]发现,肠道 SREBP-2 的过度激活能促进饮食诱导NASH 的发生;MIN 等[12]发现,NASH 患者体内 SREBP-2 成熟,HMGCR 表达增加,LDLR 表达减少。本实验验证了高脂高胆固醇饮食较单一高脂饮食更能成功诱导动物及细胞NASH 的发生,进一步证实胆固醇是NASH 发生发展的危险因素。在胆固醇诱导NASH 发生发展的动态过程中发现,高脂高胆固醇组的LDLR 蛋白表达水平先升高后降低,表明胆固醇早期能诱导肝脏高表达LDLR来处理和平衡血液中升高的胆固醇水平,但当细胞内的胆固醇含量升高至一定程度后抑制LDLR 的表达,这可能与胆固醇摄入过多引起的细胞膜破坏有关,也可能与LDLR 在溶酶体中破坏增多导致其向细胞膜的循环利用减少有关,具体机制有待进一步研究。模型早期所有高脂组较CON 组n-SREBP-2蛋白表达水平一直处于较低水平,是由于内质网过量的胆固醇堆积抑制了固醇调节元件结合蛋白裂解激活蛋白(SCAP-SREBP-2)复合物与包被蛋白2 的结合及转运,从而抑制了SREBP-2 的水解激活[22];第 8 周末,HFC5 组较 CON 组 HMGCR 的蛋白表达水平降低(P <0.05),这表明外源性胆固醇摄入过多抑制HMGCR 调控的内源性胆固醇的合成;造模后期,HFC0、HFC2、HFC5 组较 CON 组 n-SREBP-2 蛋白表达量均增加(P 均<0.05),在细胞水平也发现,OA + LDL-C 组较对照组、OA 组 n-SREBP-2、HMGCR蛋白表达水平显著升高(P <0.05),表明在NASH发生发展后期,n-SREBP-2、HMGCR 介导的内源性胆固醇合成增多并参与了NASH 的发生发展。
综上所述,本研究发现,饮食中的胆固醇能诱导肝脏高表达低密度脂蛋白受体从而进入肝细胞内,肝细胞内外源性胆固醇的堆积在早期也会对自身内源性胆固醇的合成起抑制作用,肝脏的这种自我调节机制在高脂高胆固醇饮食的早期能维持肝内胆固醇浓度的动态平衡,从而保护肝脏胆固醇稳态不受破坏;随着肝内胆固醇含量的进一步增加,肝细胞LDLR 表达减少,此时由LDLR 介导的胆固醇摄入减少使肝内胆固醇相对不足,这将作为一个肝内胆固醇含量降低的信号,反馈性调节n-SREBP-2 及HMGCR表达升高,从而打破肝脏胆固醇代谢稳态,加剧了NASH 的发生发展。
