F 基因型腮腺炎减毒活疫苗(人二倍体细胞)的质量稳定性分析
2021-01-19易力邹俊如乔燕何云龙樊会青李琦涵王晶晶
易力,邹俊如,乔燕,何云龙,樊会青,李琦涵,王晶晶
中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118
流行性腮腺炎是一种由腮腺炎病毒(mumps virus)引起的传染性疾病,腮腺炎病毒的传播通常以空气飞沫为载体[1],这就导致了该病的高传播率及较高的发病率[2]。腮腺炎病毒感染通常引起患者双侧或单侧的腮腺肿大,感染人群中有20%的青年男性可发生单侧睾丸炎,5%的青年女性可发生卵巢炎,而在总的感染发病者中,并发无菌性脑膜炎的可达15%,并发胰腺炎的约5%,并发脑炎的可能性约为1 / 6 000,并发单侧永久性耳聋的可能比例为1 /15 000,另外还有一些偶发的并发关节炎、心肌炎及肝炎等[3-5]。以我国2018 年CDC 公布的全国法定传染病疫情为例,全国丙类传染病报告发病数居前5位的病种占丙类传染病报告发病总数的99.80%,其中流行性腮腺炎报告发病数居第4 位,发病率为18.65 / 10 万[6]。对接种腮腺炎疫苗后的人群进行调查显示,抗体血清阳性率较低,接种疫苗后的人群对腮腺炎的免疫力降低[7-8]。21 世纪以来,病毒性腮腺炎疫情持续增加,2016 — 2017 年出现了腮腺炎暴发的情况[9-11]。我国做为广泛使用腮腺炎疫苗的国家,居高不下的腮腺炎发病率也已引起广泛关注[12]。
根据大量流行病学资料分析,我国目前使用最多的腮腺炎减毒活疫苗毒株主要是A 基因型,但对我国腮腺炎患者的基因学分析发现,大部分患者感染的病毒主要为F 基因型[13]。因此,在腮腺炎病毒疫苗的研制及使用中,与流行株基因型相同的毒株将具有更加重要的流行病学意义。本研究利用细胞工厂,使用F 基因型腮腺炎减毒活疫苗毒种SP-A 株,接种于人二倍体细胞KMB17,连续制备6 批减毒活疫苗,并对不同阶段产品进行有效性、安全性和残余物质检测,以分析在细胞工厂上生产F 基因型腮腺炎减毒活疫苗的质量稳定性。
1 材料与方法
1.1 细胞及毒种 人二倍体细胞 KMB17 株(32代)由中国医学科学院医学生物学研究所提供;腮腺炎病毒SP-A 株为中国医学科学院医学生物学研究所于2005 年分离,经全基因测序为F 基因型(基因库登录号:DQ 649478),本研究使用的毒株为24 代。
1.2 实验动物 清洁级ICR 小鼠(体重18 ~22 g)和清洁级Hartley 豚鼠(体重250 ~330 g)由中国医学科学院医学生物学研究所小动物实验部提供。
1.3 主要试剂及仪器 MEM 培养基购自美国Gibco公司;新生牛血清购自兰州民海生物工程有限公司;胰蛋白酶和谷氨酰胺购自美国Sigma 公司;冻干稳定剂由中国医学科学院医学生物学研究所配制;无菌检查用培养基购自北京三药科技开发公司;鲎试剂购自湛江安度斯生物有限公司;牛血清白蛋白残留量检测Cygnus 试剂盒购自北京西美杰科技有限公司;硫酸卡那霉素残留量检测试剂盒购自北京勤邦生物技术有限公司;10 层细胞工厂购自美国康宁公司;96 孔细胞培养板购自美国Thermo 公司;集菌仪购自默克密理博公司;无菌隔离器购自上海东富龙爱瑞思科技有限公司;酶标仪购自美国BioTek公司。
1.4 F 基因型腮腺炎减毒活疫苗的制备 连续制备6 批腮腺炎减毒活疫苗(每批次12 个细胞工厂),编号为1 ~6。将KMB17 细胞在细胞工厂中传代,(37 ± 0.5)℃培养 3 ~ 5 d,待细胞长为单层时,将腮腺炎病毒SP-A 株按MOI 0.02 接种于KMB17 细胞,(37 ± 0.5)℃培养 6 ~ 8 d 收获病毒,即为病毒收获液;病毒收获液经(50 μm + 10 μm)两级澄清过滤后,即为病毒原液;将病毒原液与冻干稳定剂混合后即为半成品;半成品经分装、冻干后,制备为腮腺炎减毒活疫苗成品。
1.5 质量检定
1.5.1 疫苗有效性检测 采用微量细胞病变法对病毒收获液、原液、半成品和成品进行病毒滴度检测:将样品10 倍系列稀释,取至少3 个稀释度的病毒液接种KMB17 细胞,每个稀释度接种 8 孔,0.10 mL / 孔,置(37 ± 0.5)℃培养10 d,判定结果。并对成品进行热稳定试验:将成品在37 ℃条件下放置7 d 后检测病毒滴度。
1.5.2 疫苗安全性检测 按照《中国药典》三部(2015 版)要求对成品进行无菌、细菌内毒素和异常毒性检查。
1.5.3 疫苗残余物质检测 按照《中国药典》三部(2015 版)要求对成品进行牛血清白蛋白和抗生素残留量检测。
1.6 统计学分析 对6 批中间产品的病毒滴度,6 批成品的病毒滴度、热稳定性试验、牛血清白蛋白残留量、抗生素残留量4 个指标,应用minitab 17 软件进行正态性检验,符合正态分布(P >0.05)的数据利用其均值及标准差,绘制2 倍标准差控制线(standard deviation line,± 2 SL)和 3 倍标准差控制线[控制图中用上控制线(upper control line,UCL)和下控制线(lower control line,LCL)表示],分析各阶段产品的质量稳定性。
2 结 果
2.1 病毒滴度 检测结果显示,病毒收获液和原液病毒滴度均值均>5.9 LgCCID50/ mL;将原液稀配为半成品后,病毒滴度下降 0.3 ~ 0.5 LgCCID50/ mL;再将半成品进行冻干后,成品滴度也有所下降,下降范围在 0.4 ~ 0.6 LgCCID50/ mL;热稳定性试验结果符合《中国药典》三部(2015 版)要求。对所有阶段制品的病毒滴度检测值分别进行正态性检验,检测数据均符合正态分布(P >0.05),见表1,且在正负2 倍标准差控制线范围内波动,见图1。
2.2 疫苗的安全性 6 批成品的无菌及异常毒性检查结果均为阴性,细菌内毒素均不超过50 EU / 剂。
2.3 疫苗的残余物质 检测结果显示,6 批成品的牛血清白蛋白和抗生素残留量均低于50 ng / 剂,分别对两组检测数据进行正态性检验,检测数据均符合正态分布(P >0.05),见表2,所有数据均在正负2 倍标准差范围内波动,见图2。

表1 各阶段产品的病毒滴度范围及正态性检验结果Tab.1 Test results of virus titer and normality of products in various stages
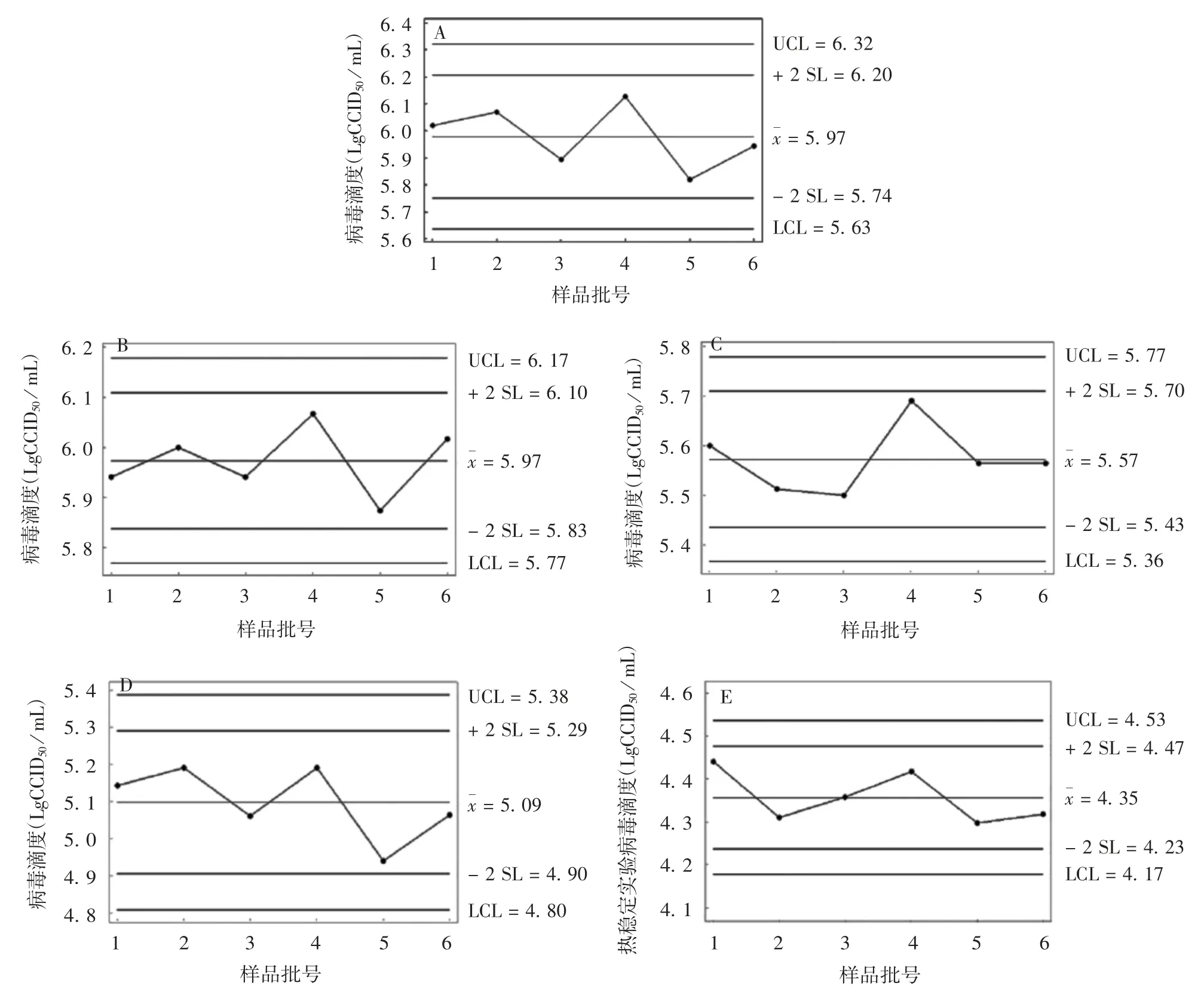
图1 病毒收获液(A)、原液(B)、半成品(C)、成品(D)及成品热稳定性试验(E)的病毒滴度变化趋势Fig.1 Trend of virus titer of virus harvest(A),bulk(B),final bulk(C),final product(D)and the final product in thermal stability test(E)
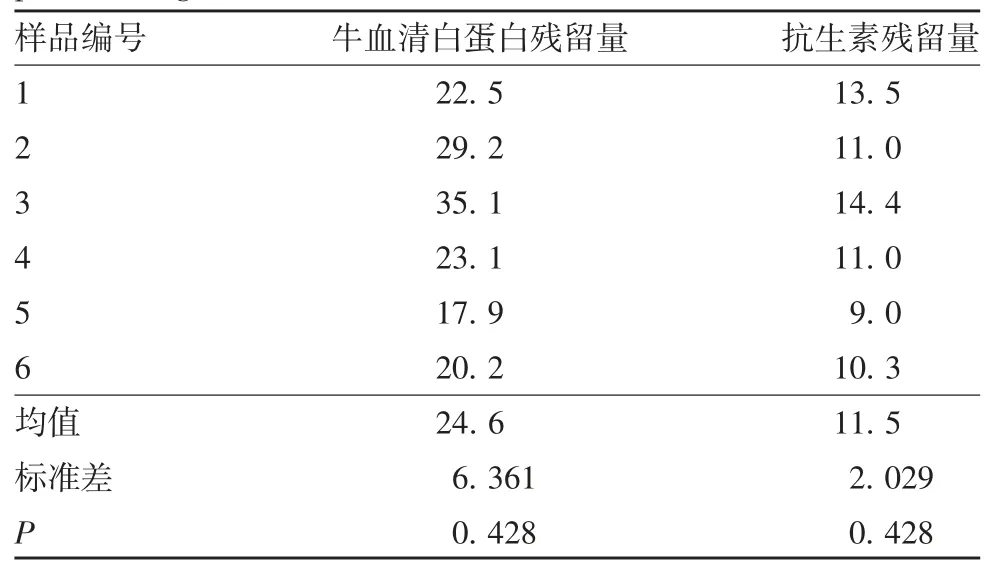
表2 成品的残余物质数据(ng / 剂)及正态性检验结果Tab.2 Test results of residual substance and normality of final product(ng / dose)

图2 成品牛血清白蛋白(A)和抗生素(B)残留量变化趋势Fig.2 Trend of residual BSA(A)and residual antibiotics(B)contents in final product
3 讨 论
本研究对在细胞工厂上生产的F 基因型腮腺炎减毒活疫苗进行了质量稳定性分析,使用的毒株与国内主要流行的腮腺炎病毒基因型相同,这将对预防和控制腮腺炎的流行起到重要作用[14],该毒株已通过Ⅰ期和Ⅱ期临床试验研究,证明其对易感人群具有较好的有效性[15],此外,使用人二倍体细胞生产,也证明其具有较好的安全性[16]。
本研究利用细胞工厂在人二倍体细胞基质上制备了6 批F 基因型腮腺炎减毒活疫苗。首先,从疫苗的有效性指标来分析,病毒收获液和原液的病毒滴度均值均高于5.9 LgCCID50/ mL;在疫苗制备过程中,将原液稀配为半成品,病毒滴度下降0.3 ~0.5 LgCCID50/ mL;将半成品冻干为成品,病毒滴度下降 0.4 ~ 0.6 LgCCID50/ mL;成品病毒滴度均不低于4.0 LgCCID50/ mL;热稳定性试验结果符合《中国药典》三部(2015 版)[17]要求,病毒滴度下降不高于1.0 LgCCID50/ mL,且仍不低于 4.0 LgCCID50/ mL。每个阶段产品的病毒滴度检测值均为正态分布,且在2 倍标准差控制限范围内波动,每个生产过程的病毒滴度变化均在可接受范围内,表明整个制备过程工艺稳定,可获得病毒滴度稳定的病毒收获液、原液、半成品和疫苗成品。病毒滴度作为衡量疫苗质量的关键指标,该实验结果表明,该生产工艺稳定。其次,从疫苗的安全性指标来分析,成品的无菌、异常毒性检查均为阴性,细菌内毒素均不高于50 EU/剂,检测结果符合《中国药典》三部(2015 版)要求(细菌内毒素应不高于50 EU / 剂)。再从疫苗的残余物质指标来分析,牛血清白蛋白和抗生素残留量检测结果均符合《中国药典》三部(2015 版)要求(牛血清白蛋白和抗生素残留量均应不高于50 ng /剂),所有检测数据均在2 倍标准差控制限范围内波动。6 批成品牛血清白蛋白残留量最高值为35.1 ng / 剂,成品抗生素残留量最高值为14.4 ng / 剂,与《中国药典》规定值比较,均不高于上限值。无菌试验、异常毒性试验、细菌内毒素、牛血清白蛋白残留量和抗生素残留量这5 个检测指标反应了该生产工艺能够稳定生产出安全性可靠的疫苗成品。
本研究利用细胞工厂在人二倍体细胞基质上制备了F 基因型腮腺炎减毒活疫苗,能获得质量稳定的中间产品和成品,生产过程中不同阶段的病毒滴度变化也较稳定,安全性指标和残留物质检测结果也证明该工艺适用于该疫苗的生产。本研究结果为F 基因型腮腺炎减毒活疫苗(人二倍体细胞)的规模化生产提供了实验依据。
