牛外周血淋巴细胞PD-1 胞外区基因的原核表达及多抗制备
2021-01-19刘珊珊吴陈华刘宇赵尚琪赫鸣睿王丽王天何泊宁张世勋岳山黄雯静朱战波
刘珊珊 ,吴陈华 ,刘宇 ,3,赵尚琪 ,赫鸣睿 ,王丽 ,王天 ,何泊宁 ,张世勋 ,岳山 ,黄雯静 ,朱战波
1.黑龙江八一农垦大学动物科技学院,黑龙江大庆163319;2.黑龙江省牛病防控工程技术研究中心,黑龙江大庆163319;3.黑龙江省兽医科学研究所,黑龙江齐齐哈尔161005
程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)及程序性死亡配体-1(programmed deathligand 1,PD-L1)被认为是外周免疫耐受和病原体特异性免疫抑制的核心[1],于各种类型的慢性感染及肿瘤疾病中,PD-1 及PD-L1 在抑制慢性病原体激活T 细胞的生物学功能中起重要作用,可诱导T 细胞“衰竭”[2-3]。研究表明,慢性病毒感染期间,PD-1 在衰竭的T 细胞上高度表达,且阻断PD-1/PD-L1 途径,可恢复T 细胞功能,使T 细胞增殖并产生效应细胞因子[1]。HIV、HCV、HBV、低分子量病毒(low molecular weight virus,LMCV)等慢性病毒感染期间,PD-1 /PD-L1途径与病毒特异性T 细胞的衰竭有关。在猪、鸡、猫、狗及牛体内发现PD-1/ PD-L1 途径,有助于慢性传染病的发病机制及免疫逃避的研究。用PD-1 或PD-L1特异的单克隆抗体(mAb)治疗,在临床试验及癌症患者体内均重新激活了衰竭的免疫应答,如T 细胞增殖、细胞因子的产生及细胞毒素作用[2,4-6]。
来自实验性淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choroid plexus meningitis virus,LCMV)感染的证据表明,PD-1 / PD-L1 通路在抑制病毒特异性CD8+T 细胞在小鼠慢性病毒感染中起关键作用[7]。在牛白血病病毒(bovine leukemia virus,BLV)感染的牛PD-L1 阻断被认为是改善针对肿瘤及慢性感染的免疫应答的适当策略[8]。前期实验使用人PD-1 抗体体外阻断 PD-1 / PD-L1 通路,结果表明,PD-1 在急性牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)感染引起的外周血淋巴细胞(peripheral blood lym-phocytes,PBL)减少及细胞凋亡中起重要作用[9]。
本研究使用原核表达系统对牛PD-1 胞外区重组蛋白进行表达,纯化后免疫小鼠制备多克隆抗体,为探讨其在牛慢性病毒感染而引起的持续性免疫抑制及免疫耐受中的作用奠定基础。
1 材料与方法
1.1 菌株、载体及病毒 大肠埃希菌DH5α、大肠埃希菌 BL21(DE3)菌株及原核载体 pET-28a(+)、CP及NCP 型BVDV 均由黑龙江八一农垦大学动物科技学院生物技术中心动物传染病实验室保存。
1.2 实验动物 SPF 级雌性昆明小鼠 5 只,18 ~ 20 g,7 周龄,购自哈尔滨医科大学实验动物学部,许可证号:SCXK(黑)2019-001。
1.3 主要试剂及仪器 RNA 提取试剂盒购自北京天根生化科技有限公司;反转录试剂盒、Taq Master Mix酶、pMD18-T simple vecter 购自日本 TaKaRa 公司;T4 DNA 连接酶、EcoRⅠ和Hind Ⅲ购自美国 Thermo Scientific 公司;胶回收试剂盒及质粒提取试剂盒购自美国Axygen 公司;硫酸卡那霉素(Kan)购自美国Amresco 公司;HRP 标记羊抗鼠 IgG、鼠抗 His 单克隆抗体及DAB 显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.4 PD-1 胞外区目的基因片段的扩增 根据Gen-Bank 上登录的牛 PD-1 序列(AB_510901.1)设计特异性引物,上游引物:5′-CGGAATTCTCCAGCAGGCCCTGGA-3′,下游引物:5′-CGAAGCTTGATGACCAGGCTCTGCATCTGG -3′,扩增片段大小为448 bp。引物由生工生物工程(上海)股份有限公司合成。采集牛外周血,按RNA 提取试剂盒说明书提取牛PBL 的RNA,反转录为cDNA,以其为模板,PCR 扩增目的片段。反应体系:Taq Master Mix 12.5 μL,上下游引物各 0.5 μL,cDNA 模板 1 μL,ddH2O 10.5 μL,混匀。反应条件:94 ℃预变性 5 min;94 ℃ 30 s,65 ℃ 30 s,72 ℃ 30 s,共 30 个循环;72 ℃ 10 min;4 ℃保存。PCR 产物经1%琼脂糖凝胶电泳分析,并回收目的片段。
1.5 重组质粒pET-28a-PD-1 的构建 将回收的PD-1 产物经 T4 DNA 连接酶与原核载体 pET-28a(+)16 ℃连接过夜,构建重组质粒pET-28a-PD-1;转化DH5α 感受态细胞,取阳性克隆,同时以 pET-28a(+)空载体及感受态细胞为对照,接种含 100 μg / mL Kan 的 LB 平板上,37 ℃培养箱培养 12 h;挑选单菌落接种于5 mL LB 液体培养基中(含 100 μg/mL Kan),37 ℃,180 r / min 培养 12 h;提取质粒,进行双酶切(EcoRⅠ/ HindⅢ)鉴定,鉴定正确后送生工生物工程(上海)股份有限公司测序,并与GenBank 中牛PD-1 序列比对。
1.6 牛PD-1 胞外区的生物信息学分析 采用NCBI、ExPASy 数据库及PHD 分析重组质粒pET-28a-PD-1 蛋白结构;利用 Lasergene 7.1 和 MEGA 6.0 进行同源性及系统进化分析。
1.7 牛PD-1 胞外区重组蛋白的诱导表达 将重组质粒转化至大肠埃希菌BL21(DE3)感受态细胞中,挑取单菌落接种至 LB 培养液中(含100 μg/mL Kan),37 ℃,180 r / min 培养至 A260为 0.4 ~ 0.6,加入 0、0.2、0.4、0.8 及 1 mmol / L IPTG 诱导,收集表达的菌液,13 201 × g 离心 1 min,沉淀用 200 μL PBS 重悬,超声破碎后,13 201 × g 离心 1 min,保留上清。沉淀再次用100 μL PBS 重悬,分别取上清及沉淀进行12% SDS-PAGE 分析。获得的牛PD-1 胞外区重组蛋白简称为牛PD-1 蛋白。
1.8 目的蛋白的纯化及鉴定 将鉴定正确的重组蛋白按 1 ∶100 比例接种于 LB 培养液(含 100 μg /mL Kan)中,37 ℃,180 r/min 培养12 h,培养物经 4 000 × g离心15 min,用磷酸盐缓冲液重悬,冰上超声破碎,2 291 × g 离心20 min,分离沉淀,用包涵体裂解液4 ℃裂解1 h,进行12% SDS-PAGE 分析。电泳结束后用 0.1 mol / L KCl 染色 10 min,出现白色条带后,切下条带,脱色30 min,放入 Tris-Gly Buffer 的预处理的透析袋中,水平电泳120 V 2 h,将透析袋放入PBS 中过夜透析,收集上清,进行Western blot 鉴定。目的蛋白经12% SDS-PAGE 分离,半干法转移至NC膜,转印 30 min;TBST 洗涤 3 次,每次 10 min,5 %脱脂乳室温封闭NC 膜2 h;TBST 洗涤3 次,每次10 min,加入鼠抗 His 单克隆抗体(1 ∶2 000 稀释),4 ℃过夜;TBST 洗涤 5 次,每次 10 min,加入羊抗鼠IgG(1 ∶10 000 稀释),室温 1.5 h;TBST 洗涤 5 次,每次 10 min,DAB 显色。
1.9 牛PD-1 多克隆血清抗体的制备 将纯化的目的蛋白免疫小鼠3 只(1 ~ 3 号),背部皮下注射,50 μg/只,用弗氏完全佐剂乳化的抗原免疫1 次,15 d 后,用弗氏不完全佐剂乳化的抗原进行3 次加强免疫,每次间隔15 d,末次免疫后10 d 采集小鼠眼球血,制备多克隆抗体。
1.10 多克隆血清抗体效价及免疫活性检测 ELISA法检测血清抗体效价。将小鼠血清进行倍比稀释作为一抗,1 ∶10 000 稀释的 HRP 标记的羊抗鼠 IgG 为二抗,读取A450;血清抗体效价按阴性血清样品(未免疫小鼠)平均A450的2 倍判定。Western blot 法检测多抗血清的免疫活性。经12% SDS-PAGE 分离目的蛋白,转膜,以1 ∶100 稀释的抗牛PD-1 多抗血清为一抗,1 ∶10 000 稀释 HRP 标记的羊抗鼠 IgG 为二抗,加DAB 显色剂显色,用水终止反应。
1.11 多克隆血清抗体阻断检测BVDV 病毒拷贝数按参考文献[10]的方法绘制BVDV 病毒拷贝数标准曲线,获得标准曲线方程,计算病毒拷贝数。将分离的牛 PBL分为 4 组,BVDV CP 组、BVDV NCP 组、BVDV CP + PD-1 多抗组及 BVDV NCP + PD-1 多抗组,每组重复3 次;体外孵育72 h 后提取总RNA,反转录为cDNA,采用SYBR 染料法检测病毒的拷贝数,与标准品同时进行定量PCR,获得标准方程,计算各感染组PBL 悬浮液病毒拷贝数。
1.12 统计学分析 应用GraphPad Prism 6.0 软件进行统计学分析,实验数据以D 表示,组间比较采用t 检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 目的基因的PCR 鉴定 经1%琼脂糖凝胶电泳分析,可见448 bp 的目的条带,大小与预期一致,见图1。
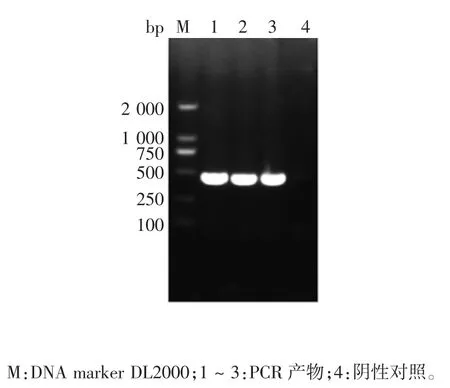
图 1 牛PD-1 胞外区PCR 电泳图Fig.1 Electrophoretic profile of PCR product of bovine PD-1 extracellular domain gene
2.2 重组质粒pET-28a-PD-1 的鉴定 重组质粒双酶切(EcoRⅠ/ HindⅢ)产物经1%琼脂糖凝胶电泳分析,可见448 bp 的目的基因片段,大小与预期一致,见图2。与NCBI-blast 序列比对同源性为100%。
2.3 牛PD-1 胞外区的生物信息学分析 牛PD-1胞外区基因读码框编码147 个氨基酸,相对分子质量为 16 040,等电点为 7.77,蛋白的不稳定系数是66.29,为一种不稳定蛋白,脂溶系数57.97,总平均亲水性-0.619,为一种亲水性蛋白,该蛋白是免疫球蛋白(IG)结构域,属IG 超家族成员。经PHD 分析,牛PD-1 胞外区蛋白的二级结构主要是由2.1% α 螺旋、34.97%延伸链及62.94%无规则卷曲构成,推测无规则卷曲是PD-1 胞外区蛋白的主要结构。
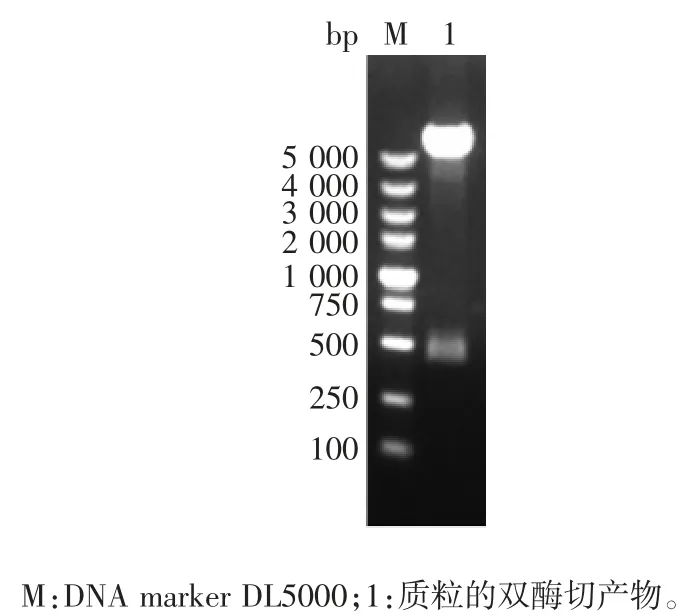
图 2 pET-28a-PD-1 重组质粒的双酶切(EcoRⅠ/ HindⅢ)鉴定Fig.2 Restriction map of recombinant plasmid pET-28a-PD-1(EcoRⅠ/HindⅢ)
2.4 牛PD-1 胞外区的序列分析 经同源性比对,构建的PD-1 胞外区质粒与奶牛和瘤牛PD-1 胞外区序列同源性均为100%,与牦牛、野生牦牛及水牛的同源性分别为99.3%、98.9%和97.7%,与绵羊及山羊的同源性为93.6%和91.5%,与人及鼠的同源性分别为79%和71%。见图3 和表1。

图3 牛PD-1 序列的同源性分析Fig.3 Homology of bovine PD-1 sequence
2.5 表达产物的鉴定及可溶性分析 经12% SDSPAGE 分析,表达蛋白相对分子质量约为19 000,超声后主要以包涵体形式存在,在37 ℃,0.8 mmol / L IPTG 诱导条件下,表达量最多,见图4。

图4 原核表达产物的SDS-PAGE 分析Fig.4 SDA-PAGE profile of expressed PD-1 extracellular region
2.6 纯化产物的鉴定 经12% SDS-PAGE 分析,可见相对分子质量约为19 000 的蛋白条带,大小与预期一致,见图5。经Western blot 分析,纯化的牛PD-1蛋白能与His 标签单抗发生特异性反应,可见相对分子质量约19 000 的蛋白条带,表明该蛋白具有良好的抗原性,见图6。
2.7 多抗血清效价 1 ~3 号小鼠的多抗血清效价分别为 1 ∶102 400、1 ∶12 800 及 1 ∶204 800。
2.8 多抗血清免疫活性 经12% SDS-PAGE 分析,可见相对分子质量约为19 000 的特异蛋白条带,表明多抗血清能与目的蛋白发生特异性反应,具有良好的免疫活性。见图7。

图 5 纯化牛PD-1 蛋白的 SDS-PAGE 鉴定Fig 5.SDS-PAGE profile of purified bovine PD-1 protein
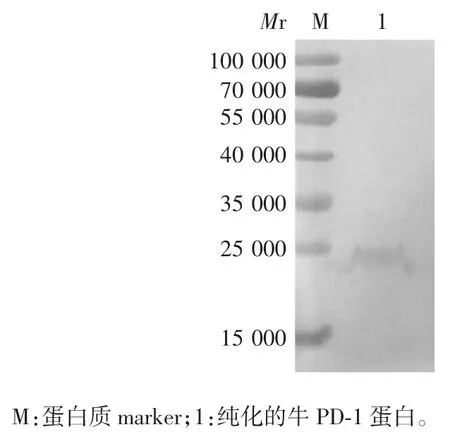
图 6 纯化牛PD-1 蛋白的Western blot 鉴定Fig 6.Western blotting of purified bovine PD-1 protein

图7 牛PD-1 蛋白多抗血清的Western blot 鉴定Fig 7.Western blotting of recombinant PD-1 protein with polyclonal antibody
2.9 BVDV 病毒拷贝数 PBL 悬浮液中BVDV CP+PD-1 多抗组及BVDV NCP + PD-1 多抗组与BVDV CP 组及BVDV NCP 组相比,拷贝数显着降低,差异均有统计学意义(t = 3.413,P < 0.05;t = 3.001,P <0.01)。见图9。表明PD-1 阻断导致感染BVDV 的PBL 悬浮液病毒量显著降低。
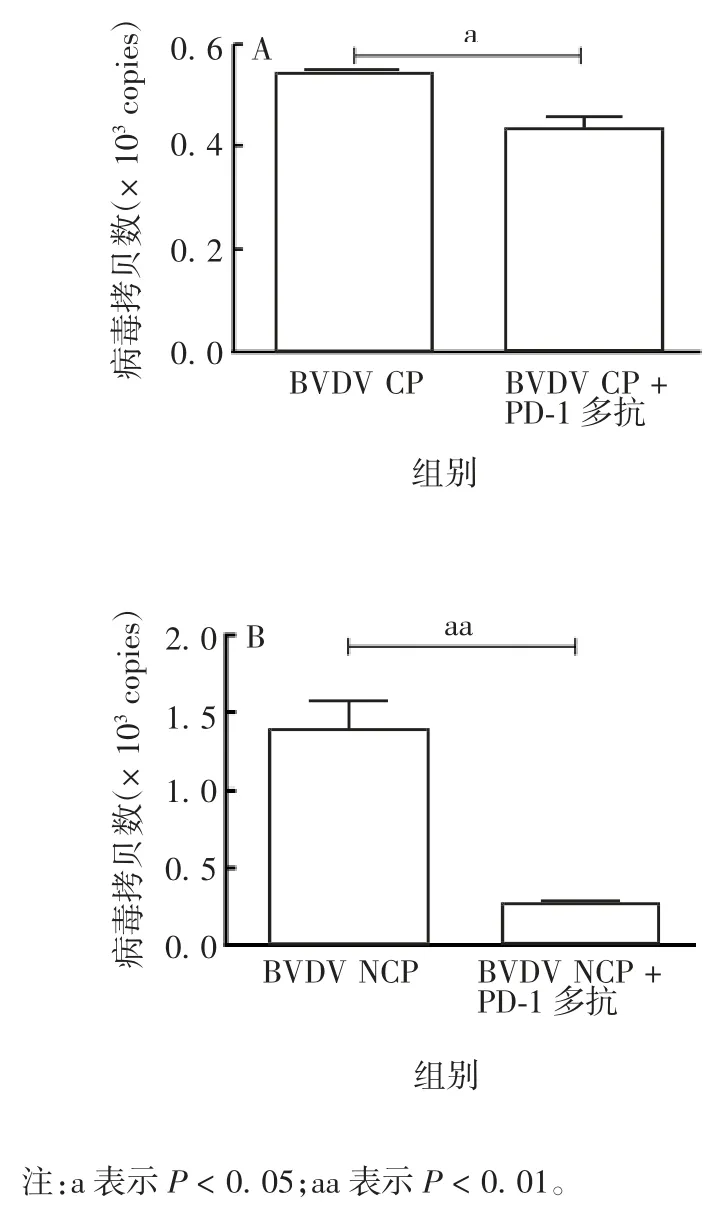
图 8 CP 型 BVDV(A)及 NCP 型 BVDV(B)病毒拷贝数Fig 8.Copy numbers of BVDV of types CP(A)and NCP(B)
3 讨 论
PD-1 为CD28 超家族的一员,通过消减杂交从凋亡诱导的T 细胞杂交瘤2B4.11 中分离。牛PD-1为282 个氨基酸的Ⅰ型膜蛋白,其对应于残基27 至171 的细胞外结构域(含免疫球蛋白结构域),随后是跨膜区域及细胞内尾巴[11],牛PD-L1 是289 个氨基酸的Ⅰ型跨膜蛋白,细胞外结构域为残基33 至224,主要在活化的免疫细胞中表达[12],因此,本实验采集牛外周血,分离牛PBL,采用RT-PCR 法扩增牛PD-1 的胞外区基因序列,其片段大小为448 bp,生物信息学分析发现牛PD-1 胞外区基因编码147 个氨基酸,相对分子质量为16 040,等电点为7.77,为一种亲水性蛋白,属Ig 超家族成员。
有研究显示,当病毒感染机体后,多种免疫细胞分泌效应性细胞因子,诱导PD-1、PD-L1 高效表达[13]。史继静等[14]利用原核表达体系成功表达了人的PD-1 胞外蛋白,制备的多克隆抗体能检测自然状态下人PD-1 蛋白。有研究发现,重组的PD-1 融合蛋白可刺激T 细胞的增殖[15]。为表达牛PD-1 胞外区蛋白在免疫调节中的作用,本文构建了牛PD-1 胞外区的原核表达质粒,表达牛PD-1 蛋白。通过MEGE 6.0 和Lasergene 7.1 进行同源性比较,发现与奶牛和瘤牛PD-1 胞外区序列同源性达100%,与牦牛、野生牦牛及水牛的同源性为99.3%、98.9%和97.7%,与绵羊及山羊的同源性为93.6%和91.5%。与人及鼠的序列同源性分别为79%和71%。将重组质粒转化至BL21 中,获得了相对分子质量约19 000的重组蛋白,与抗His 标签单抗产生特异性反应,具有良好的抗原性。
研究表明,HIV、HBV、LCMV、BLV、CSFV 等病毒能诱导活化的T 细胞表面PD-1、PD-L1 表达上调,且持续高表达;同时发现,利用PD-1 单克隆抗体阻断 PD-1 / PD-L1 通路可使 T 细胞功能恢复[16]。为研究PD-1/PD-L1 通路在牛慢性病毒感染过程中的作用,本文使用纯化后具有良好的免疫原性的PD-1胞外区重组蛋白免疫小鼠,眼球采血制备多抗血清,其抗体效价最高达1 ∶204 800,且能与目的蛋白发生反应,表明获取的PD-1 胞外区多抗血清具有较好的免疫活性。在犬、牛等免疫抑制性疾病的抗PD-1 单克隆抗体阻断试验发现,阻断后病毒载量下降[9,17-18]。本实验使用多抗血清阻断体外感染BVDV 的PBL细胞,病毒加入抗体组的病毒载量显著下降,表明该多抗血清可抑制病毒复制。
在兽医领域中,阻断PD-1 / PD-L1 途径在衰竭的T 细胞与T 细胞分化及表型研究中起重要作用,成为研究抗病毒感染的新靶标。本实验成功制备了原核表达的纯化牛PD-1 蛋白及其多抗血清,为开发具有调节及治疗慢性病毒感染的制品奠定了基础。
