猪圆环病毒2b 亚型Cap 融合蛋白的原核表达及其免疫原性分析
2021-01-19李国秀欧云文马炳李茜代军飞丁耀忠刘磊张杰
李国秀 ,欧云文 ,马炳 ,李茜 ,代军飞 ,丁耀忠 ,刘磊 ,张杰
1.甘肃农业大学动物医学院,甘肃兰州730070;2.中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室,甘肃兰州730046;3.开江县动物疫病预防控制中心,四川达州636250
猪圆环病毒(porcine circovirus,PCV)主要分为3 个基因型,即 PCV1、PCV2 和 PCV3[1-2],PCV2 属无囊膜的、单股、环状、负链DNA 病毒,为已知最小的动物病毒之一,是断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)、皮炎和肾病综合征(porcine dermatitis and nephropathy synd-rome,PNDS)的主要病原[3]。临床特征为坏死性淋巴结炎、急性肺水肿、生殖障碍及肉芽肿性肠炎,严重制约全球养猪业的持续健康发展[4-5]。PCV2包括 PCV2a、PCV2b、PCV2c、PCV2d 及 PCV2e 基因亚型,其中PCV2b 是中国猪群中主要流行的基因亚型[1,6]。PCV2 病毒粒子呈球形,直径 12 ~ 23 nm,基因组大小约为1 760 bp,含11 个开放阅读框(open reading frame,ORF),其中 ORF1、ORF5、ORF7 及 ORF-10 位于病毒基因组正链,其他ORF 位于基因组互补链。ORF1 编码病毒复制蛋白,即 Rep 蛋白[1,7-8];ORF2 编码病毒衣壳蛋白,即Cap 蛋白,该蛋白由233 ~234 个氨基酸组成,相对分子质量约278 000,其N-端富含碱性氨基酸,序列高度保守。Cap 蛋白前41个氨基酸是核定位信号肽序列,第69 ~83 位和第117 ~131 位氨基酸是Cap 蛋白的2 个主要特异性抗原表位[9-10]。麦芽糖结合蛋白(matlose binding protein,MBP)作为重要的标签蛋白,可融合在蛋白的N-或C-端,增强细菌中过表达融合蛋白的溶解性,屏蔽毒性蛋白。同时,MBP 标签纯化技术采用麦芽糖温和洗脱,无去污剂或变性剂对蛋白活性的影响。
本研究以PCV2b 亚型 Cap 蛋白编码基因的优化序列为目的片段,采用pMAL-C4x 原核表达系统可溶性表达MBP-Cap 融合蛋白,并对其进行纯化和免疫原性分析,以期为PCV2b 病毒样颗粒(virus like particle,VLP)的体外组装及诊断试剂盒的开发奠定基础。
1 材料与方法
1.1 菌株及质粒 感受态大肠埃希菌BL21(DE3)、DH5α 由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;His-Sumo-PCV2b-Cap-pUC57 重组质粒由上海玉博生物科技有限公司合成;pMAL-C4x 载体购自美国NEB 公司。
1.2 实验动物 SPF 级 BALB / c 小鼠,12 只,雄性,6 周龄,体重17 ~20 g,购自中国农业科学院兰州兽医研究所实验动物中心,动物合格证号:SCXK(甘)-2015-0001。
1.3 主要试剂及仪器 DNA marker、蛋白质marker、EcoRⅠ及PstⅠ限制性内切酶、Ex-Taq DNA 聚合酶均购自宝生物工程(大连)有限公司;直链淀粉树脂及兔抗MBP-tag 多克隆抗体购自美国NEB 公司;PCV2b 阳性猪血清购自美国VMRD 公司;质粒小量制备试剂盒、DNA 胶回收试剂盒及PCR 清洁试剂盒均购自美国AxyPrep 公司;IPTG 及氨苄西林购自北京索莱宝生物科技有限公司;HRP 标记的兔抗猪IgG、山羊抗兔IgG 及弗氏完全 / 不完全佐剂均购自德国Sigma 公司;蛋白胨、酵母提取物购自英国OXOID公司;其他试剂为国产分析纯。
1.4 引物设计及合成 以PCV2 毒株(CAU0673)基因组为参考序列,His-Sumo-PCV2b-Cap-pUC57 重组质粒为模板,设计特异性引物,上游引物:5′-CGGAATTCCACCACCACCACCACCATGGTAGCGGT-3′(下划线部分为EcoRⅠ酶切位点);下游引物:5′-AACTGCAGTTACGGGTTCAGCGGCGGATCTTTC-3(′下划线部分为PstⅠ酶切位点)。引物由西安擎科生物科技有限公司合成。
1.5 目的片段PCV2-Cap-pUC57 的扩增 以His-Sumo-PCV2b-Cap-pUC57 重组质粒为模板,PCR 扩增1 047 bp 目的片段。PCR 反应条件:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,共 35 个循环;72 ℃延伸10 min。扩增产物进行1%琼脂糖凝胶电泳鉴定,以ddH2O 作为阴性对照。凝胶回收目的片段,-20 ℃保存。
1.6 重组质粒的构建 采用EcoRⅠ及PstⅠ分别双酶切pMAL-C4x 载体和PCR 凝胶回收产物,酶切产物经T4 连接酶16 ℃连接过夜;取连接产物热激转化于感受态大肠埃希菌 DH5α 及 BL21(DE3),涂布于终浓度为0.3 mmol / L 氨苄西林抗性的LA 平板,37 ℃培养12 h;挑取单菌落接种于LB 培养液,37 ℃,200 r / min 培养 8 h;5 800 × g 离心 5 min,提取质粒,进行PCR 及酶切鉴定。将鉴定正确的重组质粒送苏州金唯智(GENEWIZ)生物科技有限公司测序,测序正确的重组质粒命名为pMAL-C4x-PCV2b-Cap。
1.7 融合蛋白MBP-Cap 的表达及可溶性分析 将重组表达菌 BL21(DE3)接种于 LB 培养液,37 ℃振荡培养约 2 h,菌液 A600为 0.6 ~ 1.0 时,优化表达条件,进行IPTG 诱导表达。IPTG 终浓度设为0.5、1 及 1.5 mmol / L;诱导温度设为 16、28 及 37 ℃;诱导时间设为 6、12 及 24 h。5 800 × g 离心 5 min收菌,1 × PBS 悬浮洗涤 3 次,菌体进行 8% SDSPAGE 分析,以未诱导的菌体及pMAL-C4x 空载体为对照。适量过柱缓冲液Buffer C(1 mmoL / L Tris-HCl,0.2 moL / L NaCl 及 1 mmoL / L EDTA)悬浮诱导后的菌体,冰浴超声裂解20 min,9 800 × g 离心10 min,收集上清裂解液及沉淀,经8% SDS-PAGE分析融合蛋白的表达形式。
1.8 融合蛋白MBP-Cap 的纯化 按直链淀粉树脂使用说明书,取适量直链淀粉树脂,制备蛋白纯化层析柱,并采用5 倍柱体积的过柱缓冲液Buffer C平衡树脂柱3 次,上清裂解液与直链淀粉树脂4 ℃结合6 h,控制流速为2 mL / min,将流穿液重复上柱结合1 ~2 次;用15 倍柱体积的过柱缓冲液Buffer C 洗涤杂蛋白,再用8 倍柱体积的10 mmoL / L 的麦芽糖缓冲液洗脱目的蛋白,收集流穿液(分别标记为C1 ~C10阶段),测定各流穿液A280,并进行8% SDS-PAGE分析,收集含有目的蛋白的流穿液,PBS 缓冲液超滤置换。
1.9 融合蛋白MBP-Cap 纯化产物的分析 采用Western blot 法。纯化的融合蛋白MBP-Cap 经8%SDS-PAGE 分离,转印至 2 张 PVDF 膜,5%脱脂奶粉室温封闭1 h;分别加入PCV2b 阳性猪血清(1 ∶100稀释)及兔抗 MBP-tag 多克隆抗体(1 ∶2 000 稀释),4 ℃,70 r / min 摇床孵育过夜;1 × PBST 洗涤 5 次,10 min / 次;分别加入 HRP 标记的兔抗猪 IgG(1 ∶6 000 稀释)及山羊抗兔 IgG(1 ∶5000 稀释),室温摇床孵育 1 h;1 × PBST 洗涤 5 次,避光显色 1 min,暗室曝光,同时设pMAL-C4x 空载体为阴性对照。
1.10 动物免疫 选取12 只健康的BALB/c 小鼠,其中4 只放血致死,制备空白对照血清;其余8 只分为融合蛋白MBP-Cap 组及PBS 组,每组4 只,经背部多点皮下注射,共免疫4 次,间隔14 d。融合蛋白MBP-Cap 组免疫剂量50 μg/只,首次及加强免疫时,分别与弗氏完全佐剂和弗氏不完全佐剂等量乳化;PBS 组免疫剂量为 0.2 mL / 只。末次免疫 7 d后,放血致死,制备血清,-20 ℃保存。
1.11 免疫小鼠血清抗体特异性的检测 采用Western blot 法。融合蛋白MBP-Cap 经8% SDS-PAGE分离,转印至PVDF 膜,5%脱脂奶粉室温封闭过夜,分别以制备的2 组小鼠抗血清及空白对照血清为一抗(1 ∶500 稀释),HRP 标记的山羊抗鼠 IgG 为二抗(1 ∶6 000 稀释),避光显色 1 min,暗室曝光,同时设pMAL-C4x 空载体为阴性对照。
2 结 果
2.1 PCV2-Cap-pUC57 目的片段的鉴定 PCR 产物经1%琼脂糖凝胶电泳分析,可见1 条1 047 bp 的目的片段,大小与预期一致,见图1。
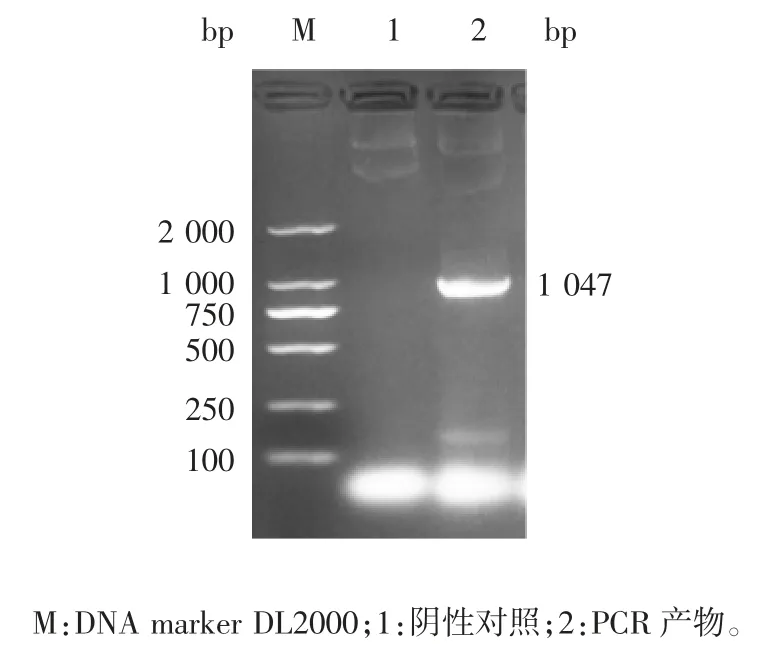
图1 PCV2b-Cap-pUC57 片段的PCR 鉴定Fig.1 Identification of PCV2b-Cap-pUC57 gene fragment by PCR
2.2 重组质粒的鉴定 重组质粒pMAL-C4x-PCV2b-Cap 经1%琼脂糖凝胶电泳分析,可见1 047 bp 的目的片段,大小与预期一致,阴性对照无目的条带,见图2;重组质粒双酶切产物经1%琼脂糖凝胶电泳分析,可见1 047 bp 的目的基因片段及6 645 bp的pMAL-C4x 载体片段,大小与预期一致,而阴性对照无目的条带,见图3。测序结果表明pMAL-C4x-PCV2b-Cap 重组质粒构建正确。
2.3 表达产物的可溶性分析 在不同诱导剂浓度、诱导时间、诱导温度下,目的蛋白表达量无明显差异,选择终浓度为 1 mmol / L 的 IPTG,37 ℃诱导 6 h为诱导表达条件。表达产物经8% SDS-PAGE 分析,融合蛋白MBP-Cap 主要以可溶性形式存在,相对分子质量约81 000,大小与理论值一致,见图4。
2.4 纯化融合蛋白MBP-Cap 的分析 经直链淀粉树脂纯化,融合蛋白MBP-Cap 主要存在于C2 流穿液,其中在C1 ~C4 阶段出现较集中的洗脱峰,见图5和图6。

图2 重组质粒PCR 产物的鉴定Fig.2 Identification of recombinant plasmids by PCR
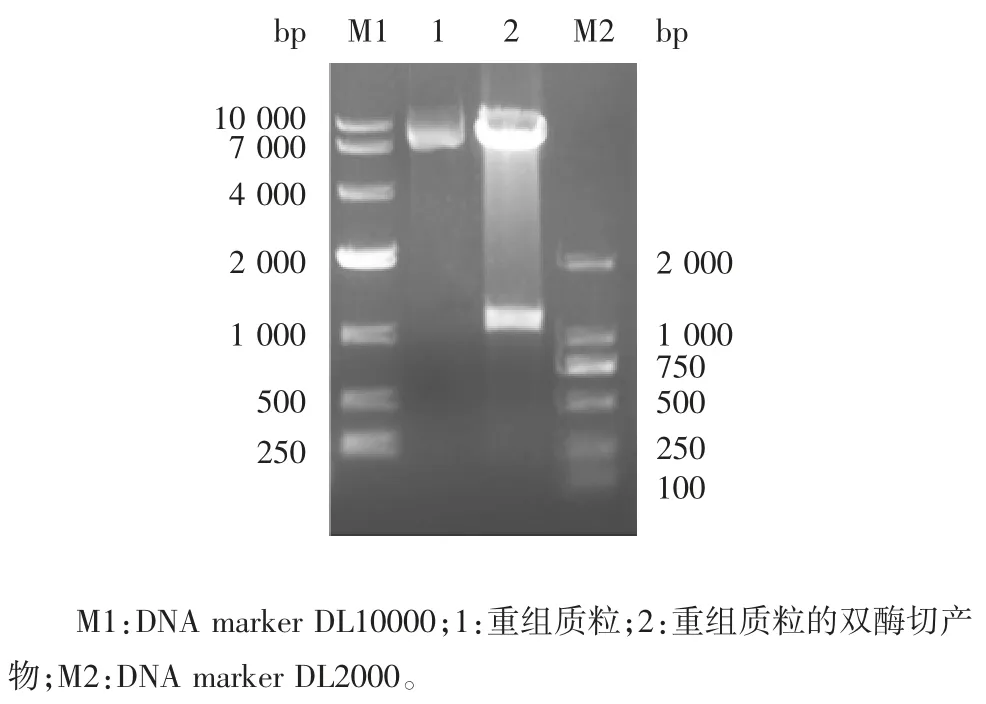
图3 重组质粒pMAL-C4x-PCV2b-Cap 的双酶切(EcoRⅠ/PstⅠ)鉴定Fig.3 Restriction map of recombinant plasmid pMAL-C4x-PCV2b-Cap(EcoRⅠ/ PstⅠ)

图4 融合蛋白MBP-Cap 的SDS-PAGE 分析Fig.4 SDS-PAGE profile of MBP-Cap fusion protein
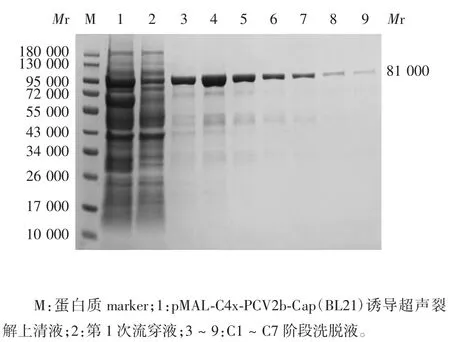
图5 纯化融合蛋白MBP-Cap 的SDS-PAGE 分析Fig.5 SDS-PAGE profile of purified MBP-Cap protein
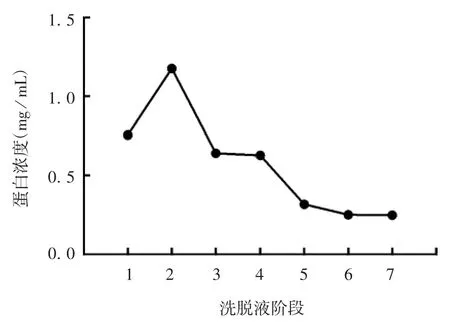
图6 洗脱液蛋白浓度Fig.6 Protein concentration of eluants
2.5 融合蛋白MBP-Cap 的鉴定 经Western blot分析,纯化融合蛋白MBP-Cap 与PCV2b 阳性猪血清及兔抗MBP-tag 多克隆抗体均发生特异性反应,于相对分子质量约81 000 处出现特异性蛋白条带,而pMAL-C4x 空载体无特异性条带,见图7。表明该蛋白具有较好的反应原性。

图7 纯化融合蛋白MBP-Cap 的Western blot 分析Fig.7 Western blotting of purified MBP-Cap protein
2.6 免疫小鼠血清的抗体特异性 经Western blot 分析,融合蛋白MBP-Cap 组在相对分子质量约81 000处出现特异性的蛋白条带,PBS 组、空白血清对照组及pMAL-C4x 空载体均无条带,见图8。表明融合蛋白MBP-Cap 可与免疫小鼠血清发生特异性反应,具有较好的免疫原性。
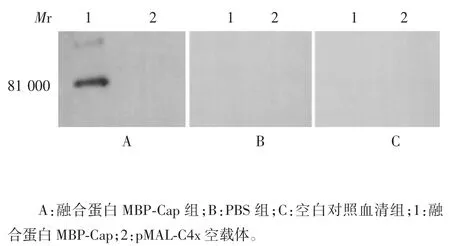
图8 免疫小鼠血清的Western blot 分析Fig 8.Western blotting of antisera of immunized mice
3 讨 论
Cap 蛋白作为一种免疫相关性蛋白,在病毒入侵宿主细胞及复制过程中起重要作用[11]。有学者发现,PCV2 通过Cap 蛋白与宿主细胞表面的特异性受体结合,由网格蛋白介导的内吞途径进入宿主细胞[12]。因此,Cap 蛋白常作为 PCV2 分子病原学、致病机理及诊断技术等研究的靶蛋白[13]。国内外学者先后采用真核及杆状病毒表达系统等表达Cap蛋白,为Cap 蛋白的研究奠定了坚实的基础[14-15]。
本研究前期采用包涵体形式原核表达,Ni-NTA 树脂亲和层析纯化,不同浓度尿素复性,获得了较高纯度的重组Cap 蛋白,但需对纯化后蛋白进行复性处理[16]。大肠埃希菌具有生长速度快、培养经济快捷、表达水平高、待选质粒及宿主多等特点,是常用的蛋白表达系统,但外源蛋白在大肠埃希菌中高水平表达的同时,容易被宿主蛋白酶降解或形成包涵体。因此,探索外源蛋白在大肠埃希菌中的可溶性表达具有较高的学术价值以及广泛的应用前景。pMAL 系列载体含有mal E 信号序列,引导融合蛋白穿过胞质膜,进入周质,实现蛋白的可溶性表达,进而有利于形成二硫键,促进蛋白折叠。
本实验以PCV2 毒株(CAU0673)基因组为参考序列,His-Sumo-PCV2b-Cap-pUC57 重组质粒为模板,PCR 扩增并构建pMAL-C4x-PCV2b-Cap 重组表达载体,经IPTG 诱导表达,直链淀粉树脂纯化,进而实现融合蛋白MBP-Cap 的原核可溶性表达,该融合蛋白相对分子质量约81 000,纯化后可与PCV2b 阳性猪血清、兔抗MBP-tag 多克隆抗体发生特异性反应,表明其具有良好的反应原性。以纯化的融合蛋白MBP-Cap 免疫 BALB / c 小鼠,制备免疫小鼠血清,可与融合蛋白MBP-Cap 发生特异性反应,表明该融合蛋白具有良好的免疫原性。
综上所述,本实验成功构建了pMAL-C4x-PCV2b-Cap 重组表达载体,可溶性诱导表达出融合蛋白MBPCap,纯化后的融合蛋白具有较好的免疫原性。该蛋白可用于PCV2b 疫苗及诊断制剂的研发,为PCV2b的防控及诊断奠定了理论基础。
