温度对亚洲小车蝗成虫体内呼吸代谢相关酶和抗氧化酶活性的影响
2021-01-12高书晶韩海斌徐林波董瑞文娜仁满都呼娜布其亚
郭 娜, 高书晶,*, 王 宁, 韩海斌, 徐林波, 董瑞文,娜仁满都呼, 娜布其亚
(1. 中国农业科学院草原研究所, 呼和浩特 010010; 2. 乌兰察布盟四子王旗草原站, 内蒙古乌兰察布 011800)
温度与昆虫个体发育及种群的动态变化有密切联系,可对昆虫个体的生长发育、生存、行为、生殖等方面产生直接或间接的影响(Battistietal., 2006; 陈丽芳等, 2015)。同时温度决定昆虫地理分布(Uminaetal., 2005)、发生期(Dingemanse and Kalkman, 2008)、种群丰富度(Yamamuraetal., 2005)等。温度是影响昆虫生长发育的主要生态因子,适宜的环境温度有利于昆虫生长发育,酶和激素的活性较强,可缩短昆虫产卵时间和发育历期,加快其繁殖速度。当温度超过一定阈值时昆虫体内水分流失量大,体表蜡质层瓦解,体内水分平衡被打破, 酶和激素的活性受到抑制甚至是破坏, 极端高温会对昆虫造成胁迫, 严重时直接导致昆虫死亡(Hallman and Denlinger, 1998; 杜尧等, 2007)。当环境温度不适宜时昆虫主要通过行为和生理两种途径来适应和抵御不良环境,行为上主要通过改变呼吸频率、取食量和交配期等来适应胁迫;生理上通过调节代谢机制进行自我保护。昆虫抵御温度胁迫的代谢水平主要包括呼吸代谢水平和抗氧化代谢水平。呼吸代谢一般是指由多种酶、辅酶以及一些其他因素参与的消耗能源物质的一系列酶反应过程(陈菊红等, 2018);能源物质消耗过程所涉及酶包括糖类代谢相关酶3-磷酸甘油醛脱氢酶(GAPDH)和3-磷酸甘油脱氢酶(GDH),脂肪代谢相关酶3-羟酰辅酶A脱氢酶(HOAD)以及参与三羧酸循环的柠檬酸合成酶(CS),其中GAPDH是糖酵解的一种关键酶, 且GAPDH与HOAD活性的比值可判断昆虫呼吸代谢消耗的能源物质类型(Beenakkersetal., 1984; 袁瑞玲等, 2015)。抗氧化代谢中的抗氧化保护酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等, 外界环境对昆虫机体产生刺激或造成胁迫时,昆虫体内活性氧急速增加,此时机体内产生一系列酶作用的抗氧化生化反应,SOD在昆虫体内能够特异清除超氧阴离子自由基并产生H2O2和O2,CAT和POD可进一步分解清除H2O2,此三者共同作用维护机体内活性氧代谢平衡(唐维媛等, 2016)。研究温度对昆虫代谢相关酶活性的影响, 能够掌握昆虫适宜生存的地理范围及其对极端气候条件的适应机制,为昆虫种群动态预测提供科学依据。
亚洲小车蝗Oedaleusasiaticus隶属直翅目(Orthoptera)蝗总科(Acridoidea)斑翅蝗科(Oedipodidae)斑翅蝗亚科(Oedipodinae)小车蝗属Oedaleus,是我国北方地区为害最为严重的优势种蝗虫之一(高书晶等, 2016)。该虫取食包括禾本科、莎草科植物等12种左右草类(康乐和陈永林, 1994)。牧草被蝗虫啃食后,草场快速枯黄,地表大面积裸露,对草原生态环境带来不良后果,同时严重影响畜牧业可持续发展(李万春等, 2004; 李广, 2007)。亚洲小车蝗具有远距离迁飞习性,全球气候变暖导致其分布区域扩大、越冬存活率增加、发生期提前等发生规律变化,给防治工作带来了极大困难(杜桂林等, 2018)。亚洲小车蝗属变温动物,自身对温度具有一定的调节能力,其体温会随环境温度发生改变,适宜的环境温度有利于其生长发育和繁殖,高温或低温会抑制发育(倪绍祥等, 2000)。亚洲小车蝗不同发育期对温度的需求不同,大多数对亚洲小车蝗的研究实验中将23~29℃设为其成虫期生长发育的适宜温度。温度还影响亚洲小车蝗的取食和产卵等生命活动(张未仲, 2013),有研究表明温度增加1~2℃可促进毛足棒角蝗Dasyhippusbarbipes, 亚洲小车蝗Oedaleusasiaticus和小翅雏蝗Chorthippusfallax卵和蝗蝻的发育, 分布区出现向北扩散的趋势(Guoetal., 2008)。在当前全球气候变化的背景下亚洲小车蝗的局部发生和扩散现象普遍存在,为了明确气候变化对亚洲小车蝗种群发生与为害的影响及亚洲小车蝗适应不同温度过程中的能量消耗和分配策略,从而预测其应对胁迫环境时能量代谢途径调控的机制。本研究探讨了18~42℃温度范围内亚洲小车蝗成虫呼吸代谢相关酶和抗氧化酶活性,解析温度变化下各代谢水平的酶学机制及其消耗能源物质种类,以期为揭示气候变暖条件下蝗虫适应机理及为有效监测其发生危害和迁飞扩散提供理论依据和参考。
1 材料与方法
1.1 供试虫源
供试亚洲小车蝗采集于内蒙古自治区四子王旗(41°52′N, 111°56′E)和镶黄旗(42°10′N, 114°24′E)。采集后于养虫笼中自然条件下饲养,每日取等量新鲜玉米叶和小麦苗并辅以少量麦麸喂食,饲养至成虫备用。雌雄虫在蝗蝻期不易辨别,成虫期形态有所差异。雌性成虫体型较雄性大, 且腹部末端有明显的瓣状产卵器,雄性腹部末端细长闭合略呈尖状。
1.2 亚洲小车蝗体内相关酶提取及活性测定
选取体型相似且健壮的亚洲小车蝗4日龄雌雄成虫个体, 将试虫于18~42℃以3℃为间隔, 设置 18, 21, 24, 27, 30, 33, 36, 39和42℃共9个温度梯度,人工气候箱中无光处理4 h(确保试虫处于静息状态),后于室温条件下恢复1 h。统计各处理试虫死亡率并用液氮处死后于-80℃冰箱保存。每一温度处理20头虫(♀∶♂=1∶1),各温度处理设置3个重复。
-80℃冰箱中逐个取出待处理蝗虫去除其头、足、翅等部位只保留胸部和腹部, 在预先冷处理过的手持匀浆器加入液氮后迅速将蝗虫躯干磨碎并倒入1.5 mL离心管中, 加入配制好的预先冷处理的提取液(1∶1, v/v, 提取液试剂盒内附)后震荡离心管30 s使其充分混匀, 冰上静置10 min后重复震荡2~3次得到组织匀浆。将匀浆在4℃ 10 000 r/min条件下离心15 min,离心完成后仔细取其上清液至干净的1.5 mL离心管中,此上清液即为测试酶提取液。GAPDH, GPDH和HOAD试剂盒由北京天根生化科技有限公司生产提供,CS, SOD, CAT和POD试剂盒由上海酶联生物科技有限公司提供。酶液提取后利用考马斯亮蓝G-250试剂测定,酶标分析仪(Spectra Max Plus 384)在595 nm波长下测量相应酶吸光度OD值。
样品酶活力的计算: (1)标准曲线制作: 标准品的酶活力分别为0, 3, 6, 12, 24 和48 U/L, 测定标准品的OD 值, 然后以酶活力为纵坐标, 测定的OD值为横坐标绘制标准曲线, 7种酶的标准曲线分别为HOAD:y=25.374x-2.5537 (R2=0.9995); GAPDH:y=63.628x-3.5416 (R2=0.9971); GPDH:y=77.22x-3.9655 (R2=0.9972); CS:y=53.34x-0.9483 (R2=0.9941); POD:y=197.01x+2.6958 (R2=0.9901); SOD:y=117.34x-1.8484 (R2=0.9961); CAT:y=42.969x-2.7767 (R2=0.9988)。(2)计算样品酶活力: 将测定的样品OD值代入不同酶的标准曲线计算出样品酶活力(U/L),再乘以稀释倍数,即为样品实际酶活力(U/L)。(3)样品折算酶活力的计算: 样品折算酶活力(U/g FW)=样品实际酶活力/组织匀浆, 组织匀浆即为100 g FW/L。以样品折算酶活力作为结果中样品的酶活性。
1.3 数据分析
采用DPS数据处理系统v15.10对数据进行处理。使用单因素方差分析(ANOVA)对9个处理温度下亚洲小车蝗成虫呼吸代谢相关酶活性数据进行方差分析,并采用最小显著差异(LSD)法对其差异显著性进行多重比较;同一处理温度下亚洲小车蝗雌、雄成虫间呼吸代谢及抗氧化相关酶活性的差异显著性采用t检验法进行分析。
2 结果
2.1 温度对亚洲小车蝗成虫体内糖类代谢酶活性的影响
温度的改变引起亚洲小车蝗雌雄成虫体内糖类代谢酶GAPDH活性发生改变,在18~42℃范围内温度不断升高过程中,酶活性呈先增后减的趋势(图1: A)。不同温度处理下雌雄虫酶活性均在33℃时达最大值,分别为0.79±0.02和0.97±0.02 U/g FW;雌雄虫酶活性都于18℃呈最低值,分别为0.24±0.02和0.39±0.02 U/g FW。不同温度处理下,亚洲小车蝗体内GAPDH活性在雌虫之间、雄虫之间存在显著差异(P<0.05);同一温度处理下,雌雄虫间36℃下无显著差异(P>0.05),其他温度下差异显著(P<0.05)。该实验温度条件下雄虫体内GAPDH活性普遍高于雌虫。
随温度升高GPDH活性在亚洲小车蝗成虫体内先增后减(图1: B),在27℃时雌雄虫体内GPDH活性最高, 分别为0.92±0.01和1.16±0.01 U/g FW;18℃时活性最低,雌虫为0.25±0.02 U/g FW,雄虫为0.39±0.02 U/g FW。雌虫之间、雄虫之间在不同温度条件下差异显著(P<0.05),相同温度处理下雌雄虫间除42℃外均存在显著差异(P<0.05),且雄虫GPDH活性整体较雌虫高。

图1 不同温度下亚洲小车蝗成虫体内的GAPDH(A)和GPDH(B)活性
2.2 温度对亚洲小车蝗成虫体内脂类代谢酶活性的影响
温度显著影响亚洲小车蝗成虫体内脂类代谢酶HOAD活性(图2)。亚洲小车蝗体内HOAD活性在18~42℃范围内呈现先增后减的变化趋势。不同温度处理下雌雄虫HOAD活性均在33℃达最大值,分别为0.36±0.01和0.38±0.01 U/g FW;在18℃时呈最小值,分别为0.09±0.01和0.12±0.01 U/g FW。不同温度处理下雌虫之间、雄虫之间HOAD活性在39和42℃差异不显著(P>0.05),其他温度处理下差异显著(P<0.05);同一处理温度下HOAD活性在24, 27, 33和36℃下雌雄虫间差异不显著(P>0.05),其他处理温度下差异显著(P<0.05)。
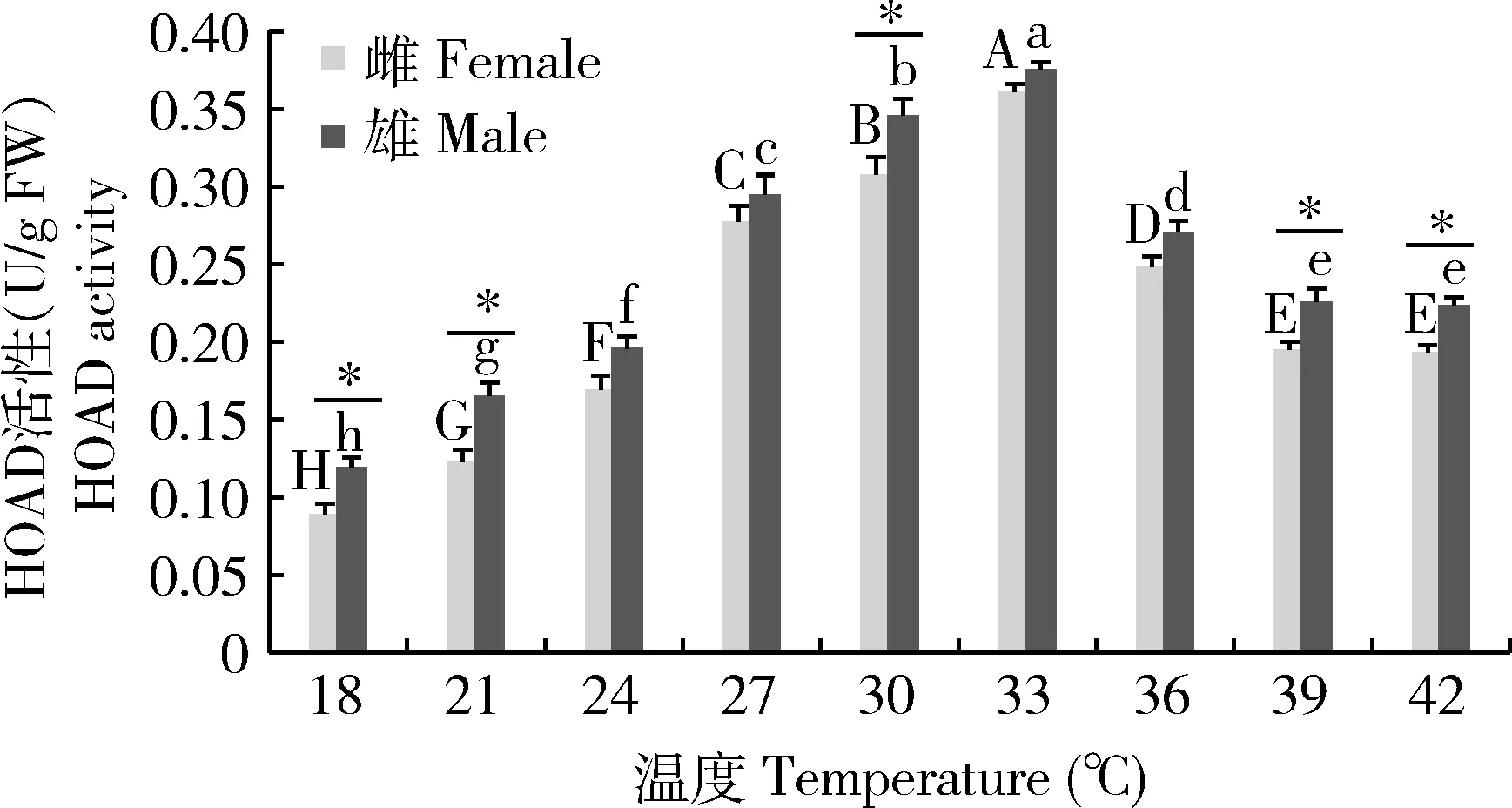
图2 不同温度下亚洲小车蝗成虫体内的HOAD活性
2.3 温度对亚洲小车蝗成虫体内三羧酸循环关键酶活性的影响
温度显著影响亚洲小车蝗成虫体内CS活性(图3)。随温度升高亚洲小车蝗成虫体内CS活性呈现先增后减的变化趋势,不同处理温度下雌雄虫CS活性均在39℃达到最大值,分别为0.84±0.03和0.92±0.01 U/g FW;雌虫CS活性均在21℃时出现最小值,为0.48±0.01 U/g FW, 雄虫在18℃时呈现最小值,为0.55±0.02 U/g FW;不同处理下雌虫之间、雄虫之间CS性差异显著(P<0.05)。同一处理温度下21和39℃处理下雌雄虫间CS活性差异显著(P<0.05),其他温度下差异不显著(P>0.05)。
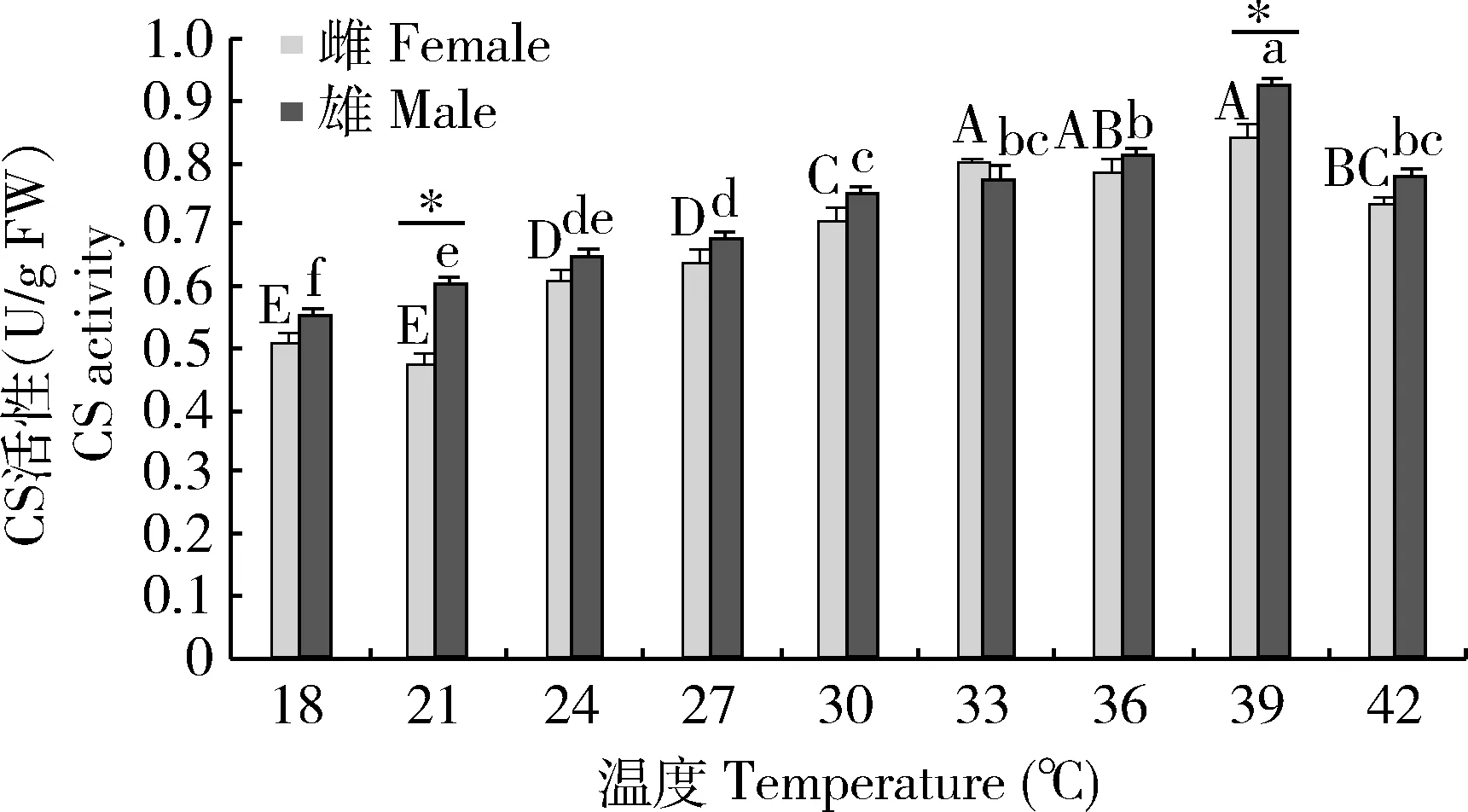
图3 不同温度下亚洲小车蝗成虫体内的CS活性
2.4 不同温度下亚洲小车蝗成虫体内呼吸代谢能源物质的利用
糖类和脂肪是昆虫生理活动中主要利用的能源物质,GAPDH与HOAD活性比值一直被作为判断其能量利用类型的指标(Beenakkers, 1969; 韩兰芝等, 2005),即两者比值远大于1时能量代谢为糖类利用型,小于1时为脂类利用型。如表1结果所示,在18~42℃温度下亚洲小车蝗成虫体内GAPDH活性与HOAD活性之比雌虫比值范围为1.99~2.93,雄虫比值范围为2.43~3.31。比值远大于1说明此实验条件下亚洲小车蝗雌雄虫能量利用类型均为糖类利用型。
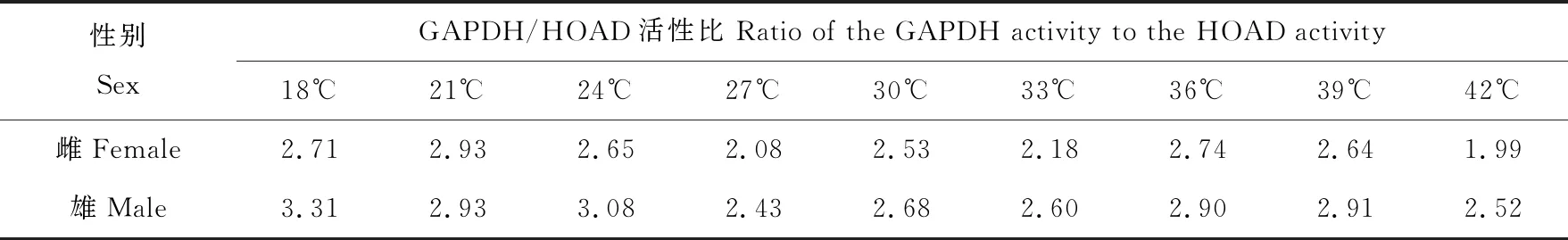
表1 不同处理温度下亚洲小车蝗成虫体内GAPDH与HOAD活性比值
2.5 温度对亚洲小车蝗成虫体内抗氧化酶活性的影响
温度显著影响亚洲小车蝗成虫体内SOD, POD和CAT 3种抗氧化酶活性(图4: A, B, C)。18~42℃温度范围下亚洲小车蝗体内3种抗氧化酶活性随温度不断升高, 均呈现先增后减的变化趋势。SOD, POD和CAT活性均于30℃时达最大值,雌虫分别为1.73±0.01, 3.04±0.05和0.71±0.03 U/mg FW, 雄虫分别为1.67±0.04, 3.43±0.09和0.74±0.02 U/mg FW; 18℃时出现最小值,雌虫分别为0.85±0.04, 1.93±0.05和0.40±0.01 U/mg FW,雄虫分别为0.92±0.01, 2.18±0.02和0.45±0.01 U/mg FW。
3种抗氧化酶活性在大多数温度下雌雄虫间均存在显著差异。同一温度处理下SOD活性在18和30℃处理温度下雌雄虫间差异不显著(P>0.05), 其他同一处理温度下雌雄虫间均存在显著差异(P<0.05)。同一温度下雌雄虫之间POD活性在21, 24, 27和39℃处理下差异不显著(P>0.05),其他处理下差异显著(P<0.05)。雄虫POD活性整体较雌虫高。同一温度下雌雄虫之间CAT活性在24, 36和39℃处理下差异不显著(P>0.05),其他处理下差异显著(P<0.05)。
3 结论与讨论
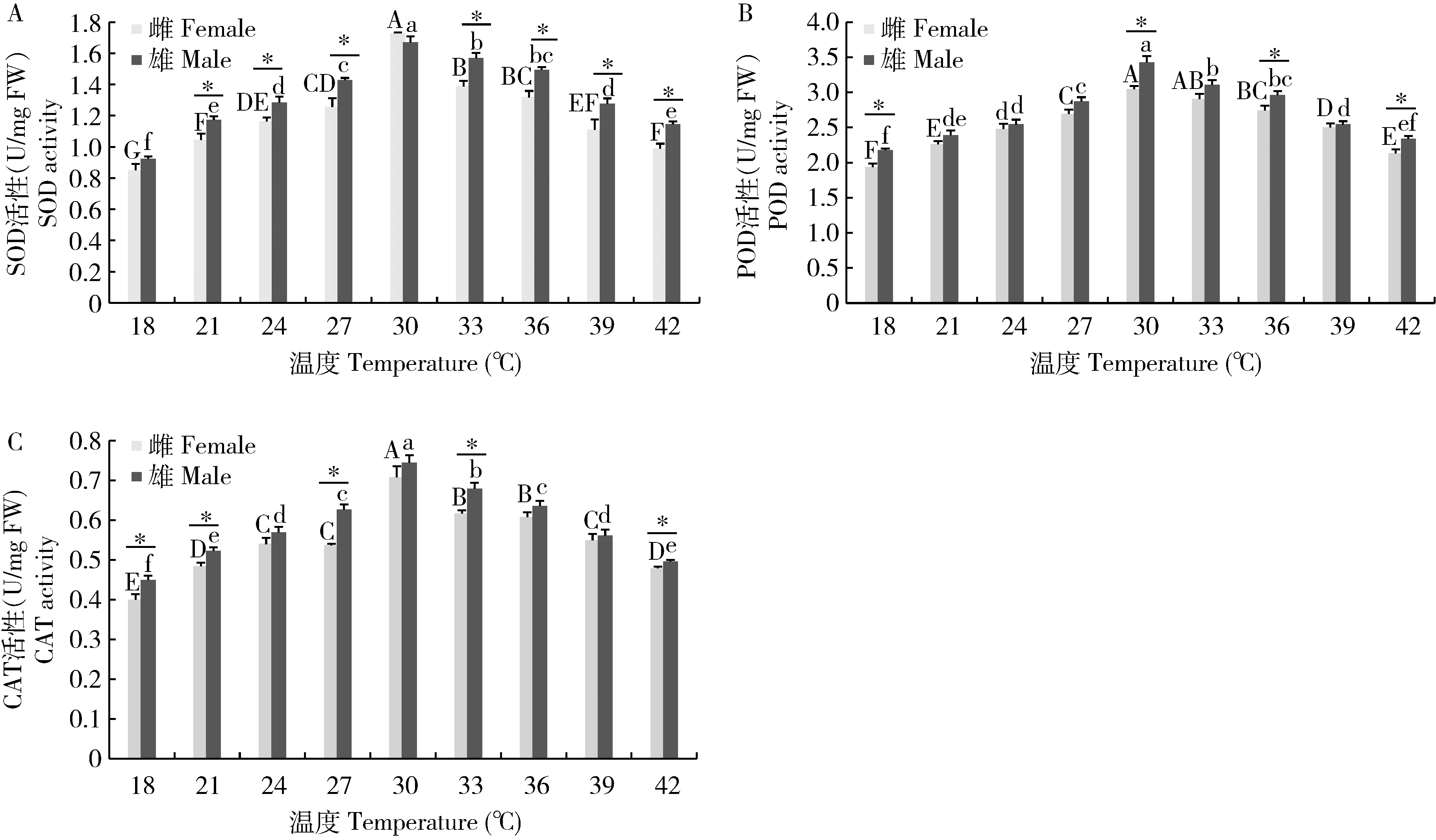
图4 不同温度下亚洲小车蝗成虫体内3种抗氧化酶的活性
昆虫是变温动物的一个类群,自身保持和调节体内温度的能力非常弱(杜尧等, 2007),环境温度是决定昆虫种群数量、个体新陈代谢速率及繁殖速率等极为重要的生态因子,它影响昆虫的整个生命历程, 同时对昆虫的生活习性、地理分布等发挥重要作用(李瑾, 2012)。生物与环境的相互作用包括生物对环境温度的适应过程, 生物体可通过各种方式来适应环境温度的变化,本实验测定分析了在18~42℃下亚洲小车蝗成虫体内4种呼吸代谢相关酶和3种抗氧化酶活性的变化, 研究表明,温度的改变能引起亚洲小车蝗成虫代谢相关酶活性的变化,随着温度升高7种呼吸代谢相关酶和抗氧化酶均呈现先增后减的趋势。糖类代谢相关酶GAPDH和GPDH分别在33和27℃达最大值(图1),脂类代谢酶HOAD活性在33℃时达最大值(图2),抗氧化相关酶SOD, CAT和POD均于30℃时呈现最大值(图4),CS活性在39℃时达最大(图3)。已有研究指出在适宜的温度范围内,随着温度升高,昆虫体内呼吸代谢增强,酶活性增加(李克斌和罗礼智, 1999; 高峰等, 2007; 陈爱端等, 2011; 李娟等, 2014; 王冬梅等, 2014)当温度超过适宜的温度范围,昆虫的生命活动就会减弱。本实验结果与上述结论相符。实验中7种酶在18~42℃范围内的整体变化趋势为先增后减,温度在27~33℃时其体内呼吸代谢相关酶活性不断增加,体内对糖类和脂类物质的利用能力逐渐增强;低温和高温使亚洲小车蝗成虫受到环境胁迫, 能源物质代谢速率减慢,相应呼吸代谢相关酶活性降低,说明亚洲小车蝗对低温和高温的抵抗能力减弱,机体活力较弱,对环境的适应性不强(钱雪等, 2017)。
在18~42℃温度处理下,亚洲小车蝗雄虫体内代谢相关酶活性普遍高于雌虫(图1~4),这表明雄成虫对糖代谢、脂代谢及抗氧化能力都强于雌成虫,同时在能量利用分析结果中雄成虫的GAPHD与HOAD比值整体上高于雌虫(表1),可初步推断雄虫在一般情况下其代谢消耗糖类的量较雌虫大且所消耗糖类的比例较脂类大很多,这可能是雌雄虫体代谢机制存在微差异,这是否与雌虫卵巢发育和抵御温度胁迫间的能量分配有关还需要进一步验证。糖类是昆虫生理活动消耗的主要能源物质,昆虫受到温度及其他环境因子胁迫时,可以通过改变消耗能源物质类型来增强自身对环境的抵抗能力(张洁等, 2013)。钱雪等(2017)研究发现,西伯利亚蝗Comphocerussibiricus雌虫在低温环境下主要消耗糖类,高温环境下可以同时消耗糖类和脂类,说明高温胁迫下,糖类和脂类可以为西伯利亚蝗提供更多的能量。本研究对亚洲小车蝗能量利用分析发现雌雄成虫在18~42℃温度下消耗的能源物质始终为糖类,与上述西伯利亚蝗的能量分配策略不同,这可能由实验处理的时间和其环境因素所致,也不排除其自身的代谢机制在种与种之间的差异性,关于这一点有待进一步研究。
气候变化已成为国内外最受关注的热点问题(孙玉诚等, 2017)。气候格局的改变会导致昆虫地理分布格局及灾变规律的重大改变(Logan and Powell, 2001; Kharoubaetal., 2019)。本研究中亚洲小车蝗呼吸代谢相关酶活性基本在27~33℃范围内达最大值(图1),说明此温度范围中虫体能源物质的代谢速率快,生命活动旺盛;亚洲小车蝗体内3种抗氧化酶活性均在30℃时达最大值(图4),SOD在生物体内的主要作用是清除超氧阴离子自由基并将其转化为过氧化氢,CAT和POD则将过氧化氢分解为H2O和CO2, 3种酶共同作用抵抗生物体氧化过程。抗氧化酶活性的增加是蝗虫受到外界环境刺激时表现出来的一种应激反应,该研究结果表明30℃时虫体内过氧化物水平较高,已经对虫体形成胁迫,随温度继续升高,虫体内增加的有害物质如活性氧等超过虫体内抗氧化酶的代谢范围,将导致虫体生理功能紊乱,酶活性受到抑制而下降,虫体死亡率增加(An and Choi, 2010; Mahmudetal., 2010)。由此推断, 27~30℃是亚洲小车蝗各项生命活动高效运行的最适温度,气候条件的变化在此温度范围下仍有利于亚洲小车蝗的繁殖和扩散,加之亚洲小车蝗具有长距离迁飞习性,借助适宜的环境条件迁飞扩散危害,将加大防治难度。这对亚洲小车蝗的监测预警范围与防治决策都将产生重大影响。
