家蚕BmPGRP-S5蛋白的抑菌活性及其在细胞免疫中的作用
2021-01-12李晓凤钟仰进杨婉莹
陈 雪, 周 虹, 李晓凤, 肖 阳, 钟仰进, 杨婉莹,*
(1. 华南农业大学动物科学学院, 广东省农业动物基因组学与分子育种重点实验室, 广州 510642;2. 广东省农业科学院蚕业与农产品加工研究所, 广州 510610)
肽聚糖识别蛋白(peptidoglycan-recognition proteins, PGRP)是昆虫中非常重要的一类模式识别受体,可以特异性识别细菌细胞壁中的肽聚糖(peptidoglycan, PGN),并通过免疫缺陷(immune deficiency, IMD)途径和Toll途径触发抗菌肽的产生(Hultmark, 2003)。第一个PGRP是从家蚕Bombyxmori血淋巴中纯化出来的(Yoshidaetal., 1996)。后来陆续有多个PGRP家族成员被鉴定,根据5′端非翻译区和转录长度,PGRPs被分为S型PGRP和L型PGRP。S型PGRP具有短的转录本和5′端非翻译区,有信号肽,可以被分泌到细胞外,是一类小分子胞外蛋白;L型PGRP具有长的转录本和5′端非翻译区,部分含有跨膜结构域,属于胞内蛋白或跨膜蛋白(Werneretal., 2000; Dziarski, 2004; Royetetal., 2011)。
果蝇Drosophila基因组中有13条PGRP基因序列,编码17个PGRP蛋白,通过与PGN的识别分别诱导体液免疫和细胞免疫(Dziarski, 2004; Royetetal., 2011)。柞蚕Antheraeapernyi的PGRP-SA可以识别革兰氏阳性菌、革兰氏阴性菌和真菌,并参与激活酚氧化酶原(prophenoloxidase, PPO)级联反应(Zhaoetal., 2018)。红棕象甲Rhynchophorusferrugineus的PGRP-LB可通过降解肠道菌群PGN来充当粘膜免疫的负调节剂,以防止共生细菌过度生长和非共生细菌持久存活(Dawadietal., 2018)。2003年,家蚕全基因组测序完成,通过生物信息学分析发现有12条PGRP基因序列,其中有6条S型,6条L型。6条S型BmPGRP, BmPGRP-L2, BmPGRP-L3和BmPGRP-L5都具有信号肽序列,推测这9个蛋白属于分泌型蛋白。BmPGRP-L1, BmPGRP-L4和BmPGRP-L6没有信号肽,属于跨膜蛋白(Tanakaetal., 2008)。BmPGRP-S1是最早鉴定到的PGRP,参与激活酚氧化酶原级联反应(Yoshidaetal., 1996)。BmPGRP-S2参与激活IMD途径(Yangetal., 2015)。BmPGRP-S3在家蚕幼虫中肠中有高表达,推测其在家蚕对细胞质多角体病毒(BmCPV)感染的免疫反应中发挥作用(Gaoetal., 2014)。BmPGRP-S4可以结合细菌并参与激活PPO途径(Yangetal., 2017)。Zhang等(2019)检测了家蚕5个S型BmPGRP基因的转录表达,发现BmPGRP-S5能快速响应不同微生物的诱导,而且BmPGRP-S5蛋白可以凝集大肠杆菌Escherichiacoli和巨大芽孢杆菌Bacillusmegaterium,推测其在细胞吞噬中发挥作用。Chen等(2016)也发现,BmPGRP-S5蛋白对革兰氏阳性菌和革兰氏阴性菌有抑菌活性,并作为启动PPO途径的模式识别受体,也可通过酰胺酶依赖性机制控制抗菌肽的产生。
基于家蚕BmPGRP-S5蛋白在先天免疫中的作用,以及其良好的抑菌活性,本研究构建家蚕BmPGRP-S5重组表达载体并转染至果蝇S2细胞,收集分泌表达的蛋白进行纯化。通过BmPGRP-S5体外抑菌实验,与不同细菌胞壁组分的结合实验,对黑化反应和血细胞吞噬作用的影响,探究BmPGRP-S5蛋白在体外抑菌及家蚕先天免疫中的作用,研究结果将为阐明家蚕细胞免疫发生机制及BmPGRP-S5蛋白的开发利用提供参考。
1 材料与方法
1.1 家蚕、菌种、载体与试剂
供试家蚕大造(Dazao)由广东省农业科学院蚕业与农产品加工研究所提供,幼虫期在26℃±2℃,相对湿度60%±5%,12 h日夜交替的环境下用新鲜桑叶饲养。果蝇胚胎S2细胞、大肠杆菌E.coliK12D31、金黄色葡萄球菌Staphylococcusaureus、巨大芽孢杆菌B.megaterium和重组表达载体pIEx-4-BmPGRP-S5由本实验室保存。
主要试剂:Effectene Transfection Reagent(QiaGen, 德国);大肠杆菌细胞壁组分PGN-EC和LPS-EC、金黄色葡萄球菌胞壁组分PGN-SA和LTA-SA、枯草芽孢杆菌Bacillussubtilis胞壁组分PGN-BS和LTA-BS(InvivoGen, 美国);SFX昆虫培养基、FITC荧光标记试剂盒(Sigma-Aldrich,美国);对硝基苯基磷酸(Thermo Scientific, 美国);SDS、多巴胺、BSA、二乙醇胺(翔博, 广州);BCA法蛋白定量试剂盒、Anti-His多克隆抗体、Anti-Mouse HRP抗体、RIPA(碧云天, 上海);重组烟草天蛾角质层蛋白(cuticle protein 36, CP36)由本实验室保存。
1.2 生物信息学分析
通过NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)搜索家蚕的PGRP氨基酸序列、T7溶菌酶结构域与其他物种的PGRP氨基酸序列。将BmPGRP-S5氨基酸序列及T7溶菌酶结构域输入同源建模网站SWISS-MODEL(https:∥swissmodel.expasy.org/interactive)进行建模,模拟输出BmPGRP-S5蛋白和T7溶菌酶的三维结构。再通过DNAMAN软件将家蚕的PGRP氨基酸序列、T7溶菌酶结构域与其他物种的PGRP氨基酸序列进行序列比对。
1.3 BmPGRP-S5蛋白的表达和纯化
将重组表达载体pIEx-4-BmPGRP-S5和pCoBlast质粒共转染S2细胞,用BT抗生素筛选,获得稳定表达BmPGRP-S5蛋白的S2细胞。由于表达环境更接近昆虫体内的实际生理环境,BmPGRP-S5自带信号肽可以将重组表达蛋白引导分泌到S2细胞培养液里。大量培养S2细胞后收集培养液,通过Ni-NTA亲和层析纯化BmPGRP-S5蛋白,分别用Balance Buffer, Elution Buffer A, Elution Buffer B, Elution Buffer C和Collection Buffer A进行洗脱,获得重组表达的BmPGRP-S5蛋白,并利用脱盐柱进行脱盐。通过SDS-PAGE和Western blot(一抗为鼠来源的Anti-His多克隆抗体,二抗为Anti-Mouse HRP抗体)检测外源蛋白表达及纯化效果。
1.4 细菌生长曲线法检测BmPGRP-S5重组蛋白的抑菌活性
在LB固体培养基上划线培养大肠杆菌K12D31、金黄色葡萄球菌和巨大芽孢杆菌,挑取单菌落于LB液体培养基中,37℃培养至OD600=0.6~0.8。由于BmPGRP-S5蛋白具有保守的依赖于Zn2+的酰胺酶活性结构域,本实验拟加入Zn2+激活其酰胺酶活性。为排除Zn2+本身对测试菌的影响,我们分别用20, 40和60 μmol/L的Zn2+处理测试菌,获得不影响细菌生长的Zn2+浓度。在最低浓度Zn2+工作液中分别加入BmPGRP-S5蛋白(Zn2+组和非Zn2+组),使其终浓度为0.3 mg/mL。将混合液置于37℃摇床上培养,每隔1 h测1次A590吸光值,连续检测6 h。同时用PBS缓冲液和抗生素卡那霉素(Kanamycin, Kana)分别作为阴性和阳性对照,其中卡那霉素的工作浓度为50 μg/mL。
1.5 ELISA检测BmPGRP-S5蛋白与不同细菌胞壁组分的结合
金黄色葡萄球菌是革兰氏阳性菌的代表,在细菌性病原微生物中占主要地位(葛志毅等, 2020)。其细胞壁含90%的PGN和10%的磷壁酸(lipoteichoic acid, LTA),LTA是细菌重要的表面抗原,能黏附于宿主细胞表面;大肠杆菌属革兰氏阴性菌,是人和动物肠道中的常居菌,常被用于昆虫免疫研究(Chenetal., 2014; Zhangetal., 2018, 2019),其细胞壁主要由PGN组成,外面包裹一层脂多糖(lipopolysaccharide, LPS),能引起哺乳动物强烈的炎症反应,又被称为内毒素;巨大芽孢杆菌属于革兰氏阳性菌,其细胞壁主要组分为PGN和LTA。PGRP最主要的功能是作为模式识别受体,为进一步研究BmPGRP-S5蛋白对病原菌的识别功能,选取高纯度的金黄色葡萄球菌的胞壁组分PGN-SA和LTA-SA、大肠杆菌胞壁组分PGN-EC和LPS-EC以及枯草芽孢杆菌的胞壁组分PGN-BS和LTA-BS分别稀释至40 μg/mL,并分别加到96孔板中,置于室温至液体蒸发。底物风干后用BSA蛋白进行封闭,分别加入目的蛋白BmPGRP-S5和对照蛋白CP36,浓度均为20 ng/μL,每孔加50 μL,同时加入带有His标签的鼠抗一抗和山羊抗鼠二抗孵育。最后加入显色剂对硝基苯基磷酸酯,测定A405吸光值。用BmPGRP-S5蛋白组的吸光值减去对照蛋白CP36的吸光值后,用Graphpad Prism 5.0软件进行统计分析。
1.6 BmPGRP-S5蛋白激活酚氧化酶原的检测
用解剖针扎5龄第3天家蚕幼虫倒数第2对尾足,收集血淋巴,高速离心去除血细胞,将获得的血浆混匀置于冰上。设4组实验,第1组加入30 μL PBS,第2组加入26 μL PBS和4 μL BmPGRP-S5蛋白(0.1 mg/mL),第3组加入22 μL PBS和浓度为40 μg/mL 的不同细菌胞壁组分PGN-EC, LPS-EC, PGN-SA, LTA-SA, PGN-BS和LTA-BS各8 μL,第4组加入18 μL PBS, 4 μL BmPGRP-S5蛋白(0.1 mg/mL)和浓度为40 μg/mL 的不同细菌胞壁组分PGN-EC, LPS-EC, PGN-SA, LTA-SA, PGN-BS和LTA-BS各8 μL。然后分别加入10 μL的血浆混匀,室温静置5 min后离心取5 μL上清于96孔板中,每孔加入多巴胺(2 mmol/L多巴胺溶于50 mmol/L Na3PO4,pH6.5)。再用酶标仪测定吸光度A490值,1 min测1次,连续记录30 min, PPO活力以每分钟A490的变化值表示。
1.7 BmPGRP-S5蛋白促血淋巴黑化反应的检测
为检测BmPGRP-S5蛋白对家蚕血浆黑化反应的影响,将细菌胞壁组分PGN-SA, LTA-SA, PGN-EC, LPS-EC, PGN-BS和LTA-BS 作为激活组分,分别与BmPGRP-S5蛋白组合,加入到新鲜的家蚕血淋巴中,激活黑化反应。先在离心管中分别加入50 μL浓度为40 μg/mL 的细菌胞壁组分PGN-EC, LPS-EC, PGN-SA, LTA-SA, PGN-BS和LTA-BS;共有两组,实验组加入5 μL BmPGRP-S5蛋白(0.3 mg/mL),对照组加入5 μL PBS缓冲液。用解剖针扎家蚕5龄第3天幼虫倒数第2对尾足,收集血淋巴,分别200 μL加入到上述混合液中。轻轻混匀,用相机记录下20 min内黑化反应的变化,利用ImageJ软件对拍下的照片做灰度扫描分析。
1.8 共聚焦显微镜观察BmPGRP-S5蛋白对血细胞吞噬细菌的影响
用异硫氰酸荧光素(fluorescein isothiocyanate isomer, FITC)标记大肠杆菌K12D31、金黄色葡萄球菌和巨大芽孢杆菌,方法参考Pearson等(2003)的标记方法,将细菌摇至OD600=0.6~0.8,离心收集细菌并用PBS进行悬浮,加入用二甲基亚枫溶解的FITC 溶液(10 g/L),使FITC在菌液中的终浓度为5 mg/L,置37℃摇床中反应1.5 h。收集细菌并用PBS洗涤2次,用1%多聚甲醛固定30 min,PBS洗涤2次,配成浓度为1×109细菌/mL的悬液,避光保存于4℃备用。
取家蚕血细胞加入到SFX培养基中,轻轻摇匀,放置于28℃培养箱30 min,使血细胞贴壁形成单层细胞。分别加入200 μL用FITC染料标记的大肠杆菌K12D31、金黄色葡萄球菌和巨大芽孢杆菌(OD600=0.6~0.8)和100 μL BmPGRP-S5蛋白(0.3 mg/mL)。空白对照和阴性对照分别选择100 μL PBS和细胞松弛素D(cytochalasin D, CytD)。接着在28℃避光培养3 h。洗净培养基,用0.05%的Trypan Blue猝灭未被血细胞吞噬的细菌细胞所带荧光,洗净多余的Trypan Blue。用4%多聚甲醛固定30~60 min,洗净多余的多聚甲醛,封片。在共聚焦显微镜(FV10-ASW, Olympus, 日本)的100×油镜下进行观察,分别统计5个视野区域600个血细胞中被吞噬的细菌的数量,吞噬率指被吞噬细菌的占比(Qietal., 2016)。
1.9 数据分析
实验数据以3次重复的平均值±标准误表示,用Graphpad Prism 5.0软件进行作图,两组间的差异显著性采用t检验进行检验。
2 结果
2.1 BmPGRP-S5蛋白的序列分析
对BmPGRP-S5蛋白进行结构分析发现,BmPGRP-S5蛋白的PGRP结构域与T7溶菌酶的酰胺酶结构域具有相似性(图1),暗示BmPGRP-S5蛋白具有溶菌酶的活性。由于T7溶菌酶酰胺酶活性由依赖于Zn2+的His(H), Tyr(Y), His(H), Thr(T)和Cys(C)决定(Yangetal., 2017; Wangetal., 2020),因此进一步对BmPGRP-S5蛋白、T7溶菌酶和其他物种的PGRP进行氨基酸比对,结果如图2所示,BmPGRP-S5蛋白在这几个酰胺酶活性的关键位点上完全保守,推测BmPGRP-S5蛋白可能也有依赖Zn2+的酰胺酶活性。

图1 家蚕BmPGRP-S5蛋白与T7溶菌酶的结构域对比

图2 家蚕BmPGRP-S5蛋白与T7溶菌酶和其他昆虫PGRP蛋白的序列比对
2.2 BmPGRP-S5蛋白的表达与纯化
将BmPGRP-S5基因重组到pIEx-4载体上,转染果蝇S2细胞。通过SDS-PAGE和Western blotting检测发现BmPGRP-S5蛋白表达后可以被自身信号肽引导分泌到细胞培养液里(图3: A, B)。收集培养液,通过Ni-NTA亲和层析柱进行蛋白纯化,洗脱液Collection Buffer A可把目的蛋白BmPGRP-S5蛋白高效单一地纯化出来(图3: A, B)。
2.3 BmPGRP-S5蛋白的抑菌活性
溶菌酶的酰胺酶活性依赖于Zn2+,我们先在缓冲液里添加Zn2+,发现金黄色葡萄球菌对Zn2+非常敏感,浓度为20 μmol/L的Zn2+就能抑制细菌生长(图4: A),故对金黄色葡萄球菌进行的后续抑菌实验中不添加Zn2+。终浓度为20和40 μmol/L的Zn2+分别对大肠杆菌K12D31(图4: B)和巨大芽孢杆菌(图4: C)的生长活力无影响,因此后续实验中分别添加20和40 μmol/L的Zn2+进行抑菌实验。BmPGRP-S5蛋白的抑菌效果如图4(B)所示,没有添加Zn2+的BmPGRP-S5蛋白对测试菌金黄色葡萄球菌(图4: D)、大肠杆菌K12D31(图4: E)和巨大芽孢杆菌(图4: F)的生长均无影响。在加入40 μmol/L的Zn2+后,BmPGRP-S5蛋白对巨大芽孢杆菌的抑菌效果有明显增强(P<0.05);但是加入20 μmol/L的Zn2+后BmPGRP-S5蛋白并不能抑制大肠杆菌K12D31的生长, 说明BmPGRP-S5蛋白的抑菌效果微弱,在添加Zn2+的情况下仅对巨大芽孢杆菌有抑菌效果,同时也暗示这种抑菌作用依赖于Zn2+,是通过含有锌指结构域的酰胺酶活性功能域发挥作用。
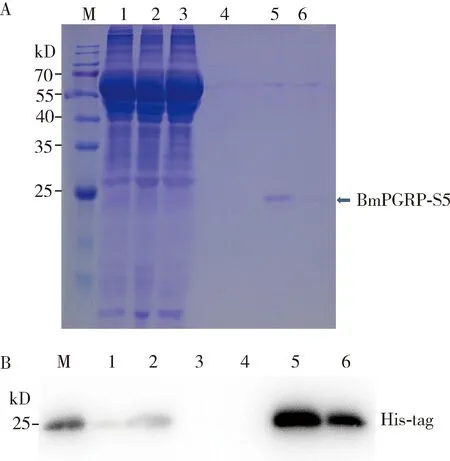
图3 家蚕BmPGRP-S5蛋白的表达及纯化的SDS-PAGE (A)和Western blot (B)检测

图4 家蚕BmPGRP-S5蛋白对细菌生长曲线的影响
2.4 BmPGRP-S5蛋白与不同细菌胞壁组分的结合
我们通过ELISA实验检测了BmPGRP-S5蛋白与细菌胞壁组分的结合能力,实验结果如图5所示。BmPGRP-S5蛋白与金黄色葡萄球菌的胞壁组分PGN和枯草芽孢杆菌胞壁组分LTA的结合力较强。而BmPGRP-S5蛋白与金黄色葡萄球菌的LTA-SA、大肠杆菌的PGN-EC和LPS-EC及枯草芽孢杆菌的PGN-BS结合能力微弱。

图5 家蚕BmPGRP-S5蛋白与细菌胞壁组分的结合力
2.5 BmPGRP-S5蛋白参与酚氧化酶原反应
酚氧化酶原介导的黑化是一种重要的昆虫免疫反应,为研究BmPGRP-S5蛋白是否参与黑化反应,我们检测了BmPGRP-S5蛋白对不同细菌胞壁组分促进酚氧化酶原反应中的作用(图6)。结果显示体外表达的BmPGRP-S5蛋白以及各细菌胞壁组分PGN, LTA和LPS都可以激活酚氧化酶原级联系统。而BmPGRP-S5蛋白可以促进金黄色葡萄球菌的PGN-SA和枯草芽孢杆菌的LTA-BS激活酚氧化酶原系统的能力。这与ELISA检测到BmPGRP-S5蛋白与金黄色葡萄球菌的PGN-SA和枯草芽孢杆菌的LTA-BS结合能力强的结果(图5)相一致。但是结果也显示加入BmPGRP-S5蛋白会抑制LTA-SA, LPS-EC和PGN-BS的促酚氧化酶原能力。
2.6 BmPGRP-S5蛋白在细菌胞壁组分激活下对黑化反应的影响
为检测BmPGRP-S5蛋白对家蚕血浆黑化反应的影响,将3种细菌胞壁组分分别与BmPGRP-S5蛋白组合,加入到新鲜的家蚕血淋巴中,激活的黑化反应如图7(A)所示。金黄色葡萄球菌的PGN-SA和LTA-SA本身就可以明显激发黑化反应,在20 min内,BmPGRP-S5对PGN-SA处理组有促进作用,但对LTA-SA处理组呈现抑制作用;来自大肠杆菌的PGN-EC和LPS-EC对黑化反应的激发作用微弱,BmPGRP-S5蛋白在后期对PGN-EC处理组有促进作用,对LPS-EC处理组有抑制作用;枯草芽孢杆菌的PGN-BS和LTA-BS本身对黑化的激活效果不明显,但在LTA-BS组加入BmPGRP-S5蛋白后5 min出现黑化反应,10 min后明显增强。图7(B)是对图7(A)的灰度扫描,从统计数据可以看出,当BmPGRP-S5蛋白与枯草芽孢杆菌的LTA-BS同时存在时,可以加快LTA-BS对酚氧化酶原的激活速度,且黑化程度也更强;而BmPGRP-S5蛋白对金黄色葡萄球菌和大肠杆菌促进黑化反应的功能不显著。

图6 BmPGRP-S5蛋白对不同细菌胞壁组分激活家蚕第3天幼虫血淋巴中酚氧化酶原(PPO)的影响

图7 BmPGRP-S5蛋白对家蚕5龄第3天幼虫血淋巴黑化反应的影响(A)及灰度扫描分析(B)
2.7 BmPGRP-S5蛋白对家蚕血细胞吞噬细菌作用的影响
共聚焦显微镜观察发现,细胞松弛素D(Cyt D)处理血细胞后会影响细胞骨架的动力,降低细胞能动性和吞噬能力。PBS缓冲液组的血细胞有一定的吞噬能力,但在加入BmPGRP-S5蛋白后能明显促进血细胞对大肠杆菌K12D31、金黄色葡萄球菌和巨大芽孢杆菌的吞噬能力(图8: A)。在显微镜下选择不同的视野进行计数,并计算细胞吞噬效率。用CytD处理后,血细胞对3种供试菌的吞噬率都在10%左右,PBS缓冲液中血细胞的吞噬率在30%以下,互相之间没有明显差异。加入BmPGRP-S5蛋白后,血细胞对金黄色葡萄球菌的吞噬率提高到53.33%左右,对大肠杆菌K12D31的吞噬率在25.83%左右,对巨大芽孢杆菌的吞噬率达30.83%左右。与对照组相比,BmPGRP-S5蛋白对血细胞吞噬金黄色葡萄球菌有明显的促进作用;对吞噬大肠杆菌K12D31和巨大芽孢杆菌也有促进作用(图8: B)。

图8 BmPGRP-S5蛋白对家蚕血细胞吞噬细菌的能力(A)及吞噬率(B)的影响
3 讨论
PGRP作为细菌胞壁组分肽聚糖的模式识别受体,生物信息学分析发现PGRP具有典型的依赖Zn2+的酰胺酶活性域,第61位的His(H)、第91位的Tyr(Y)、第171位的His(H)、第177位的Thr(T)和第179位的Cys(C)是酶促活性的关键位点(Yangetal., 2017; Wangetal., 2020)。Chen等(2014)研究发现,BmPGRP-S5蛋白对革兰氏阳性菌藤黄微球菌Micrococcusluteus、金黄色葡萄球菌和革兰氏阴性菌粘质沙雷氏菌Serratiamarcescens、大肠杆菌JM109都有抑菌活性,但Zn2+并没有增加BmPGRP-S5的酰胺酶活性。对BmPGRP-S4的实验也表明,额外向缓冲液里添加Zn2+并不能提升其抗菌活性(Yangetal., 2017),似乎说明PGRP的抑菌活性不取决于酰胺酶活性结构域。而在本研究的检测中,BmPGRP-S5蛋白本身对3种供试菌均没有抑菌活性,只有加入40 μmol/L的Zn2+后对巨大芽孢杆菌有抑菌活性,暗示BmPGRP-S5蛋白对细菌的抑菌作用与酰胺酶活性有关(图4)。与前者结果不同的原因猜测可能是原核系统表达的PGRP蛋白溶剂中已有足够的Zn2+,额外添加Zn2+无法发挥作用(Yangetal., 2017)。虽然BmPGRP-S5蛋白对巨大芽孢杆菌有抑菌作用,但抑菌活性不强,也不广谱,直接作为抑菌剂的开发意义不大。
过去的研究认为PGRP最主要的功能是对PGN的识别,近年来有新进展。Li等(2013)发现草鱼Ctenopharyngodonidellus中的PGRP5在CIK细胞中的表达可以被PGN和LTA所诱导。来自单峰骆驼Camelusdromedarius的CPGRP-S可以与LPS及LTA结合,从而抑制LPS和LTA诱导的细胞炎症因子TNF-和IL-6的表达,并且CPGRP-S可以显著降低LPS和LTA诱导的死亡率(Sharmaetal., 2011)。Sharma等(2013)进行的生物信息学分析发现,CPGRP-S能分别与LPS, PGN和LTA在C-D接触位点相结合。除CPGRP-S外,骆驼科的肽聚糖识别蛋白-1(peptidoglycan recognition protein-1, PGLYRP-1)可以在体外与LPS和LTA紧密结合,从而抑制LPS和LTA诱导细胞炎性因子TNF-α和IL-6表达(Zhangetal., 2012)。因此,Dziarski和Gupta(2018)提出,哺乳动物PGRP的其他结合位点位于肽聚糖结合沟之外,能与LPS和LTA等具特异结合性。我们的研究发现,BmPGRP-S5蛋白除了与金黄色葡萄球菌胞壁组分PGN结合外,还可以与来自枯草芽孢杆菌的胞壁胞壁组分LTA结合(图5)。结果表明不止鱼类和哺乳动物中的PGRP可以通过识别LPS和LTA来参与天然免疫,昆虫中的PGRP也可以识别LTA。
黑化反应和细胞吞噬是昆虫最主要的快速免疫方式。果蝇细胞免疫包括黑化、细胞吞噬、凝集和结节等能在30 min内清除99.5%的细菌,Toll和IMD介导的体液免疫只负责清除细胞免疫后剩余的微量细菌(Haineetal., 2008)。我们取家蚕血淋巴和血细胞分别进行黑化反应和细胞吞噬实验,当体系中加入BmPGRP-S5蛋白时,可以加快对酚氧化酶原的激活速度,提高血细胞的吞噬效率。本实验与Chen等(2014)的研究结果有不同,其在与细菌细胞壁组分的结合实验中,BmPGRP-S5蛋白与来自大肠杆菌和枯草芽孢杆菌的PGN结合力较强,与来自金黄色葡萄球菌的PGN结合力较弱;在检测酚氧化酶原活力的实验中,家蚕中的BmPGRP-S5蛋白与来自大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的PGN结合均可以激活酚氧化酶原系统。但在本研究的结合实验中,BmPGRP-S5蛋白与来自金黄色葡萄球菌的Lys型PGN结合力较强,与来自大肠杆菌的DAP型PGN和枯草芽孢杆菌的PGN-BS结合能力非常弱;在检测酚氧化酶原活力的实验中,BmPGRP-S5蛋白可以促进金黄色葡萄球菌的PGN-SA激活酚氧化酶原系统,但无法促进来自于大肠杆菌和巨大芽孢杆菌的PGN来激活酚氧化酶原系统(图6)。出现不同结果的可能原因是Chen等(2014)实验中的BmPGRP-S5是用大肠杆菌原核表达纯化出来,经过了变性、复性等过程,我们的BmPGRP-S5蛋白是在果蝇S2细胞真核表达,可以利用自身信号肽分泌到细胞外,蛋白活性不受影响,更趋近昆虫体内的生理生化环境。本研究发现,BmPGRP-S5蛋白抑制了LTA-SA和LPS-EC引起的家蚕血淋巴黑化反应(图7),BmPGRP-S5与这2个细菌胞壁组分结合后会抑制PPO的活性(图6),暗示BmPGRP-S5蛋白可能对某些细菌胞壁组分引发的免疫通路有负控制作用,其具体机理尚不清楚,有待进一步研究。
本研究的BmPGRP-S5蛋白是在果蝇S2细胞中重组表达的,它可以利用自身信号肽分泌到细胞外,蛋白活性不受影响,更能真实地反映BmPGRP-S5蛋白的功能特性。而且本研究更注重研究BmPGRP-S5 蛋白与不同细菌胞壁组分结合后对细胞免疫的影响。本研究的结果表明,BmPGRP-S5蛋白可以通过识别革兰氏阳性菌的PGN和LTA激活血淋巴黑化反应,并促进家蚕血细胞吞噬外源微生物。接下来,我们会进一步通过Pull-down来寻找与BmPGRP-S5互作的蛋白,研究促进黑化和细胞吞噬的下游因子。本研究结果将有助于阐明家蚕血细胞对外源微生物吞噬的识别机制,也为进一步研究昆虫细胞免疫奠定基础。
