中华蜜蜂NPC1蛋白AcNPC1的原核表达、多克隆抗体制备及功能鉴定
2021-01-12刘永梅史红霞马振刚王林玲许金山周泽扬党晓群
刘永梅, 史红霞, 李 颜, 马振刚, 王林玲, 许金山, 周泽扬, 党晓群
(重庆师范大学, 重庆市动物生物学重点实验室, 重庆市媒介昆虫重点实验室, 重庆 401331)
NPC1蛋白是一类广泛存在于脊椎动物和无脊椎动物体内的参与胆固醇运输的保守蛋白。人类C型尼曼匹克病(Niemann-Pick disease type C, NPC)是一种罕见的常染色体隐性遗传疾病(占克斌等, 2007),其中约有95%的NPC患者是由NPC1突变引起胆固醇代谢障碍所致(Carsteaetal., 1997)。NPC1基因位于人类18号染色体上,是一个由1 278个氨基酸组成13次跨膜蛋白,属于疏水性膜蛋白(Ericksonetal., 2008),NPC1蛋白在核内体内腔形成3个腔内结构域:分别为A结构域(NPC1-A)、C结构域(NPC1-C)和I结构域(NPC1-I)(Scott and Ioannou, 2004);NPC1-C是三者中最大的结构域,该区域主要功能是与NPC2发生相互作用(Lietal., 2016),共同调控胆固醇的外流,将胆固醇运输出核内体和溶酶体,以便维持细胞内的酯类动态稳定,同时该区域也能够在蛋白酶作用下与埃博拉病毒的GP蛋白进行互作(Zhaoetal., 2016),介导病毒感染宿主细胞,由于不同物种间NPC1-C的序列差异性(如第503位的苯丙氨酸)影响了埃博拉病毒对不同种细胞的侵染能力(Neufeldetal., 1999)。
有研究表明果蝇Drosophia基因组编码两个NPC1同系物,分别命名为NPC1a和NPC1b,与人类NPC1蛋白的同源性分别为42%和35%(Fluegeletal., 2006)。研究人员利用果蝇NPC1a突变体分析,发现NPC1a突变体无法合成蜕化类固醇,突变体1龄幼虫期延长且无法蜕皮进入2龄幼虫,甚至死亡,NPC1a突变体幼虫死亡,暗示了NPC1a是生物合成蜕皮类固醇所必需的蛋白(Huangetal., 2005);在家蚕Bombyxmori中,NPC1基因被干涉后,发现部分家蚕蜕皮推迟,推测该基因与家蚕蜕皮过程相关(晁会娟, 2017)。同时也有研究者利用果蝇NPC1b的突变体,发现该果蝇幼虫无法吸收胆固醇,从而引起1龄幼虫死亡(Voghtetal., 2007)。
此外,NPC1蛋白是大多数囊膜病毒侵染细胞的重要受体(Krishnanetal., 2012),Carette等(2011)研究表明,NPC1是埃博拉病毒侵染时的受体蛋白,通过突变NPC1细胞能有效抑制埃博拉病毒的侵染,而当细胞表达野生型NPC1后其又能恢复对病毒的易感性,说明该病毒的侵染是依赖NPC1蛋白的存在;NPC1抑制剂丙咪嗪能够强烈抑制丙肝病毒(Hepatitis C virus, HCV)(Sainzetal., 2012)、登革热病毒(dengue virus)(Jupatanakuletal., 2014)的增殖,暗示这些病毒的侵染可能与NPC1存在一定的相关性。
由此,NPC1是在生命体中承担着胆固醇运输的角色,同时起着多种囊膜病毒侵染的宿主桥梁。因此调查中华蜜蜂NPC1的表达以及其与CSBV病毒感染之间的关系,不仅为进一步深入了解NPC1蛋白在蜜蜂的生长发育中的重要功能奠定基础,也为揭示CSBV病毒入侵过程提供新思路,为开发中囊病有效防控新靶标提供理论支撑。
1 材料与方法
1.1 供试昆虫与病毒
健康的中华蜜蜂由重庆师范大学资源与媒介昆虫重点实验室提供;CSBV病毒分离于重庆酉阳某养蜂场。
1.2 菌株、质粒载体和试剂
实验所用的大肠杆菌Escherichiacoli菌株DH5α和表达菌株RosettaTM(DE3)均购于成都天泰生物技术有限公司;扩增目的基因的引物由重庆生工生物有限公司合成;制备多克隆抗体所使用的昆明雌性小鼠购于重庆腾鑫生物技术有限公司;Premix Taq DNA聚合酶、pMD19-T Vector、BamHⅠ内切酶、XbaⅠ内切酶、2000 bp DNA Marker、5000 bp DNA Marker、Solution Ⅰ连接酶、PrintScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒购于TaKaRa公司;Trizol Reagent、双色预染蛋白Marker、胶回收试剂盒、质粒抽提试剂盒、弗氏完全佐剂、弗氏不完全佐剂、FITC标记的羊抗鼠二抗、HRP标记的羊抗鼠二抗购于重庆奥哲生物有限公司;IPTG、X-Gal、Ampicillin、琼脂糖、异丙醇、Tris饱和酚、酵母提取物、蛋白胨、琼脂粉购于重庆生工生物有限公司,PVDF膜购于Promega公司,ECL显色液购于Bio-Rad公司。
1.3 AcNPC1基因序列的生物信息学分析
AcNPC1基因序列和蛋白质序列下载于NCBI(http:∥www.ncbi.nlm.nih.gov/);然后分别用SMART(http:∥smart.embl-heidelberg.de/smart/)、SignalP 4.1 (http:∥www.cbs.dtu.dk/services/SignalP/)、NetPhos 3.1 (http:∥www.cbs.dtu.dk/services/NetPhos/)、NetNGlyc 1.0 (http:∥www.cbs.dtu.dk/services/NetNGlyc/)和SWISS-MODEL(https:∥swissmodel.expasy.org/)对AcNPC1的蛋白质序列特征进行预测。同时,通过NCBI的Blast比对后,下载与AcNPC1序列相似性高的序列,选用MEGA 5.0中邻接法进行系统发育树的构建,并将bootstrap值设为1 000。
1.4 AcNPC1基因克隆及原核表达载体构建
使用BioXM、primer5.0软件设计中华蜜蜂AcNPC1(GenBank登录号: XP_016906844.1)的引物(表1)。添加XbaⅠ和BamHⅠ酶切位点。采用 Trizol法提取中华蜜蜂总RNA,参照Roche EvoScript Universal cDNA Master试剂盒操作说明进行反转录,测定浓度后放置于-20℃保存备用。以中华蜜蜂cDNA为模板扩增AcNPC1基因,反应体系: 正反向引物(0.5 μmol/L)各1 μL, cDNA模板1 μL, Premix rTaq 12 μL, ddH2O 10 μL。PCR扩增程序:95℃预变性5 min; 95℃变性40 s, 55℃退火1 min, 72℃ 1 min, 35个循环; 72℃延伸10 min。通过琼脂糖凝胶电泳分离并回收目的片段,酶切后与pMD19-T载体连接,转化至大肠杆菌DH5α感受态细胞,菌液均匀涂布于含有0.1 mol/L氨苄青霉素的LB固体培养基平板,随机挑取单菌落经菌液PCR和双酶切检测后,送公司进行核苷酸测序。对测序正确的阳性克隆菌提取质粒,通过XbaⅠ和BamHⅠ酶切位点亚克隆至pET-30a表达载体,进行PCR和双酶切鉴定。
(2) Logistic回归以液化概率50%作为液化和非液化区分时模型的预测准确率为87.7%,这与其他的研究结果相近;虽然准确率为非连续变量,但该结果可作为砂土地震液化确定性分析的一个参考。
1.5 AcNPC1蛋白的原核表达和纯化
将获得阳性重组表达质粒pET-30a-AcNPC1和pET-30a空载质粒分别转入大肠杆菌RosettaTM(DE3)培养。 以220 r/min、37℃振荡培养至OD600=0.6,两种菌液各取1支作为对照(37℃未诱导组),余下4支试管中各加入终浓度为0.1 mmol/L IPTG在37℃诱导培养7~8 h;分别收集试管中未诱导以及诱导的菌液,经低温超声波破碎仪破碎菌体后,沉淀用含8 mol/L尿素的Binding Buffer缓冲液裂解,经14 000 r/min离心10 min取上清进行SDS-PAGE电泳检测。
用已灭菌处理的ddH2O清洗His镍柱,并用Binding Buffer缓冲液平衡His镍柱;将上述已过膜的上清蛋白溶液加至His镍柱中循环上样15~20 min;上样完成后用Binding Buffer缓冲液冲洗柱子,再用Elution Buffer缓冲液进行洗脱,离心管收集洗脱液,每管约收集0.5 mL,每次接6个离心管;用ddH2O清洗柱子后,再使用Binding Buffer平衡镍柱,重复以上步骤收集目的蛋白。最后通过SDS-PAGE电泳检测纯化的重组蛋白。
1.6 AcNPC1多克隆抗体的制备及检测
将1.5节纯化好的AcNPC1原核表达蛋白作为抗原,与等体积的弗氏完全佐剂混匀,皮下注射小鼠,第一次进行免疫时,蛋白量为0.1 mg蛋白/小鼠,之后每隔一周进行一次免疫,将重组蛋白与等体积的弗氏完全佐剂混匀,皮下注射小鼠,蛋白与第一次的免疫量一致;最后一次免疫完成后的第4天,对小鼠进行眼球采血,将采集到的血液于37℃恒温箱中静置1 h后,转至4℃冰箱中放置过夜,直至血清析出,在无菌超净台中将血清转移至新的离心管中,小量分装做好标记后,于-20℃保存待用。将多克隆抗体按1∶200(v/v)稀释比稀释后作为一抗,与1.5节纯化、透析后获得的AcNPC1进行免疫印迹检测所制备抗体的特异性。为了进一步了解AcNPC1在中华蜜蜂中表达情况,首先采用玻璃珠破碎法获取中华蜜蜂总蛋白作为抗原,并以AcNPC1鼠抗多抗作为一抗(稀释比为1∶2 000, v/v),HRP标记的羊抗兔(稀释比为1∶5 000, v/v)作为二抗进行蛋白免疫印迹分析。
1.7 AcNPC1的RNAi
为了进一步研究AcNPC1是否参与了CSBV侵染过程,利用在线siRNA预测网站(http:∥rnaidesigner.lifetechnologies.com)对AcNPC1的siRNA位点进行预测,设计3个干涉片段(siRNA1, siRNA2和siRNA3)(表1),其中,siRNA1和siRNA2靶向AcNPC1基因的胞内环2区域(1 712-1 737 bp和1 532-1 557 bp),siRNA3靶向AcNPC1基因的5′UTR区(66-91 bp),送至上海生物工程有限公司合成。RNAi阴性对照使用实验室利用L4440载体表达并纯化的dsGFP(502 bp)(史红霞等, 2019)。中华蜜蜂幼虫的饲养参见文献(王倩, 2008; 史红霞等, 2019)。siRNA的添食实验设置A和B组,其中A组包括正常幼虫、正常幼虫+siRNA1、正常幼虫+siRNA2、正常幼虫+siRNA3处理组;B组包括感染CSBV幼虫、感染CSBV幼虫+siRNA1、感染CSBV幼虫+siRNA2、感染CSBV幼虫+siRNA3处理组;每个处理组设计3个生物学重复(添加siRNA和dsGFP量均为2.2 μg/幼虫)。从巢脾中挑取大小适中的2日龄中华蜜蜂幼虫>200头,在人工培养箱黑暗培养12 h死亡和体色不正常的幼虫移除,确保每组幼虫数量至少20头,A组添加20 μL/头食物,B组添加20 μL/头食物(含有CSBV液,2.1×109copies/μL),12 h后,分别添加siRNA,同时添加食物20 μL。12, 24, 48和72 h后进行取样。每组取3~4头幼虫,放入相应的离心管中,-80℃冰箱保存。
1.8 RT-qPCR检测AcNPC1基因的相对表达量
分别收集1.7节中的中华蜜蜂正常幼虫和CSBV感染12, 24, 48和72 h的幼虫、健康幼虫和感染CSBV幼虫不同siRNA干涉组、dsGFP对照组等材料,采用Trizol法提取总RNA,通过RT-qPCR检测AcNPC1基因和CSBV VP1基因(GenBank登录号: AF469603.1)在CSBV感染过程中的转录水平,引物序列见表1。RT-qPCR体系: Master Mix 2×conc 10 μL, 正反向引物(0.005 μmol/L)各1 μL, ddH2O 7 μL,将上述体系冰上混匀后,移至PCR 8联排反应管中,加入相应的cDNA模板1 μL混匀。RT-qPCR反应程序: 95℃预变性 5 min; 95℃变性40 s, 55℃退火1 min, 72℃延伸50 s, 30个循环;72℃终延伸10 min,12℃保存。反应后进行溶解曲线分析。CFX96TMTouch实时定量PCR系统进行数据记录分析,每个样品为3头幼虫混合后抽提总RNA,至少重复3次,并进行3次独立实验。AcActin为内参基因。
1.9 数据分析
RT-qPCR数据采用2-ΔΔCt方法计算,利用SPSS19.0进行数据统计分析,干扰效率的表达比较采用单因素方差分析(one-way ANOVA)和t检验进行显著性检验(双尾),P<0.05时有显著性差异。基因水平下调率按照以下公式计算:
下调率(%)=[(正常基因表达量-干扰后该基因表达量)/正常基因表达量]×100%。
2 结果
2.1 中华蜜蜂AcNPC1基因序列的特征分析
通过NCBI数据库检索及比对,发现存在3条东方蜜蜂A.cerana的NPC1基因序列,选取NPC1基因序列(GenBank登录号: XP_016906844.1)为研究对象,命名为AcNPC1,AcNPC1由1 339个氨基酸组成,蛋白的分子量大小预测为149.79 kD,等电点为6.37,信号肽剪切位点位于第22和23个氨基酸之间,含有12个N-和8个O-糖基化位点,多个磷酸化修饰位点,推测AcNPC1可能为糖蛋白。通过序列比对发现,中华蜜蜂AcNPC1与已报道的NPC1家族成员相似,都包含信号肽、跨膜域和3个典型的功能域,分别是NTD结构域(N-terminal domain)(第24-264位氨基酸),SSD结构域(sterol-sensing domain)(第615-797位氨基酸)及PTC结构域(patched domain)(第855-1 098位氨基酸),其中NPC1和NPC2结合的结构域命名为C结构域(第371-615位氨基酸),但AcNPC1有14个跨膜域而非13个跨膜域。
以人类NPC1蛋白(3jd8.1.A)的三维结构为模板,利用在线软件绘制中华蜜蜂AcNPC1的三维结构图。软件数据分析结果显示中华蜜蜂AcNPC1蛋白与人类NPC1序列大约为46.79%的相似性。结构域预测分析显示中华蜜蜂AcNPC1的两个蛋白都存在多次跨膜和3个大的膜外功能区,分别为A结构域、C结构域和I结构域,3个膜外功能区相互堆积形成三维空间结构,与人类NPC1蛋白相似,其中NTD结构域即A结构域位于结构的最上方,虽然NTD结构域和胞内环2的保守性最低,但存在较为保守的半胱氨酸位点,由于半胱氨酸(Cys)之间可以形成分子内和分子间二硫键,在蛋白相互作用以及蛋白正确折叠中起着重要作用,同时由于NTD结构域处于膜外区,推测NTD结构域在AcNPC1蛋白运输胆固醇过程中扮演着重要角色。PTC结构域即I结构域和SSD结构域分别位于下方两侧,三者形成了类似三角形的结构C结构域是NPC1与NPC2互作共同介导胆固醇的运输,也是人NPC1与埃博拉病毒结合的区域。
为了进一步了解中华蜜蜂AcNPC1在不同物种间的进化关系,利用MEGA 5.0软件对东方蜜蜂与其他物种的NPC1蛋白序列进行系统进化分析,结果表明,东方蜜蜂NPC1和西方蜜蜂ApismelliferaNPC1始终聚为一枝(图1)。蜜蜂NPC1与膜翅目和双翅目NPC1的同源性非常高,序列一致性超过50%,蜜蜂与脊椎动物的亲缘关系较远,但仍然存在41%NPC1序列一致性,属于较高同源性;NPC1在脊椎动物和无脊椎动物中都具有较高的同源性,说明该NPC1蛋白在物种进化过程中是比较保守的。
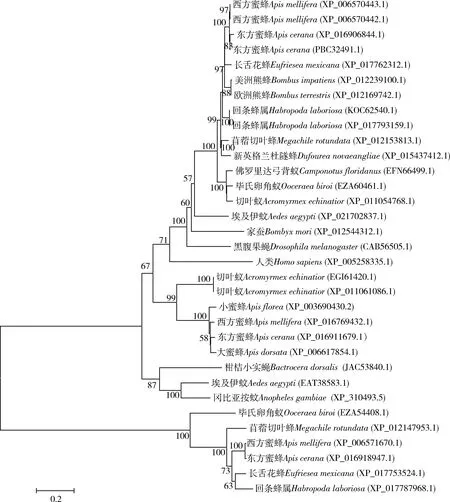
图1 基于氨基酸序列构建的东方蜜蜂和其他物种NPC1蛋白的系统进化树(邻接法)
2.2 中华蜜蜂AcNPC1原核表达
PCR扩增获得了长度约为650 bp的条带(图2: A),与理论长度一致,命名为AcNPC1。将AcNPC1与pMD19-T连接,经测序验证正确后(图2: B),将AcNPC1与表达载体pET-30a连接构建重组表达质粒pET-30a-AcNPC1,进行PCR检测和双酶切验证(图2: C),结果表明重组表达质粒pET-30a-AcNPC1构建成功。
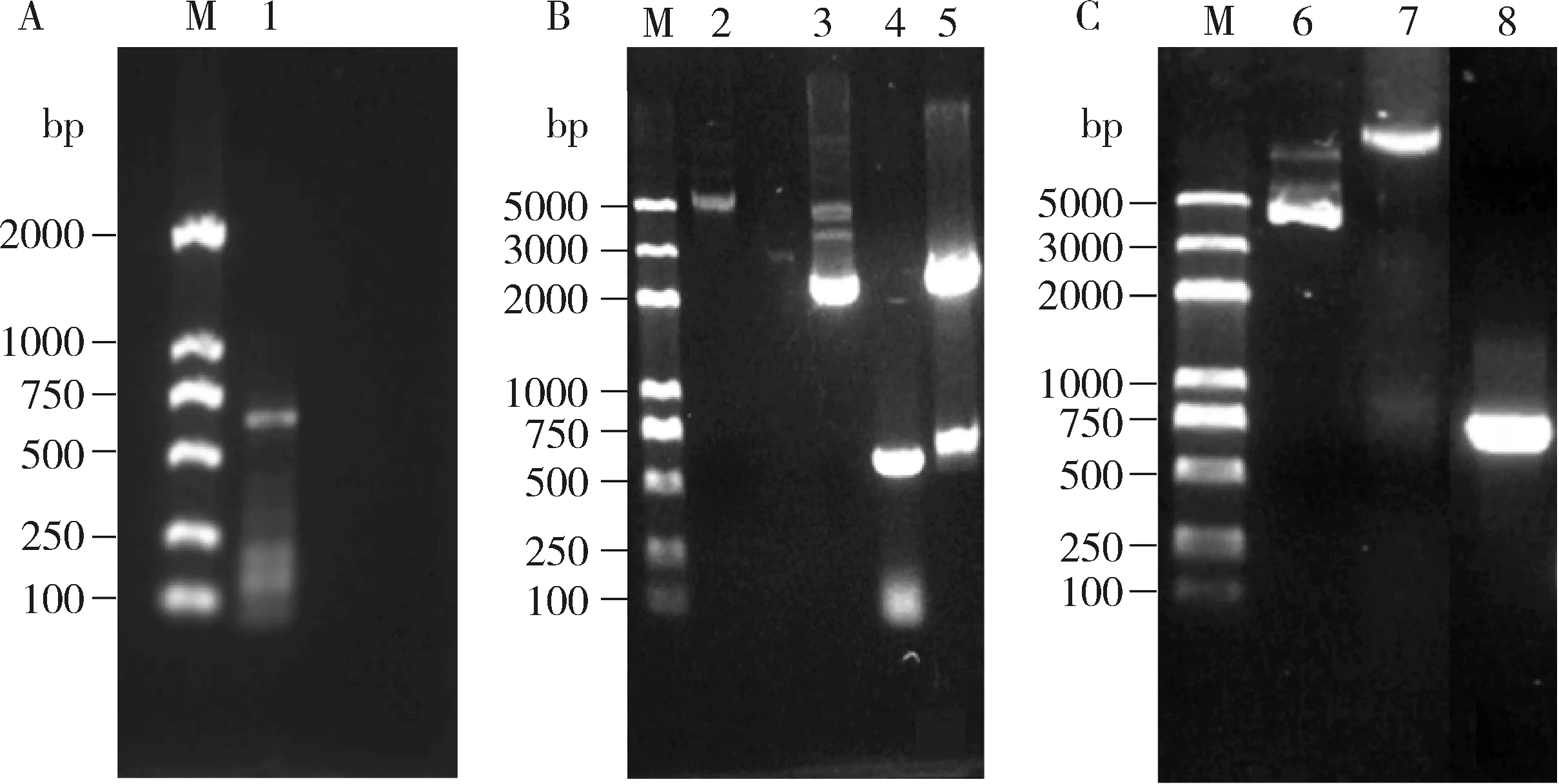
图2 中华蜜蜂AcNPC1基因PCR扩增(A)、验证(B)和原核表达载体构建(C)
2.3 重组蛋白AcNPC1的诱导表达及表达形式
将验证正确的pET-30a-AcNPC1重组表达质粒转入原核表达载体RosettaTM(DE3)进行体外蛋白原核表达,利用0.1 mmol/L IPTG诱导表达,产物经SDS-PAGE蛋白电泳检测,结果如图3(A)所示,IPTG诱导下获得了蛋白分子量约为36 kD的目的蛋白带。利用Ni-NTA superflow cartridges以含8 mol/L尿素的洗脱缓冲液对重组蛋白进行纯化与富集,将收集的蛋白溶液进行SDS-PAGE电泳检测(图3: B),5-8泳道为纯化蛋白随机取样的电泳结果,条带单一,表明纯化效果较好。由于高浓度的尿素对细胞有毒害作用,在免疫小鼠时可能产生造成一定的伤害甚至死亡,因此采用透析将尿素含量降低至2 mol/L,将透析后的蛋白溶液进行SDS-PAGE蛋白电泳检测(图3: C),结果显示透析后的蛋白浓度较高,通过纯化及透析共制得约10 mg重组蛋白作为抗原制备多克隆抗体。
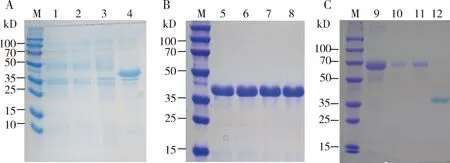
图3 SDS-PAGE检测中华蜜蜂AcNPC1重组蛋白的诱导表达(A)及纯化(B和C)

图4 Western blot检测抗血清对重组蛋白AcNPC1(A)和中华蜜蜂总蛋白(B)的特异性
2.4 中华蜜蜂抗AcNPC1多克隆抗体
用纯化后重组蛋白AcNPC1作为抗原制备鼠多克隆抗体,将多克隆抗体与上述纯化、透析后的重组蛋白AcNPC1进行蛋白免疫印迹分析(4: A),在分子量为36 kD左右处有一条明显的杂交信号条带,表明抗体AcNPC1是特异性与重组蛋白AcNPC1反应。进一步免疫印迹分析AcNPC1在中华蜜蜂中的表达情况,结果表明(4: B),AcNPC1抗体可以从中华蜜蜂总蛋白中杂交到两条带,分别约70和30 kD,推测可能原因是膜蛋白的提取比较困难,AcNPC1在提取过程中发生了部分降解。
2.5 siRNA对中华蜜蜂AcNPC1表达水平的影响
RT-qPCR数据分析表明,与对照相比(正常幼虫),给正常中华蜜蜂幼虫分别添食AcNPC1的siRNA1, siRNA2和siRNA3后,siRNA1片段最先开始表现出干涉效果,在添食12 h后AcNPC1基因表达下调了66.19%(P<0.05),siRNA1, siRNA2和siRNA3干扰24 h时均使AcNPC1基因表达显著下调(P<0.01),分别下调了73.20%, 72.81%和54.78%;在添食48 h后siRNA1仍具有干涉效果(P<0.05),AcNPC1基因表达下调了57.76%(图5)。与CSBV添毒幼虫相比,感染CSBV的幼虫在添食siRNA1片段 12 h后AcNPC1基因表达开始出现下调(P<0.05),下调了48.07%,24 h后AcNPC1基因表达下调了43.90%(P<0.05);添食siRNA2和siRNA3 48 h后,感染CSBV的幼虫AcNPC1基因表达出现显著性下调(P<0.01),分别下调了59.85%和57.67%(图5),说明siRNA1, siRNA2和siRNA3 3个干涉片段均对CSBV添毒幼虫中的AcNPC1具有干扰作用,其中siRNA3效果最为明显。图6显示,使用siRNA1干扰AcNPC1后12 h,与未干扰组相比,CSBV VP1基因表达量明显降低并逐渐下降,到72 h时,CSBV VP1基因的表达水平下调了67.65%(P<0.01),而此时该实验组中AcNPC1的表达并未被siRNA1显著下调(图5),暗示CSBV病毒含量的变化与AcNPC1的表达并不直接相关。
3 讨论
NPC1蛋白是胞内运输胆固醇的重要受体蛋白,是维持人体健康的重要因子,其突变将会使细胞中胆固醇和鞘糖脂等脂类沉积在晚期胞内体、溶酶体,从而引发疾病。多种研究表明NPC1蛋白也参与了多种囊膜病毒侵染宿主细胞过程,说明NPC1蛋白不仅维持细胞正常生理活动所必需的,也是及其重要的病毒侵染因子即协助囊膜病毒进入细胞。中蜂囊状幼虫病病毒(CSBV)是严重威胁中华蜜蜂的健康病原之一,CSBV属于无囊膜的RNA病毒,目前对无囊膜的RNA病毒的入侵机制已有大量研究,但受体介导病毒入侵的机制尚不清楚,而CSBV作为无囊膜病毒的代表无疑是最好的研究材料之一,因此本研究对中华蜜蜂AcNPC1在CSBV侵染蜜蜂是否相关进行初步探索。
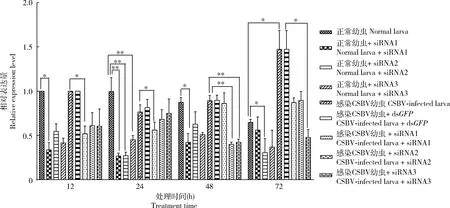
图5 siRNA对中华蜜蜂正常幼虫和感染CSBV幼虫中AcNPC1表达的影响
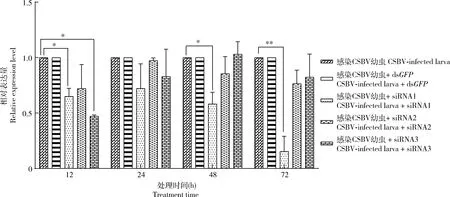
图6 siRNA 干扰AcNPC1对感染CSBV的中华蜜蜂幼虫中CSBV VP1基因表达水平的影响
通过对中华蜜蜂NPC1序列信息的深入分析,为了研究NPC1是否与CSBV存在互作,我们选取NPC1蛋白与埃博拉病毒结合的区域为靶标,构建原核表达载体,进行IPTG诱导表达,得到了蛋白分子量为36 kD重组蛋白,并以其为抗原进行动物免疫,获得相应的抗血清,将收集得到的血清与重组蛋白进行免疫印迹分析杂交到一条特异的、分子量大小约为36 kD的蛋白质条带。而与中华蜜蜂总蛋白的免疫印迹分析发现,NPC1抗体能杂交到两条带,有可能是在提取膜蛋白过程中该蛋白发生了部分降解。
本研究利用RT-qPCR从mRNA水平检测了AcNPC1基因在正常中华蜜蜂幼虫和感染CSBV中华蜜蜂幼虫中的表达水平,结果显示正常幼虫中AcNPC1基因表达量呈先下调后上调趋势(图5)。为了进一步确定AcNPC1是否参与了CSBV感染宿主的过程,我们通过体外饲喂siRNA下调AcNPC1基因表达后,检测CSBV病毒在蜜蜂幼虫中的增殖情况。RT-qPCR数据表明,正常幼虫中AcNPC1的3个干涉片段均对AcNPC1基因有下调作用。siRNA1的干涉效果最好,仅在干涉12 h后使AcNPC1基因表达下调了66.19%,而在感染CSBV的幼虫中,3个干涉片段的干涉效果不及在正常幼虫中的干涉效果(图5)。越来越多的研究数据表明,病毒可通过编码 RNA 或蛋白质抑制剂来干扰 RNAi。例如HIV-1的Tat蛋白通过阻止Dicer将前体dsRNA加工成siRNA而消除细胞的RNAi防御功能(Bennasseretal., 2005),埃博拉病毒的VP35也被证实具有与HIV的Tat类似抑制RNAi的作用(Haasnootetal., 2007)。CSBV病毒为正义单链RNA病毒,因此,我们推测CSBV对宿主蜜蜂幼虫可能具有抗RNAi的作用,从而导致感染CSBV的幼虫中RNAi效果不理想。在RNAi干扰实验中,值得注意的是,CSBV病毒的VP1基因显著下调时AcNPC1并没有被显著沉默(图5, 6),可能是因为NPC1下调后并不直接影响CSBV的感染而是影响了宿主的其他代谢活动进而影响了CSBV病毒的增殖。此外,图5显示CSBV病毒感染72 h时AcNPC1基因才出现显著上调,也进一步表明AcNPC1基因可能不是CSBV入侵直接相关的关键基因。
综上,本研究首次对中华蜜蜂AcNPC1进行了原核表达,获得了高纯度的重组蛋白,制备了特异性强的鼠多抗,为后期AcNPC1蛋白的精细定位奠定基础。同时,本研究利用合成的siRNA对中华蜜蜂幼虫中AcNPC1的表达进行干扰,使AcNPC1基因下调了50%以上,表明在蜜蜂中通过饲喂的方式进行RNAi是可行的。此外,AcNPC1与CSBV病毒感染之间的相互关系有待进一步分析验证。
