冰片对血脑屏障通透性影响机制的研究进展
2021-01-08张英睿董泰玮胡琼丹樊亚梅
张英睿,王 建,董泰玮,陈 念,胡琼丹,樊亚梅
(成都中医药大学药学院,四川 成都 611137)
冰片商品有3 种,分别是龙脑香科植物龙脑香Dipterocarpus turbinatus Gaertn.f.树脂的加工品,即天然冰片;源于菊科植物艾纳香Blumea balsamifera (L.) DC.叶提取的结晶,即艾片;以樟脑、松节油等为原料,经化学方法合成的精制品[1],即合成冰片,均收载于2020 版《中国药典》,其味辛、苦,性微寒或凉,有开窍醒脑、清热止痛之效[2],冰片常作为佐药以引药上行。冰片芳香走窜,能开启闭阻心窍,因心主神明,脑为元神之府,心与脑息息相关[3],故其配伍应用在心脑血管病治疗中尤为广泛。
血脑屏障是彼此紧密相连的脑毛细血管内皮细胞,与周围的星形胶质细胞和周细胞相互作用形成的屏障系统,结构[4]见图1。其中,脑毛细血管内皮细胞之间的紧密连接是大分子物质经血脑屏障转运的屏障[4],可选择性允许所需营养物质进入屏障,阻止某些大分子物质进入脑组织,从而保持中枢神经系统内环境的相对稳定,但这也限制了大多数药物到达患处并发挥治疗作用,成为药物治疗中枢神经系统疾病的重要制约因素[5]。
现代药理研究表明[6],冰片可增加生理性血脑屏障通透性,促使其他药物通过其而引药上行,同时也可降低已损伤脑组织的血脑屏障通透性,起到保护脑缺血再灌注后其结构的作用[7]。由此可见,冰片可发挥双向调节血脑屏障通透性的作用。
汪宏锦等[8]研究表明,天然冰片、艾片、合成冰片主要成分(分别为右旋龙脑、左旋龙脑、异龙脑) 对血脑屏障通透性的作用方向一致,并且其剂量不同,影响血脑屏障通透性的作用强度也有所差异。冰片对血脑屏障通透性作用方向的影响因素主要有2 点,分别为脑组织的生理病理状态、冰片的临床用法(单用或配伍),以下将对其进行概述。
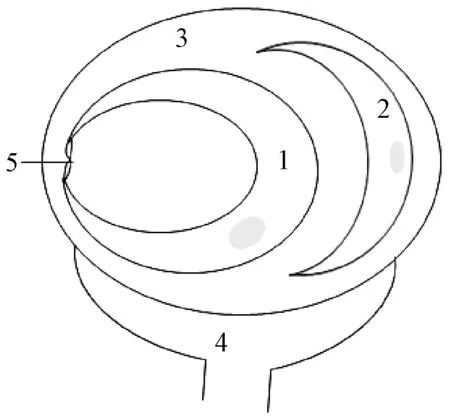
图1 血脑屏障结构示意图
1 冰片对生理状态血脑屏障通透性的影响
1.1 增加生理性血脑屏障通透性 冰片不仅具有开窍醒神的功效,而且性善走窜,引药上行。王宁生等[9]应用CT动态扫描技术,首次提出冰片引药上行、佐使有功等作用的发挥可能与其能增加生理性血脑屏障通透性有关;现代药理研究显示[10],冰片可促进生理性血脑屏障开放,而且不会引起脑的病理性损害,并对脑及血脑屏障有一定的保护作用。
1.1.1 单用促透增量 李伟荣等[11]发现,小鼠灌服天然冰片5 min 后脑内即可测得其所含成分含有量,表明灌胃给药后它自身可直接透过血脑屏障迅速入脑,发挥促透作用。Wu 等[12]报道,相较于对照组(灌胃给予生理盐水),灌胃给予等量天然冰片后小鼠脑内尼莫地平含有量显著升高,AUC5~60min提高30%,提示冰片可促进生理性血脑屏障开放,引药上行。俞浩等[13]研究表明,小鼠尾静脉注射罗丹明123(Rh123) 5 min 后,合成冰片高剂量组(200 mg/kg)、中剂量组(100 mg/kg) 与溶剂对照组相比脑组织内该染料含有量显著升高,同时低剂量组(50 mg/kg) 也有升高趋势,表明冰片增加血脑屏障通透性作用与其剂量呈正相关。
1.1.2 配伍促透他药 陈振振等[14]发现,艾片配伍各剂量麝香酮均可提高血脑屏障体外模型的细胞膜流动性,降低细胞膜电位,调节细胞内Ca2+含有量,从而促进栀子苷进入脑部,表明两者配伍具有芳香开窍的作用,可促进生理性血脑屏障开放。黄萍等[15]报道,合成冰片与安息香配伍时可显著增加小鼠脑组织中伊文思蓝(EB) 含有量,增强开窍醒神的功效。陈群[16]研究表明,低剂量合成冰片(300 mg/kg) 与丹皮酚联用后小鼠脑组织中后者含有量高于高剂量冰片(600 mg/kg) 联用合用组,与俞浩等[13]结论相悖,具体有待进一步研究。
1.2 机制研究
1.2.1 增加NO 水平 NO 作为扩血管因子之一,可改善局部神经元的氧供应和微循环,调节脑毛细血管内皮细胞通透性[17],舒张脑血管,是影响血脑屏障通透性的信使分子,通常相关研究是通过考察一氧化氮合酶(NOS) 间接进行的,其中内皮型一氧化氮合酶(eNOS) 在生理条件下存在并发挥生理效应。赵保胜等[18]研究表明,合成冰片可诱导eNOS 表达增强,促使脑毛细血管内皮细胞生成更多的NO,从而介导血脑屏障开放。
1.2.2 影响组胺水平 组胺是一类具有广泛生物活性的单胺类神经递质,同时也是机体重要的信息传递物质,存在于神经元及组胺能神经纤维中,脑内其水平升高时可增加血脑屏障通透性。Li 等[19]发现,合成冰片可升高大鼠下丘脑内组胺水平,从而介导血脑屏障开放,但该作用具有一定饱和性。曹阳[20]报道,相较于空白组、伊立替康单用组,不同剂量合成冰片联用伊立替康后大鼠脑内组胺水平均明显上升,血脑屏障通透性增加。研究表明,组胺诱发血脑屏障通透性增加由NO 介导,这也是生理状态下它调节微血管通透性的机制之一[21-22],具体见图2。
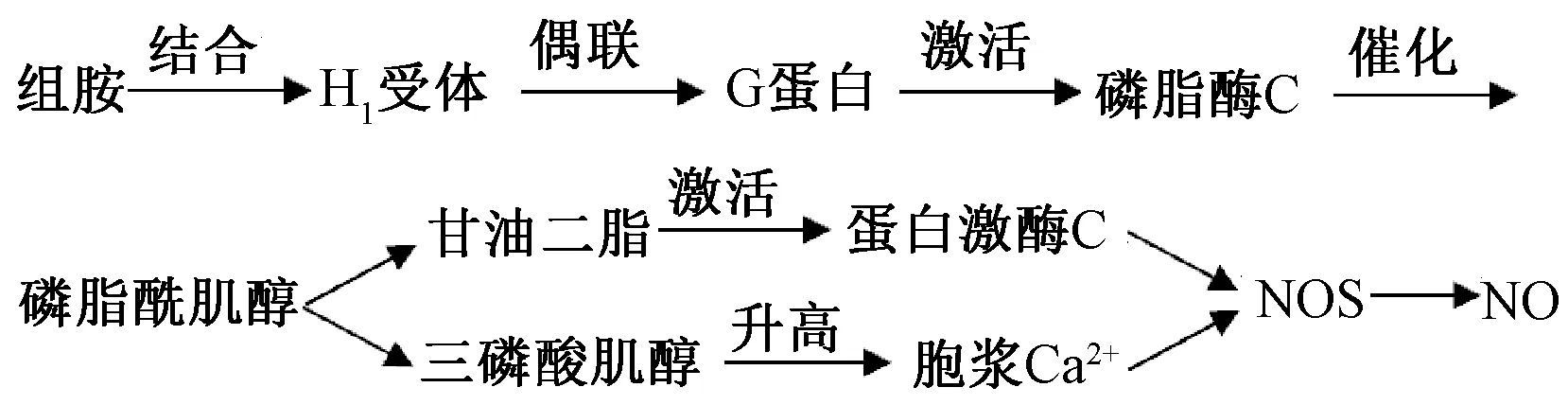
图2 组胺与NO 的关系
1.2.3 抑制P-糖蛋白表达 P-糖蛋白是具有药物外排泵功能的糖蛋白,在血脑屏障处主要分布于脑毛细血管膜的腔面上,其外排作用对药物的脑部转运具有重要意义,可单向将特定药物排出到脑微血管腔内,阻止其向中枢分布,发挥屏障作用[23]。若同时存在2 种亲和力不同的底物,则均可与P-糖蛋白发生竞争性结合,而且亲和力大者易与其结合而被泵出细胞膜外,亲和力小者则易在细胞内蓄积[24]。
陈振兴[25]应用细胞流式仪和蛋白质免疫印迹法,对P-糖蛋白表达、转运活性等方面进行机制研究,发现天然冰片、艾片、合成冰片均能影响其表达,抑制其转运活性,而且艾片作用更强。朱国栋[26]研究表明,合成冰片不能抑制大鼠脑组织中P-糖蛋白表达,但其作用与相关竞争性抑制剂维拉帕米相似,推测冰片可能发挥竞争性抑制作用而优先与P-糖蛋白结合,从而抑制不易于透过血脑屏障的药物外排而在细胞内聚集,介导血脑屏障开放[27]。
1.2.4 影响5-羟色胺水平 5-羟色胺是重要的血管活性物质,也是中枢及外周神经系统的重要神经递质,其水平变化对血脑屏障通透性有重要影响。Li 等[19]发现,合成冰片可通过升高大鼠下丘脑5-羟色胺来介导血脑屏障开放,而且其作用持久性与剂量有关。王刚等[28]报道,帕罗西汀联合槲皮素组与合成冰片联合槲皮素组的作用效果有明显差异,表明帕罗西汀作为5-羟色胺抑制剂能显著抑制槲皮素透过血脑屏障,而合成冰片可通过升高大鼠下丘脑5-羟色胺水平可促使血脑屏障开放,从而促进槲皮素透过血脑屏障,使脑组织中其水平显著增加。
但冰片升高5-羟色胺水平的具体机制尚不明确。有研究表明,5-羟色胺拮抗剂是研究P-糖蛋白功能的有力工具[29],故推测冰片升高其水平的机制可能与P-糖蛋白有关。冰片相较于5-羟色胺,对P-糖蛋白的亲和力更大,与后者结合后被泵出细胞外,抑制了两者结合后外排,使5-羟色胺在细胞内蓄积,从而介导血脑屏障开放[24,30]。
1.2.5 改变血脑屏障超微结构 血脑屏障通透性升高时,常表现为血脑屏障紧密连接的开放、基底膜的疏松断裂、内皮细胞的间隙加大。陈怡君[31]通过电镜观察发现,天然冰片可致血脑屏障超微结构疏松,从而增加血脑屏障通透性。葛朝莉等[24]在透射电镜下发现与对照组比较,合成冰片组大鼠脑毛细血管内皮细胞间的紧密连接缝隙变宽,结构减少,提示冰片可使血脑屏障超微结构发生改变,介导血脑屏障开放。
Claudin-5 蛋白是血脑屏障紧密连接膜蛋白,仅需其表达即可形成紧密连接,对维持血脑屏障的正常形态与功能意义重大。Jin 等[32]发现,灌胃给予合成冰片30 min 后,Claudin-5 蛋白从脑毛细血管内皮细胞膜转移至细胞质,紧密连接结构也随之改变,揭示了冰片改变血脑屏障超微结构的机制之一。
2 冰片对病理状态血脑屏障通透性的影响
2.1 可降低病理性血脑屏障通透性 研究表明,血脑屏障破坏是脑缺血、脑梗塞等中枢神经系统疾病的重要病理基础[4]。在病理状态下,脑毛细血管内皮细胞、星形胶质细胞发生损伤,前者紧密连接开放,后者足端肿胀[33],血脑屏障通透性显著增加,导致某些大分子物质可通过血脑屏障,而冰片可降低血脑屏障通透性,恢复其正常功能,从而起到修复脑损伤、保护脑组织的作用。
2.1.1 单用 文静[34]发现,天然冰片、合成冰片可改善永久性大脑中动脉栓塞(pMCAO) 模型大鼠的脑毛细血管超微形态结构,与假手术组相似,表明两者对受损神经元及血脑屏障结构具有一定的修复作用。田徽[35]报道,艾片、合成冰片中的龙脑可迅速透过局灶性脑缺血(MCAO)大鼠血脑屏障,改善其紧密连接的破坏程度,从而降低其通透性以发挥调节作用,同时证实艾片透过率略高于合成冰片,而且其疗效有优于同剂量合成冰片的趋势。
2.1.2 配伍 徐露等[36]研究天然冰片配伍灯盏花素后脑缺血再灌注大鼠血脑屏障通透性的影响,发现与模型组比较,两者配伍后伊文思蓝含有量显著降低,表明血脑屏障通透性降低,从而得到了保护。杨筱倩[37]等报道,艾片配伍黄芪甲苷、三七总皂苷后,相较于单用可增强对大鼠脑缺血再灌注后脑组织的保护作用。姚洪武等[38]考察了合成冰片、麝香及其两者不同配比对缺血性模型小鼠血脑屏障通透性的影响,发现与模型组相比,冰片-麝香2∶1、3∶1配伍组脑内伊文思蓝含有量显著降低,以前者更明显,提示两者合理配伍能降低脑缺血状态下血脑屏障通透性。
另外,以麝香、冰片为主的复方麝香注射液有脑保护作用,两者配伍可通过降低脑含水量、血脑屏障通透性来保护脑组织免受损伤[39]。喻斌等[40]研究表明,合成冰片与川芎配伍对血脑屏障通透性的降低作用及对脑缺血大鼠的保护作用均优于单用川芎,并且中剂量冰片配伍组(160 mg/kg) 疗效优于低剂量(80 mg/kg)、高剂量(320 mg/kg),表明两者配伍对脑缺血的保护作用并非随冰片剂量增加而增强,可能与血脑屏障状态、冰片的临床用法密切相关。
2.2 机制研究
2.2.1 下调NO 水平 NO 作用具有双重性[41],前者来源于诱导型一氧化氮合酶(iNOS) 的NO 具有神经毒性作用,在病理性因素的刺激下其大量表达,生成的NO 因自身毒性或与超氧化自由基结合得到毒性更大的O2-和OHOO-,使血脑屏障通透性病理性增加,导致神经损伤。由此可知,iNOS 参与了血脑屏障的病理性损伤过程。
田徽[35]报道,艾片、合成冰片均可有效降低大鼠脑缺血再灌注损伤后iNOS 表达,从而抑制iNOS 催化合成NO,降低大量NO 所致的神经毒性,减轻脑损伤,使血脑屏障通透性降低,发挥脑保护作用。王玮[42]也发现,合成冰片可减少脑损伤大鼠脑微血管中iNOS 表达,减轻过量NO 所致的病理性损伤,进而起到保护脑组织的作用。
2.2.2 抗炎 基质金属蛋白酶(MMP) 几乎能降解血脑屏障基底膜胞外基质的各种蛋白成分,使血脑屏障受损,其中与血脑屏障破坏最为密切的是MMP-9,其表达仅与炎症细胞有关。例如,TNF-α 可上调MMPs 表达,从而加重血脑屏障损伤。
王建等[43]研究表明,MCAO 大鼠与假手术组比较,脑组织MMP-9 表达显著,给予天然冰片可下调其表达,从而发挥脑保护作用。徐攀[44]发现,给予艾片后抗炎活性药效指数ETNF-α不断升高。倪彩霞等[45]研究四味芳香开窍药对脑缺血再灌注损伤模型大鼠血清TNF-α 水平的影响,发现合成冰片组与5%吐温对照组比较,TNF-α 水平显著降低,提示冰片可抑制其水平、生成、释放,从而发挥一定的抗脑缺血作用。
2.2.3 抗自由基损伤 脑组织中各种氧自由基能通过攻击生物膜中的不饱和脂肪酸来引发脂质过氧化作用,形成脂质过氧化物[如丙二醛(MDA) ],同时降低超氧化物歧化酶(SOD) 活性及其清除氧自由基的功能。因此,组织内MDA 水平和SOD 活性可反映细胞受自由基损伤的程度。
邵新然[46]发现,天然冰片可使脑缺血再灌注损伤模型大鼠脑组织中SOD 活性上调,增强其清除氧自由基的功能。田徽[35]报道,MCAO 大鼠缺血侧脑组织中MDA 水平显著上升,SOD 活性显著下降,表明大鼠术后脑组织受损严重,而艾片、合成冰片可增强机体清除自由基的能力,有效改善自由基损伤程度,从而起到脑保护作用。
2.2.4 影响相关基因表达 细胞凋亡促进基因Bax、细胞凋亡抑制基因Bcl-2 属于Bcl-2 基因家族,两者均与细胞凋亡密切相关,其中前者过度表达产物可拮抗Bcl-2 抑制细胞凋亡的作用,使细胞趋于死亡。研究表明[47],Bax、Bcl-2与脑缺血时发生的细胞凋亡存在因果关系,由于后者表达量低于前者,导致两者比值升高,最终造成细胞凋亡,血脑屏障破坏,从而诱发脑缺血。 Claudins 基因的表达产物是构成紧密连接复合体的主要成分,其表达下调可导致血脑屏障紧密连接疏松,故它具有重要的调节血脑屏障通透性的作用[31,48]。
Dong 等[49]发现,与脑缺血模型组比较,天然冰片、艾片、合成冰片均可显著促进Bcl-2 基因表达,其中合成冰片还可显著降低Bax 表达,天然冰片、合成冰片均可显著降低Bax/Bcl-2 比值,减轻血脑屏障受损程度。现代药理研究表明,Bcl-2 表达产物可通过抑制脂质过氧化反应来抑制细胞凋亡,降低血脑屏障通透性[50];Dong 等[49]也发现与脑缺血模型组比较,天然冰片、艾片、合成冰片均可上调Claudin-5 表达,脑毛细血管内皮细胞、毛细血管基底膜、神经胶质细胞间的连接更紧密,从而降低血脑屏障通透性,发挥脑保护作用。王建[43]等报道,天然冰片配伍红花可通过促进Claudin-5 表达来发挥对脑缺血损伤的保护作用。
3 讨论
冰片可双向调节血脑屏障通透性,不仅增加生理性血脑屏障通透性,引药上行,还降低脑组织受损时血脑屏障通透性,发挥脑保护作用,并且促进、抑制血脑屏障开放的机制完全不同。其中,冰片增加血脑屏障通透性的机制主要涉及NO、组胺、P-糖蛋白、5-羟色胺水平及超微结构,各机制之间相互影响,如NO 是介导组胺增加血管通透性的重要物质,冰片与P-糖蛋白结合促使5-羟色胺在细胞内含量增加。冰片降低血脑屏障通透性的作用主要与NO水平、炎症因子、自由基及基因表达有关,而且不同基因的表达可对血脑屏障超微结构、抗自由基损伤能力产生影响,可见脑组织处于不同生理病理状态时,NO 水平是影响冰片对血脑屏障作用方向的重要因素,而冰片可通过控制其水平来双向调节血脑屏障通透性,具体见图3。
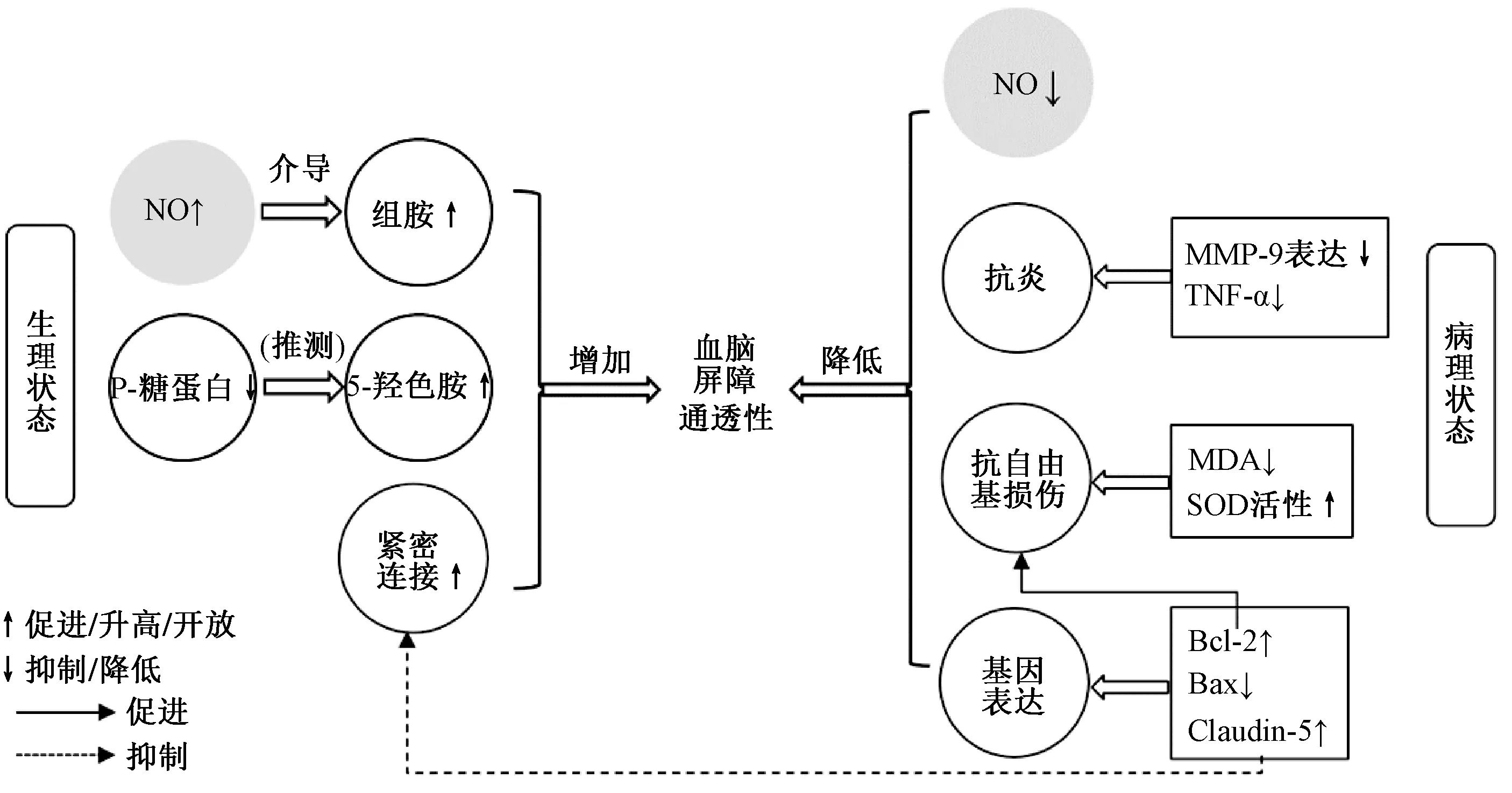
图3 冰片双向调节血脑屏障通透性机制
课题组前期对艾片、合成冰片影响血脑屏障的机制和脑保护作用进行了研究,发现给予两者后MCAO 大鼠血脑屏障的破坏减轻,紧密连接完整,脑水肿改善,水肿率下降,而且艾片高、低剂量组及合成冰片高剂量组可显著增加断头小鼠张口次数、延长存活时间,艾片、合成冰片高剂量组均能显著延长腹腔注射亚硝酸钠、尾静脉注射氯化镁、双侧颈总动脉结扎所致脑缺血小鼠的存活时间,从而发挥脑保护作用。由此推测,其作用机制可能主要与调节NO 通路、P-糖蛋白通路、抗自由基损伤有关。
虽然3 种冰片对血脑屏障通透性的作用强度无显著性差异,但艾片在调节血脑屏障通透性的作用机制、脑保护等方面有优于天然冰片、合成冰片的趋势[25,35],但目前对天然冰片、艾片的研究相对不足,有待进一步考察。不同剂量冰片对血脑屏障通透性的作用也有所差异,综合俞浩[13]、陈群[16]、喻斌[40]实验结果,推测它可能与冰片剂量在一定范围内呈正相关,并存在最佳剂量 (可能为200 mg/kg),此时冰片增加或降低血脑屏障通透性的作用最强,但超过最佳剂量后反而呈负相关,具体还应结合其配伍状况及脑组织生理病理状态进行深入研究。
随着中医药现代化的进一步推进,有别于传统给药形式的冰片现代应用研究已取得丰硕成果。冰片配伍电针的针药结合疗法[51]、载药透过血脑屏障的冰片-聚乙二醇共修饰固体脂质纳米粒[52]、具有潜在脑靶向作用的丹参素冰片酯[53]等均不同程度地扩大了该药材的应用范围,尤其是经过表面修饰的功能化纳米粒,在脑靶向递药及诊断、脑部疾病治疗方面的应用愈加广泛。
综上所述,今后对冰片的研究应在选择适宜品种和剂量的基础上,结合该药材影响血脑屏障通透性的相应机制,围绕它治疗现代脑病的作用靶点进行,以期实现其传统功效与现代制剂(尤其是靶向制剂) 的有机结合。
