沉默PKM2表达可通过Bim来影响肺鳞状细胞癌凋亡
2020-12-24温媛媛杨志强金丹雯钱立勇
温媛媛 杨志强 金丹雯 何 慧 钱立勇
丙酮酸激酶(PK),作为糖酵解的关键酶之一,编码4种不同亚型,L、R、M1、M2[1,2]。PKM2主要表达在正常人类胚胎发育过程中,与组织修复和再生密切相关[3]。PKM2在肿瘤细胞能量供应、上皮-间质转化(EMT)、细胞侵袭转移和细胞增殖等方面发挥重要作用[4,5]。此外,PKM2还可以通过磷酸化、乙酰化等修饰作用与多种蛋白相互调控,介导PKM2在细胞内的不同定位,发挥特殊的生物学功能[6,7]。
近年来,有研究发现在肝癌中PKM2通过调节Bim稳定性来抑制细胞凋亡[8]。Bim作为Bcl-2家族BH3蛋白重要成员,在外界压力诱导的细胞凋亡中发挥重要作用[9]。PKM2介导的肺癌细胞凋亡的分子机制尚不清楚。在肺鳞状细胞癌中PKM2是否可通过调控Bim来影响肺癌细胞凋亡?本研究分析了PKM2在肺鳞状细胞癌中的表达、与临床病理参数的关系及对肺鳞状细胞癌不良预后的影响,探讨PKM2在肺鳞状细胞癌凋亡中的作用及与Bim的关系。
材料与方法
1.标本来源与患者资料:本研究收集了舟山医院病理诊断中心2007年1月1日~2016年12月31日的95例肺鳞状细胞癌与癌旁正常组织标本。所有入组患者均行根治性手术切除,未行化疗或放疗。根据WHO肺癌组织学分类标准(2015年)确定组织学类型,根据2009年国际抗癌联盟(UICC)的TNM分期系统进行分期。所有入组患者术前均获得知情同意。随访方法为门诊和电话随访。生存时间从手术日期至因复发/转移而死亡日期或最后一次随访日期。本文随访数据截止日期为2016年12月,1例患者失访。
2.主要试剂:P免疫组织化学检测试剂盒(中国福州迈新生物技术公司);兔抗人PKM2抗体(英国Abcam公司),兔抗人Bim抗体(美国Santa Cruz公司),鼠抗人β-actin抗体(北京中杉金桥生物技术有限公司),Annexin V-FITC/PI试剂盒(英国Abcam公司);Lipofectamine 2000(美国Invitrogen公司);RNA PCR Kit (AMV) Ver. 3.0试剂盒(日本TaKaRa公司),PCR引物合成与测序委托大连TaKaRa公司进行,PKM2 siRNA(5′-CCAUAAUCGUCCUCACCAATT-3′)和对照siRNA(5′-UUCUCCGAACGUGUCACGUTT-3′) 由上海吉玛生物公司设计合成,Bim siRNA购自美国Santacruz公司。
3.免疫组织化学染色及结果判定:石蜡组织制成4μm切片,按照SP法进行染色:脱蜡,水化,阻断内源性过氧化物酶活性,抗原修复,封闭,分别滴加一抗(PKM2,1∶400)(Bim,1∶100)4℃过夜,PBS清洗后加入对应的二抗、室温孵育1h,DAB显色,复染,常规脱水、透明、封片,显微镜下判读。半定量法评价PKM2与Bim在肿瘤区域的免疫着色。每张切片在光镜下随机选取5个高倍视野,每个视野计数100个细胞,并计算了阳性细胞的百分比。PKM2与Bim均以细胞质中出现棕黄色颗粒为阳性显色,二者染色强度分为3个等级:0为阴性;1为中等着色;2为强着色。染色百分率分为4个等级: 1级1%~25%;2级26%~50%;3级51%~75%;4级76%~100%。以阳性细胞率和染色强度的分值乘积作为每一例的积分,积分<4者判定为阴性或低表达,积分≥4为阳性或高表达。
4.细胞培养和siRNA干扰实验:选取人正常支气管上皮细胞系HBE与人肺鳞癌细胞系SK-MES-1,两种细胞均为贴壁生长的细胞系,均接种在DMEM培养液中,于37℃含5%CO2湿润空气的培养箱中培养。实验分5组:未处理组、control siRNA组、PKM2 siRNA组、PKM2 siRNA+Bim siRNA组及Bim siRNA组,每个实验均重复3次。取生长状态良好的细胞以5×105每孔的密度接种于6孔板中进行转染实验,阴性对照为未转染组与control siRNA组,siRNA 浓度为 20μmol/L,转染具体步骤按Lipofect amine 2000试剂说明书进行。
5.蛋白提取与免疫印迹:使用细胞裂解液,对贴壁细胞进行裂解,4℃静置24h,低温高速离心(4℃, 12000r/min, 40min),提取上清即为总蛋白。加样,上样蛋白量为60μg。经聚丙烯酰胺琼脂糖凝胶电泳1.5h后,转印至PVDF膜,加入Western blot封闭液室温封闭60min,洗净,后将膜立即加入稀释好的一抗(PKM2抗体,1∶500;Bim抗体,1∶600;β-actin抗体,1∶200),4℃孵育过夜。TTBS洗膜3次,后加入对应的二抗室温下孵育2h,ECL显色,X线胶片曝光成像,经自动电泳凝胶成像分析仪采集图像。以目的条带与内参照 β-actin 条带灰度值之比表示目的蛋白的相对表达水平。重复实验 3次。
6.RT-PCR法:细胞离心后加入 1ml Trizol 与液氮混匀,转移至 1.5ml EP 管中,加入200μl 氯仿,经过两次高速离心后(4℃、12000r/min、15min),去除上清液,用 1ml 75%乙醇洗涤管壁和RNA,再经高速离心处理后,弃去上清液,即获得细胞总RNA。利用RNA PCR Kit (AMV) Ver. 3.0试剂盒反转录获得cDNA,扩增PKM2与Bim,以β-actin为内参。PKM2 PCR上游引物: 5′-CCATTACCAGCGACCCCACAG-3′;下游引物:5′- GGGCACGTGGGCGGTATCT-3′。Bim PCR上游引物:5′-CTGCAGATA TGCGCCCAGAGAT-3′; 下游引物: 5′-CACCAGGCGGACAATGTAACG-3′。β-actin PCR上游引物:5′-AAATCGTGCGTGACATTAA-3′; 下游引物: 5′-CTCGTCATACTCCTGCTTG-3′。实验重复3次,取平均值。
7.Annexin V-FITC/PI试剂盒检测凋亡:取对数生长期的细胞,以1×104个/毫升的密度接种于细胞培养瓶内,置于37℃ CO2孵箱中培养。收集细胞,加入300μl的1×binding buffer 悬浮细胞,再分别加入5μl的Annexin V-FITC与5μl的PI,室温避光15min后加400μl PBS,使用流式细胞仪进行分析检测,实验重复3次,取平均值。

结 果
1.PKM2与Bim蛋白在肺鳞状细胞癌中的表达及与临床病理因素的关系:免疫组化结果发现,PKM2在74例肺鳞状细胞癌组织中高表达(77.9%),免疫染色定位于细胞质。在正常支气管及肺泡组织中不表达或低表达(图1)。PKM2高表达与患者高TNM分期(χ2=10.146,P=0.008)、淋巴结转移(χ2=19.011,P=0.003)及肿瘤直径(χ2=8.848,P=0.009)相关(表1)。Bim在65例肺鳞状细胞癌组织中低表达(68.4%),染色定位于细胞质(图1)。Spearman相关性表明,在95例肺鳞状细胞癌中PKM2与Bim表达呈负相关(rs=-0.932,P=0.000,表2)。
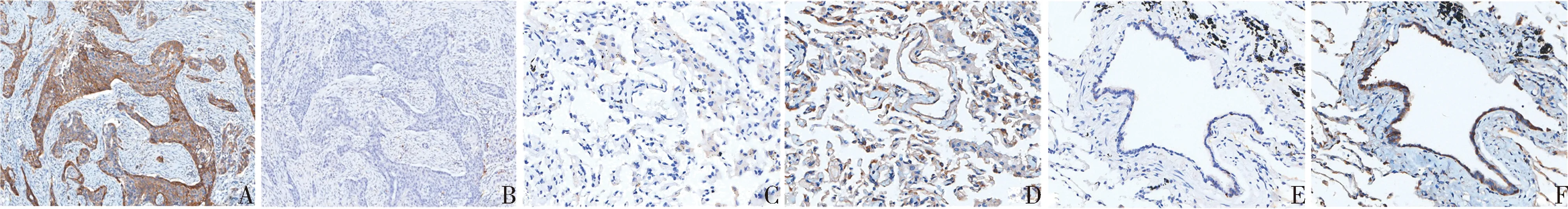
图1 PKM2与Bim在肺组织中的表达(SP法,×200)A、C、E.PKM2分别在肺鳞状细胞癌、正常肺泡上皮及支气管上皮中的表达;B、D、F.Bim分别在肺鳞状细胞癌、正常肺泡上皮及支气管上皮中的表达

表1 PKM2在90例肺鳞状细胞癌中的表达及与临床病理参数的关系
2.PKM2高表达与肺鳞状细胞癌患者不良预后相关:Kaplan-Meier生存分析显示,PKM2蛋白高表达组患者的总体生存期低于PKM2低表达组(χ2=18.630,P=0.000,图2)。单因素分析表明,肿瘤体积大(χ2=9.185,P=0.038)、高TNM分期(χ2=11.453,P=0.011)、PKM2高表达状态(χ2=18.630,P=0.000)、淋巴结转移(χ2=19.857,P=0.000)与患者不良预后密切相关(表3)。将单因素分析中有统计学意义的4项指标引入COX风险比例回归模型分析,多因素分析表明,淋巴结转移(RR=2.896,P=0.003)、PKM2表达(RR=1.798,P=0.038)与患者不良预后显著相关,分别为本组患者生存时间的独立预测因素(表4)。

表2 PKM2与Bim在95例肺鳞状细胞癌组织中表达相关性分析

图2 PKM2表达情况与患者生存曲线分析
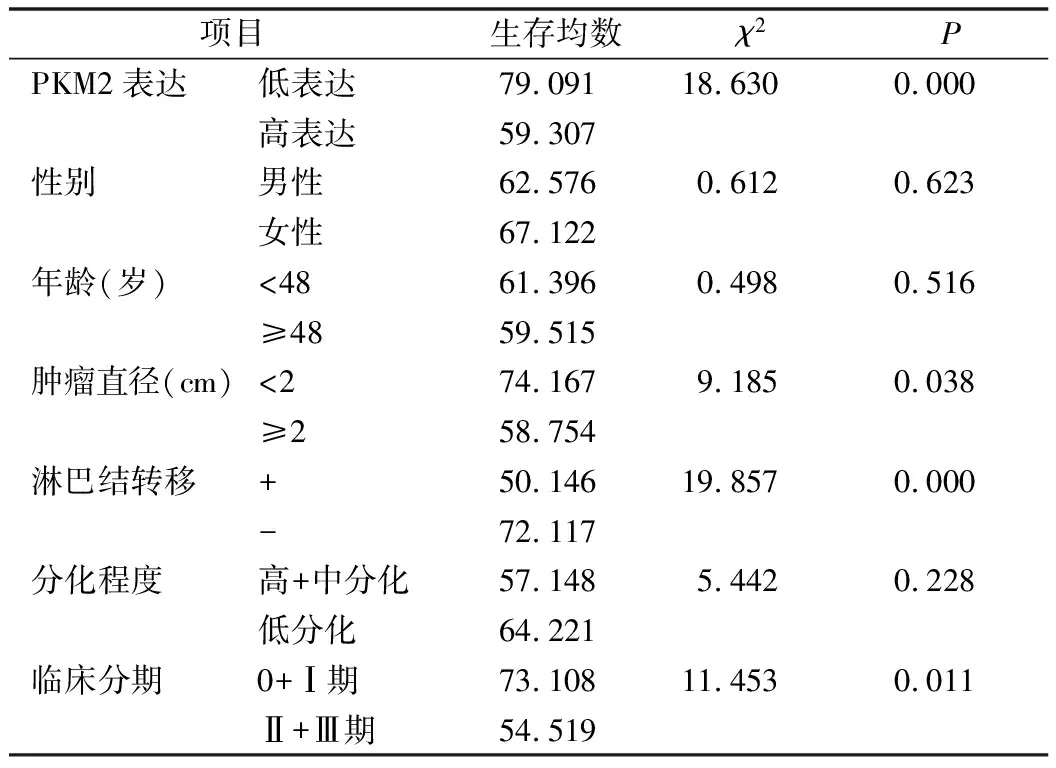
表3 95例肺鳞状细胞癌患者总生存率的单因素分析

表4 95例肺鳞状细胞癌患者预后的多因素分析(COX回归模型)
3.PKM2在肺鳞状细胞癌中高表达:鳞状细胞癌SK-MES-1中PKM2蛋白(t=8.210,P<0.05)与mRNA(t=5.473,P<0.05)表达均高于正常支气管上皮细胞系HBE(图3)。

图3 PKM2蛋白与mRNA在SK-MES-1中表达A.PKM2蛋白在肺鳞状细胞癌SK-MES中表达高于正常支气管上皮细胞系HBE;B.PKM2 mRNA在肺鳞状细胞癌SK-MES中表达高于正常支气管上皮细胞系HBE

图4 肺鳞状细胞癌中沉默PKM2表达后可上调Bim表达A、B、C、D.在SK-MES-1中分别沉默PKM2与Bim表达后,PKM2、Bim蛋白和mRNA 表达情况;E、F.共转染PKM2 siRNA与Bim siRNA后,PKM2与Bim蛋白和mRNA表达情况
4.PKM2可通过Bim抑制肺鳞状细胞癌凋亡:采用PKM2 siRNA片段与Bim siRNA片段来分别沉默PKM2与Bim表达,在SK-MES-1中转染PKM2siRNA或 Bim siRNA 48h后收集细胞,发现PKM2与Bim在PKM2 siRNA组中表达显著低于control siRNA组(P<0.05),Bim在Bim siRNA组中表达显著低于control siRNA组(P<0.05),证明PKM2 siRNA片段与Bim siRNA片段的干扰作用是显著的,在肺鳞状细胞癌中沉默PKM2表达可上调Bim表达(图4中A~D)。为了观察PKM2对肺鳞状细胞癌凋亡的影响,细胞转染PKM2 siRNA 48h后采用 Annexin V-FITC/PI试剂盒处理细胞。与未处理组(10.45%±1.23%)、control siRNA组(11.32%±1.52%)比较,SK-MES-1细胞转染PKM2 siRNA(28.01%±3.65%)后细胞凋亡率明显增加(P<0.05,图5)。为了探讨Bim在PKM2调控细胞凋亡中的作用,SK-MES-1细胞同时转染PKM2 siRNA与Bim siRNA(13.55%±1.74%),与单独转染PKM2 siRNA(28.01%±3.65%)比较,PKM2上调Bim表达的作用明显减弱(P<0.05,图4中E、F),同时细胞凋亡率明显减少(P<0.05,图5)。

图5 肺鳞状细胞癌中沉默PKM2表达可通过上调Bim来诱导细胞凋亡A.SK-MES-1各实验组中细胞的凋亡情况;B.各实验组中凋亡率统计,*P<0.05
讨 论
PKM2已被证实在许多恶性肿瘤中高表达且与这些肿瘤的不良预后相关,例如胃癌、前列腺癌[10,11]。在638例肝细胞肝癌中,PKM2表达上调并与肝细胞肝癌的恶性临床表型显著相关,包括高临床分期、血管浸润和肿瘤直径。PKM2高表达与肝细胞肝癌的总体生存期缩短密切相关[8]。在子宫内膜癌中高表PKM2高表达的患者总体生存率较PKM2低表达患者低[12]。PKM2高表达与食道鳞状细胞癌的总生存期低相关[13]。本研究发现PKM2在肺鳞状细胞癌组织中高表达,且PKM2高表达与患者高TNM分期、淋巴结转移及肿瘤直径相关。PKM2高表达的患者的总体生存期低于PKM2低表达者,PKM2高表达与肺鳞状细胞癌患者不良预后相关,且为患者生存时间的独立预测因素。
PKM2可调控许多恶性肿瘤细胞的增殖与凋亡。文献报道,采用siRNA沉默PKM2表达后可抑制肿瘤细胞生长、促进细胞凋亡[14]。PKM2通过与Bub3结合并在Y207位点磷酸化来直接调节细胞周期进展[15]。PKM2可在T11位点磷酸化组蛋白H来调控细胞周期蛋白cyclinD1与c-myc表达促进肿瘤细胞增殖[16]。这些研究报道均证实PKM2在肿瘤发生、发展中发挥着重要作用。本研究发现,采用PKM2 siRNA片段干扰PKM2表达后,凋亡检测实验发现,沉默PKM2可诱导细胞凋亡。
凋亡是细胞的一种程序性的细胞死亡,包括内源性和外源性凋亡途径[17]。Bim作为Bcl-2家族重要凋亡蛋白成员之一,可激活caspase-9,诱导线粒体凋亡通路[18]。有研究发现在肝癌细胞系中沉默PKM2表达可上调Bim来诱导肝癌细胞凋亡[8]。在肺鳞状细胞癌中,Bim是否也参与了PKM2调控的肺癌细胞凋亡?本研究就这一假设进行探讨,免疫组化与统计结果表明在95例肺鳞状细胞癌组织中PKM2与Bim表达呈负相关,同时采用特异性siRNA片段沉默PKM2表达后可上调Bim表达,共转染PKM2 siRNA与Bim siRNA片段发现抑制PKM2表达可通过上调Bim来诱导肺鳞状细胞癌凋亡。
综上所述,本研究表明PKM2高表达与肺鳞状细胞癌不良预后密切相关,PKM2可通过调控凋亡蛋白Bim表达来影响肺鳞状细胞癌凋亡,为肺鳞状细胞癌的诊治提供新的靶点。
