调控TGF-β1/Smad4通路对宫颈癌SiHa细胞自噬基因p62的影响
2020-12-24杨子霖王志莲
杨子霖 王志莲
宫颈癌(cervical cancer, CC)是全球女性常见的恶性肿瘤,导致宫颈癌的危险因素主要有高危型HPV(high-risk human papillomavirus, HR-HPV)感染、多产、多性伴侣、早期性生活、吸烟以及不良的卫生习惯[1]。研究发现,TGF-β/Smads通路和自噬共同参与癌症的发生、发展,而且二者可以协同促进癌细胞的浸润、转移,因此,明确宫颈癌发展的TGF-β1/Smad4通路和自噬的相互作用可能为预防和治疗子宫颈癌提供潜在的理论依据[2]。
已有研究表明,TGF-β1/ Smad4信号通路在许多类型的癌症中发挥作用,包括宫颈癌。在其早期,TGF-β1可以抑制上皮细胞增殖和促进凋亡,而在宫颈癌晚期,TGF-β1则通过多种机制促进宫颈癌的侵袭和转移。研究表明,Smad4是TGF-β1信号转导的中心介质,在TGF-β1介导的肿瘤发生中的功能转换中起着关键作用[3]。Smad4在宫颈癌中常表现为基因突变或缺失,从而使TGF-β1/ Smad4信号通路中断,减弱了其抑制效应。因此,在TGF-β1/Smad4信号通路中的任何一部分的中断或缺失,会导致该通路的抑癌作用减弱,进而促进宫颈癌的发展。
自噬是发生在细胞内的一种自我消耗机制,是自噬体吞噬了衰老损伤的细胞器、蛋白质和多余的脂质与溶酶体融合后发生降解,其产物输出到细胞质中进行回收利用的一种生理性细胞途径[4]。p62也称为螯合物1(SQSTM1),是一个广泛使用的自噬标志物,当机体细胞发生自噬时,自噬体与溶酶体融合降解错误折叠蛋白质,p62的含量降低。当自噬被抑制时,p62累积,而当自噬被诱导时,p62数量减少。
TGF-β1的自噬激活是通过Smad4和JNK途径介导的,TGF-β1/Smad4通路与自噬的密切作用可能为促进宫颈癌形成重要标志。因此,本研究通过给予外源性TGF-β1和SIS3处理宫颈癌SiHa细胞,探讨调控TGF-β1 /Smad4通路对宫颈癌SiHa细胞自噬关键基因p62的影响。
材料与方法
1.材料来源:宫颈癌细胞株SiHa细胞购自中国科学院细胞库(上海)。
2.实验试剂:人重组TGF-β1蛋白购自美国BD公司;PCR试剂盒购自美国Fermentas公司;PVDF 转移膜购自德国Millipore公司;化学发光试剂购自德国Millipore公司;β-actin pAb购自美国Bioworld公司;RIPA(强)组织细胞快速裂解液购自武汉贝茵莱生物科技有限公司;BCA 蛋白浓度测定试剂盒购自武汉贝茵莱生物科技有限公司;Trizol购自德国Qiagen公司。
3.实验分组及处理:复苏SiHa细胞,后转入25cm2培养瓶中,水平放置于培养箱之中,按照一般细胞培养及传代原则,定期换液,无菌操作。并定期观察记录。当细胞铺满培养瓶底部的80%时,向培养瓶中加入1ml 0.25%胰酶消化将SiHa细胞制成单细胞混悬液,以1.5×105/ml的浓度接种于所需数量的6孔板中,置于培养箱中培养24h,饥饿处理过夜,分为A、B、C、D、E、F共6个组,A、B、C组用移液器各加入等体积(0.5ml)提前配置好的含0、5、10ng/ml的TGF-β1的DMEM高糖液体培养基,培养后收取细胞;D、E、F组用移液器各加入等体积(0.5ml)提前配置好的含0、5、10ng/ml的SIS3的DMEM高糖液体培养基,培养后收取细胞。
4.标本提取及检测p62的mRNA表达量:SiHa细胞干预后加入20μl DEPC溶解RNA,-80℃保存。测定RNA浓度及A260/A280值,RNA反转录为cDNA,引物序列(5′→3′)如下:p62正向引物为AGGACAAATTGCGCCCATTT,p62反向引物为TCTCTTT-CAGGGACAGGCTG,β-actin 正向引物为TGGCACCCAGCAGCACAATGAA,β-actin反向引物为CTAAGTCATAGTCCGCCTAGAA。稀释cDNA后加入20μl反应体系。预变性(95℃,15min)→变性(95℃,30s)→ 退火(60℃,1min)→延伸(60℃,1min);变性、退火、延伸共循环40次,计算结果。
5.标本提取及检测p62的蛋白表达量:取细胞干预后的6孔板,倒掉其培养液,PBS清洗6孔板3次,分别向每孔加入RIPA液100μl,震荡后置于冰上20min;配置BCA工作液后计算蛋白浓度。制备SDS-PAGE凝胶,上样加入Marker及样品,电泳,转膜及封闭,一抗孵育于4℃摇床过夜,次日蒸馏水清洗;洗涤PVDF膜、稀释二抗,静置1h,随后再次洗膜。滴加ECL化学发光液于PVDF膜上目的蛋白区域,放于化学发光成像仪中曝光检测。

结 果
1.TGF-β1影响宫颈癌SiHa细胞中p62 mRNA表达水平:SiHa细胞分别在TGF-β1浓度为0(空白对照)、5、10ng/ml中培养24h后,检测各组细胞中p62在mRNA水平的相对表达量,组间比较结果提示,mRNA相对表达量不全相同(F=30.359、P=0.001),3组间两两比较结果提示,mRNA表达水平从大到小依次为0ng/ml组、5ng/ml组、10ng/ml组,0ng/ml组与5ng/ml组比较、0ng/ml组与10ng/ml组比较、5ng/ml组与10ng/ml组比较,差异均有统计学意义,P值分别为0.006、0.000、0.011,详见图1。
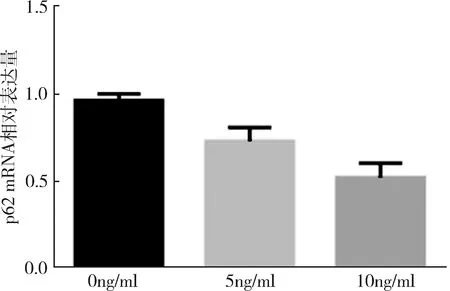
图1 3种浓度TGF-β1对SiHa细胞p62mRNA表达水平的影响
2.TGF-β1影响宫颈癌SiHa细胞中p62蛋白表达水平:p62的分子量为64kDa,以β-actin作为内参。对图2的结果进行灰度值扫描后,以p62相对β-actin的灰度值比作为p62的相对表达量,结果显示,0ng/ml组(空白对照)、5ng/ml组、10ng/ml组的p62相对表达量分别为0.978±0.024、0.781±0.060、0.627±0.088,组间比较结果提示,蛋白相对表达量不全相同(F=23.486、P=0.001),3组间两两比较结果提示,蛋白表达水平从大到小依次为0ng/ml组、5ng/ml组、10ng/ml组,0ng/ml组与5ng/ml组比较、0ng/ml组与10ng/ml组比较、5ng/ml组与10ng/ml组比较,差异均有统计学意义,P值分别为0.009、0.000、0.024,详见图3。
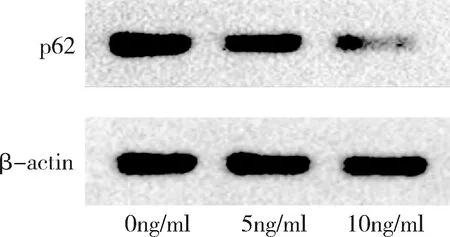
图2 3种浓度TGF-β1对SiHa细胞p62蛋白表达水平的影响

图3 3种浓度TGF-β1对SiHa细胞p62蛋白表达水平的影响
3.SIS3影响宫颈癌SiHa细胞中p62 mRNA表达水平:SiHa细胞分别在SIS3浓度为0(空白对照)、5、10ng/ml中培养24h后,检测各组细胞中p62在mRNA水平的相对表达量,组间比较结果提示,mRNA相对表达量不全相同(F=29.318、P=0.001),3组间两两比较结果提示,mRNA表达水平从小到大依次为0ng/ml组、5ng/ml组、10ng/ml组,0ng/ml组与5ng/ml组比较、0ng/ml组与10ng/ml组比较、5ng/ml组与10ng/ml组比较,差异均有统计学意义,P值分别为0.004、0.000、0.025,详见图4。

图4 3种浓度SIS3对SiHa细胞p62mRNA表达水平的影响
4.SIS3影响宫颈癌SiHa细胞中p62的蛋白表达水平:对图5的结果进行灰度值扫描后,以p62相对β-actin的灰度值比作为p62的相对表达量,0ng/ml组(空白对照)、5ng/ml组、10ng/ml组的p62相对表达量分别为0.911±0.086、1.819±0.337、2.352±0.265,组间比较蛋白相对表达量不全相同(F=25.001、P=0.001),3个组的两两比较结果显示,蛋白表达水平从小到大依次为0ng/ml组、5ng/ml组、10ng/ml组,0ng/ml组与5ng/ml组比较、0ng/ml组与10ng/ml组比较、5ng/ml组与10ng/ml组比较,差异均有统计学意义,P值分别为0.005、0.000和0.041,详见图6。
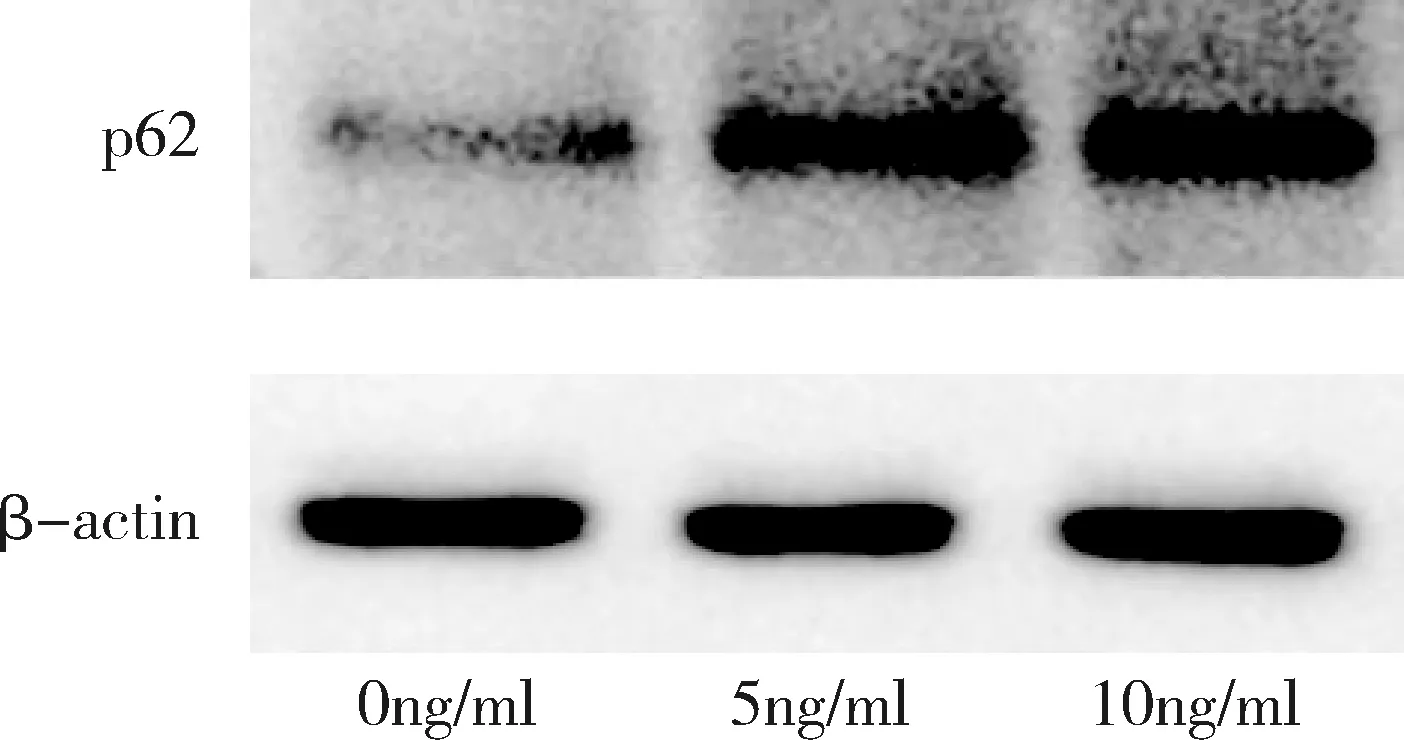
图5 3种浓度SIS3对SiHa细胞p62蛋白表达水平的影响

图6 3种浓度SIS3对SiHa细胞p62蛋白表达水平的影响
讨 论
自噬是宫颈癌发生的关键环节,而TGF-β1介导的TGF-β1/Smad4信号通路是自噬的重要通路之一。在宫颈癌中可显示TGF-β1/ Smad4信号通路的失调。TGF-β1对正常宫颈上皮细胞有强效的抑癌作用,随着宫颈癌的发展,癌细胞转换对TGF-β的反应,并利用该因子作为细胞运动、侵袭、转移和肿瘤干细胞维持的有效启动子。Chen等[5]研究指出,与健康对照组比较,在大约71.21%的宫颈癌患者血浆中检测到TGF-β1高表达。此外,在一些晚期宫颈癌中,TGF-β1水平与临床病理特征如肿瘤大小、侵袭性和低分化呈正相关[6]。Smad4的低表达是宫颈癌中最常见的改变之一,由缺失、突变或表观遗传修饰引起。有文献报道,异位表达的Smad4诱导了SiHa细胞凋亡,并降低了裸鼠宫颈癌的生长,表明Smad4在肿瘤中具有抑癌作用[7]。Phuah等[8]研究发现,miR-210的抑制增加了Smad4蛋白的表达,增强了对宫颈癌的抗增殖和凋亡诱导作用。这些发现表明Smad4在TGF-β介导的肿瘤抑制中起着核心作用。SIS3是一种合成化学物质,能特异性抑制Smad3磷酸化及其与Smad4的结合,并降低TGF-β1的蛋白水平,因此可作为TGF-β1/Smad4通路抑制剂[9]。
研究显示,自噬在癌变的早期阶段起着抑癌作用,可能是通过抑制其对活性氧的产生和促炎性细胞因子分泌的抑制作用。在晚期自噬通过增加在弱氧条件下的癌细胞存活来促进已建立肿瘤中的肿瘤生长和转移[10,11]。自噬和TGF-β1/Smad4通路均广泛参与肿瘤代谢[12]。Zhang等[13]研究表明,自噬和TGF-β1/Smad4途径均参与神经胶质瘤的侵袭,而且自噬相关标记蛋白和TGF-β都被确定与病理等级相关。Smad4作为TGF-β1信号转导途径的关键成员,在激活信号转导途径调控基因表达中发挥抑制作用。细胞自噬功能的不稳定性与宫颈癌的发生、发展密切相关。HPV感染可抑制自噬相关基因的表达,从而促进宫颈癌的发生、发展[14]。p62是与自噬通量有关的中枢自噬相关基因,研究表明,p62的数量上调和无效降解与多种癌症(包括宫颈癌)的发生有关,p62水平的升高可能表明自噬降低不足以降解p62,同时有利于癌细胞突破基膜,导致了肿瘤的扩散和转移[4]。
本研究通过给予TGF-β1浓度为0(空白对照)、5、10ng/ml干预宫颈癌SiHa细胞24h后,p62表达量较对照组逐渐降低,差异有统计学意义(P<0.05),通过给予SIS3浓度为0(空白对照)、5、10ng/ml干预SiHa细胞24h,p62表达量较对照组逐渐升高,差异有统计学意义(P<0.05),提示TGF-β1/Smad4通路通过调节自噬,进而影响宫颈癌的发生、发展。Liang等[15]研究表明,TGF-β1通过TGF-β1/Smad4依赖性途径诱导自噬。在用浓度梯度TGF-β1处理了24h胰腺导管癌细胞中,LC3的表达量逐渐增高。分别用2ng/ml和5ng/ml TGF-β1处理24h的胰腺导管癌细胞,透射电子显微镜显示随浓度升高胞质中自噬体增加。提示TGF-β1介导的TGF-β1/Smad4通路激活了自噬并且影响了下游的LC3表达量。而在胃癌等肠道肿瘤中也有类似发现[16]。上述结论均与本研究结果相符,此研究发现可能为预防和治疗宫颈癌提供新的思路。
综上所述,外源性的TGF-β1 /Smad4通路激活剂TGF-β1可使宫颈癌SiHa细胞自噬蛋白p62 mRNA及蛋白的表达量降低,诱导宫颈癌SiHa细胞发生自噬,细胞侵袭和迁移能力可能增强。外源性的TGF-β1/Smad4通路抑制剂SIS3可使宫颈癌SiHa细胞自噬蛋白p62 mRNA及蛋白的表达量升高,抑制宫颈癌SiHa细胞发生自噬,细胞侵袭和迁移能力可能减弱,且随TGF-β1和SIS3浓度的增加,p62表达量出现变化,具有一定的浓度依赖性。本研究提示调控TGF-β1/Smad4通路可对宫颈癌SiHa细胞自噬基因p62产生影响,意义在于阐明TGF-β1/Smad4通路与自噬关键基因在宫颈癌中的相关性,以提供对宫颈癌潜在机制的深入探讨。
