IVF治疗中卵丘颗粒细胞密度对胚胎学结局的影响
2020-12-24赵激浪欧阳杰吕祁峰李孟惠
董 竞 吴 铃 赵激浪 欧阳杰 凡 永 吕祁峰 李孟惠 李 斌
进行体外授精时,受精及早期胚胎质量将直接影响不孕症患者的治疗结局。常规体外受精-胚胎移植(IVF-ET)操作中,卵丘-卵母细胞复合物(cumulus-oocyte complex, COC)将直接与数量合适的精子进行共同孵育过夜,第2天去除卵丘细胞后观察原核形成及早期胚胎发育情况[1]。在这个过程中,因延长了精卵共同孵育的时间,死亡的精子及受精过程中大量散落的卵丘细胞可能会产生一些不利于早期胚胎发育的物质,如氧化自由基等,从而影响体外胚胎的发育[2]。此外,过多的精子和卵丘细胞也会大量消耗掉培养液中的营养成分,从而对早期的胚胎造成不良的影响。短时授精研究发现,缩短精卵共育的时间不会影响受精率,可提高胚胎发育质量[3~5]。但有研究认为,卵母细胞过早的脱离卵丘细胞存在的微环境会对其成熟、受精产生不利的影响,保留卵丘细胞能够增加卵子受精后的胚胎发育能力,提高胚胎利用率和临床妊娠率[2,6]。现有研究多集中在通过减少精卵共育的时间来改善临床结局,但IVF授精时,卵丘颗粒细胞存在的密度对胚胎学结局的影响尚未引起关注。本研究旨在探讨传统IVF授精时,COC上卵丘颗粒细胞密度对胚胎学结局的影响。本文将通过受精率、卵裂率、优质胚胎率、卵子利用率、临床妊娠率和活产率等多种指标来评价IVF授精时,卵丘细胞的多寡对胚胎学和胚胎移植结局的影响。
对象与方法
1.研究对象:回顾性分析2016年11月~2017年5月(对照组)和2017年11月~2018年5月(研究组)在上海交通大学医学院附属第九人民医院辅助生殖科接受体外受精-胚胎移植治疗的不孕症患者710例。患者纳入标准:首次IVF周期患者;年龄≤35岁;基础卵泡刺激素(follicle stimulating hormone, FSH)<10IU/L;窦卵泡数≥5个;获卵数≤15个。排除标准:严重的内外科系统性疾病不适宜接受促排卵治疗及不能耐受妊娠患者;有高泌乳素血症及产生高雄激素的其他内分泌疾病,如卵巢和肾上腺肿瘤等。对照组按照1∶1与研究组根据年龄、不孕年限和体重指数等患者基本资料进行倾向得分匹配[7]。本研究严格遵守《赫尔辛基宣言》并得到医院医学伦理学委员会的审批,参与对象均签署知情同意书。
2.超促排卵及取卵:按本中心孕激素促排卵方案进行促排[8]。从月经周期的第3~5天开始促排,在促排7~8天后,阴道超声监测卵泡的发育情况,并进行性激素水平的测定,根据卵泡的发育情况及血清中的激素水平,调整用药量,当有1个以上卵泡的直径达到20mm或者3个以上的卵泡直径达到18mm以上时扳机,扳机34~36h后在阴道超声引导下行取卵术。
3.剥除卵丘细胞:先用巴斯德管将取到的COCs在2ml G-IVF(瑞典Vitrolife公司)中洗去残留红细胞,随后转入含1ml G-IVF的Falcon 353037培养皿(美国Corning公司)中,置于培养箱内继续孵育3~4h。授精操作前,先在无菌大皿Falcon 353003中做一个200μl G-IVF的液滴,再将待切除卵丘颗粒细胞的COCs转入液滴中(≤5个COCs),用1ml BD注射器在COC周围呈井字形切割4下(图1),切除卵母细胞周围约80%的卵丘颗粒细胞后,随后将处理好的COC转入含1ml G-IVF的Falcon 353037培养皿中,等待加精。重复上述操作,将所有需要切除卵丘颗粒细胞的COCs处理完毕。上述所有操作均是在37℃,6% CO2的操作箱(美国Astec公司, ss-250)中进行。

图1 卵丘颗粒细胞部分去除前后的比较(×4)A.颗粒细胞部分去除前;B.颗粒细胞部分去除后;C.切卵丘示意图
4.精液处理与体外受精:男方取卵日手淫法取精,密度梯度离心联合上游法优化处理精液,随后将精子置入37℃、6% CO2培养箱内孵育备用。取卵后3~4h,去除和未去除部分卵丘颗粒细胞的卵子行常规IVF授精。COC均置于盛有1ml G-IVF的Falcon 353037培养皿中,加入经密度梯度离心后优选的精子,孵育过夜后,观察原核。
5.胚胎培养与观察:授精后约16~18h观察受精情况,72h观察胚胎卵裂情况。采用Cummins′标准对第3天胚胎进行评级[9]。其中Ⅰ级和Ⅱ级胚胎作为优质胚胎进行冷冻保存;Ⅲ级和Ⅳ级胚胎继续培养至囊胚期。囊胚采用Gardner和Schoolcraft评分系统进行评级。在第5天或第6天,只有3BC级或更高级别的胚胎被冷冻,而囊胚在第7天至少达到3CC才有资格被冷冻。胚胎冷冻根据既有方法采用Cryotop进行[10]。
6.胚胎移植与妊娠结果判断:笔者所在中心常规采用冻融胚胎移植(FET),胚胎移植的内膜准备主要有自然周期、微刺激和激素替代3种方式,均按笔者所在中心常规进行[11]。胚胎移植操作均在超声监测下进行,移植后14天行尿hCG检测,阳性为生化妊娠,再经14天行阴道超声检查,见孕囊者为临床妊娠。

结 果
1.患者基本资料:经过倾向得分匹配后共入选710个周期,研究组和对照组各355个周期。两组患者的年龄、不孕年限、体重指数、基础FSH、基础LH、不孕原因和平均获卵数等基本资料比较,差异均无统计学意义(P>0.05,表1)。
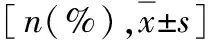
表1 患者的基本资料
2.IVF治疗时降低卵丘颗粒细胞密度对患者受精和胚胎发育的影响:研究组的受精率、正常受精率、有效成囊率和卵子利用率均高于对照组相应指标(P<0.01),异常受精率则低于对照组(P<0.01)。两组间卵裂率和优胚率比较,差异无统计学意义(P>0.05),详见表2。

表2 两组患者受精和胚胎发育的比较[%(n/N)]
3.IVF治疗时不同COC授精密度下卵丘颗粒细胞密度对胚胎学结局的影响:研究组(切除COC上部分卵丘颗粒细胞)中按授精卵数分为低密度(1~5个)、中密度(6~10个)和高密度(11~15个)3组分别与对照组相应授精卵密度的患者进行比较,以分析不同授精密度情况下卵丘颗粒细胞密度对受精和胚胎发育的影响。3个授精密度组内,研究组和对照组患者的年龄、不孕年限、体重指数、基础FSH、基础LH、不孕原因和平均获卵数等基本资料比较,差异均无统计学意义(P>0.05,表3)。

项目低密度(1~5个)中密度(6~10个)高密度(11~15个)对照组研究组对照组研究组对照组研究组周期数7979153153123123年龄(岁)32.56±2.1932.00±2.0632.09±2.2231.87±2.5231.60±2.1331.59±2.44不孕年限(年)3.80±2.353.14±1.933.15±2.013.23±1.893.03±1.663.53±2.01体重指数(kg/m2)22.28±3.7022.66±4.0421.86±3.2422.39±3.4021.59±2.7821.72±2.74基础FSH(IU/L)6.21±1.755.76±1.415.57±1.305.77±1.205.45±1.115.42±1.03基础LH(IU/L)3.37±2.213.93±3.083.65±2.074.04±2.133.96±2.144.05±2.26不孕原因 输卵管因素41(51.90)44(55.70)96(62.75)108(70.59)75(60.98)88(71.54) 排卵障碍4(5.06)2(2.53)3(1.96)2(1.31)5(4.07)7(5.69) 子宫内膜异位症4(5.06)3(3.80)9(5.88)6(3.92)01(0.81) 混合因素26(32.91)28(35.44)36(23.53)31(20.26)37(30.08)21(17.07) 不明原因4(5.06)2(2.53)9(5.88)6(3.92)6(4.88)6(4.88)获卵数3.46±1.343.48±1.438.16±1.368.03±1.3412.81±1.4412.81±1.33
当COC授精密度≤5个时,研究组和对照组之间受精率、正常受精率、异常受精率、卵裂率、优胚率、有效成囊率和卵子利用率比较,差异均无统计学意义(P>0.05)。当COC授精密度>5个时,研究组的正常受精率、有效成囊率和卵子利用率显著高于对照组(P<0.05),异常受精率显著低于对照组(P<0.05),其中当COC授精密度>10个时,研究组的受精率、正常受精率、异常受精率、有效成囊率和卵子利用率与对照组的比较,差异有统计学意义(P<0.01),详见表4。

表4 不同授精密度情况下两组患者受精和胚胎发育的比较[%(n/N)]
4.IVF治疗时降低卵丘颗粒细胞密度对患者胚胎移植结局的影响:研究组和对照组分别进行了449和387个FET周期,研究组和对照组的生化妊娠率、临床妊娠率、宫外孕率、流产率、种植率、活产率、继续妊娠率等比较,差异均无统计学意义(P>0.05);研究组的新生儿孕周、出生体重和出生缺陷率与对照组相似,差异无统计学意义(P>0.05),详见表5。

表5 两组患者FET结果的比较
讨 论
随着辅助生殖技术的发展,人们不断探索如何改进实验方法以获取更高的受精率、更优质的胚胎及更高的临床妊娠率。本研究旨在了解IVF治疗时卵丘颗粒细胞存在的密度对早期胚胎发育的影响,发现在IVF授精前通过切除部分卵丘颗粒细胞降低其密度可显著提高卵子的正常受精率、降低异常受精率,改善早期胚胎质量,增加患者卵子利用率,而对胚胎移植结果没有明显影响。
卵丘颗粒细胞可分泌雌二醇(estradiol, E2)及孕酮(progesterone, P4),常规IVF受精过程中大量颗粒细胞产生的高水平的E2、P4对胚胎具有直接的毒性作用[12,13]。卵丘颗粒细胞还可产生大量的活性氧类物质(reactiveoxygenspecies, ROS),引起细胞膜流动性降低,促使DNA碎片形成和胚胎发育停止,导致透明带硬化,影响胚胎正常孵出,降低胚胎的生存能力[14,15]。此外体外培养过程中大量颗粒细胞也会消耗培养液中的营养,使卵子处于一个相对营养不足的环境中。为减少卵丘颗粒细胞代谢产物对卵子及受精卵可能产生的负面影响,本研究在授精前切除过多的颗粒细胞以降低其密度,在保证受精时间的同时,降低卵子、受精卵周围不良代谢产物的浓度,减少对授精液营养成分的消耗。Gianaroli等[3]研究发现,减少COC暴露于授精液中的时间后,受精率和种植率都显著提高,表明减少COC暴露于授精液中的时间有利于胚胎发育。
多项研究认为短时受精有利于胚胎质量及种植潜能的提高,是减少了卵丘或精子代谢废物对卵子产生的潜在损害,这与本研究有异曲同工之效[16~18]。但是史鸿志等[19]研究发现,过夜受精在受精率、优质胚胎率等指标上甚至优于短时受精联合补救ICSI,因为过夜受精减少了体外操作和暴露时间,一些卵母细胞在过夜培养过程中胞质和胞核达到了更好的成熟状态,且在一个合适的受精浓度范围内,精卵作用时间的延长并不产生负面的影响,反而为卵母细胞提供了更多的优质精子选择。本研究通过在授精前切除COC上部分卵丘颗粒细胞以降低其密度的方法,让卵子在过夜受精的同时又减少了卵丘颗粒细胞代谢废物对卵子产生的潜在损害,研究结果证明了此授精方案的有效性,未来将需进一步扩大样本量,并进行随机对照研究来探索授精前切除部分颗粒细胞对卵子受精和胚胎发育的影响。
既然授精过程中卵丘颗粒细胞产生的代谢废物会影响受精和胚胎发育,那么IVF授精时授精皿中不同的COC密度就会造成卵丘颗粒细胞密度的不同,可能会影响卵子受精和胚胎发育。因此本研究将入组患者按照IVF授精时授精皿内卵子数分组,分析不同授精密度下不同卵丘颗粒细胞密度对受精结果和早期胚胎发育的影响。本研究结果显示,当COC授精密度≤5个时,研究组和对照组之间受精率、卵裂率、优胚率、有效成囊率和卵子利用率比较,差异均无统计学意义。结果与刘晓妍等[20]研究结果一致,该研究发现,当授精密度为1~4个卵子时,授精前剥除部分卵丘细胞不会影响IVF的受精结局;当COC授精密度>5个以后,研究组的正常受精率、有效成囊率和卵子利用率均显著高于对照组的相应指标,异常受精率也显著低于对照组;当COC授精密度>10个时,研究组的受精率、正常受精率、异常受精率、有效成囊率和卵子利用率与对照组的差异愈加显著(P<0.01)。结果表明,卵丘颗粒细胞的高密度存在可能产生了有害的代谢物质影响了受精和胚胎发育,通过切除COC上部分卵丘颗粒细胞降低其密度后,能有效改善胚胎学结局,同时这种改善作用随着授精密度增加更加显著。
IVF治疗的临床结局是医患共同关心的问题。本研究发现研究组和对照组的生化妊娠率、临床妊娠率、宫外孕率、流产率、种植率和活产率等比较,差异均无统计学意义,两组的新生儿孕周、出生体重和出生缺陷率也相似,说明IVF授精过程中降低卵子周围颗粒细胞的密度不会对胚胎移植结局造成影响。
本研究未全部剥除而只是部分切除卵丘颗粒细胞,是因为卵丘颗粒细胞对卵母细胞与精子结合有重要的调节作用。研究表明,卵丘颗粒细胞具有参与精子与卵母细胞的相互识别、维持精子运动活力、引导精子到卵母细胞、诱导精子获能和顶体反应、防止透明带硬化、提高精子的体外受精等能力。Fatechi等[21]和Li等[22]的研究表明,卵丘颗粒细胞的存在增加卵母细胞的体外受精率、卵裂率和胚胎后续发育能力,这说明卵丘颗粒细胞的存在不仅影响精卵结合,而且对卵母细胞的成熟以及受精卵的进一步发育具有重要的影响。另有研究发现,全部除去卵丘颗粒细胞的卵母细胞形成雌雄原核的能力受到了损伤,并有较高的多精受精率,提示卵丘颗粒细胞的存在有助于雌雄原核的形成及防止多精受精。
综上所述,本研究结果表明通过切除COC上的卵丘颗粒细胞以降低其密度,能够改善患者IVF治疗时的胚胎学结局。
