芍药苷干预施万细胞外泌体对背根神经元细胞凋亡的作用
2020-12-24杨鑫伟朱笳悦朱晏伯许利平
韩 朔 李 潇 杨鑫伟 朱笳悦 朱晏伯 许利平
施万细胞(Schwann cell,SCs)是周围神经系统中特有的神经胶质细胞,对周围神经损伤的修复发挥着重要作用,是糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)中的主要靶细胞[1,2]。近年来研究发现,2型糖尿病患者血液中外泌体(exosomes,EXOs)能够诱导氧化应激,导致细胞凋亡,SCs分泌的EXOs装载和传递信号分子,能够影响神经元细胞的结构和功能[3,4]。氧化应激是DPN的主要发病机制,有研究发现,EXOs所携带的核转录因子E2相关因子2 (nuclear factor elytroid-derived factor 2-related factor,Nrf2)等蛋白含量发生改变,加重氧化应激,进而影响背根神经节神经元(dorsal root ganglion neurons, DRGn)[5]。SCs分泌的EXOs是否通过传递氧化应激信号影响DRGn尚不清楚。本研究通过高糖环境诱发的施万细胞氧化应激,观察芍药苷(paeoniflorin,PF)对SCs分泌的EXOs 对DRGn的作用,探讨PF的作用机制。
材料与方法
1.实验材料:(1)细胞:施万细胞株RSC96 CRL-2765,购自美国模式培养物集存库。培养基为含10%胎牛血清的DMEM高糖培养基,培养条件为37℃、5%CO2。(2)动物:5~7天龄新生SD乳鼠,雌雄不限,购自北京维通利华实验动物技术公司,实验动物许可证号:SCXK(京)2016-0006,实验单位使用许可编号:SYXK(京)2018-0003。(3)试剂:Rabbit anti-beta Ⅲ Tubulin(ab18027)、Rabbit anti-Heme Oxygenase 1(ab68477)、Rabbit anti-CD63(ab217345)、Rabbit anti-p75 NGF(ab8874)、Rabbit Anti-Flotillin 1(ab41927)均购自英国Abcam公司。anti-Bax(sc-7480)、anti-Bcl-2(sc-7382)、anti-Casepase 3(sc-56053)、anti-GADD153(sc-7351)均购自美国Santa Cruz公司。芍药苷(110736-201035,纯度96.5%)购自中国药品生物制品检定所。(4)实验仪器:超速离心机(美国Beckman公司,L-80XP),激光共聚焦显微镜(德国Leica公司,TCS SP8),透射电子显微镜(日本Hitachi公司,HD7700)。
2.SCs细胞分组:将SCs分为空白对照组(25mmol/L葡萄糖DMEM+10%FBS)、模型对照组(150mmol/L葡萄糖DMEM+10%FBS)、PF1低剂量组(150mmol/L葡萄糖DMEM+10%FBS+1μmol/L PF)、PF10中剂量组(150mmol/L葡萄糖DMEM+10%FBS+10μmol/L PF)和PF100高剂量组(150mmol/L葡萄糖DMEM+10%FBS+100μmol/L PF),培养24h后收集上清液备用。其中,细胞培养所用FBS采用超速离心法(100000×g,12h)去除EXOs后经0.22μm滤膜过滤。
3.SCs来源 EXOs的提取:SCs分组培养24h后取细胞上清液,按照300×g离心10min、2000×g离心10min、10000×g离心30min的步骤弃沉淀收集上清液,采用超速离心法100000×g离心70min,沉淀用PBS重悬浮后100000×g离心70min,沉淀部分即为EXOs。
4. DRGn培养及分组:采用双酶消化法分离培养DRGn。取5~7天的新生SD乳鼠,处死后于体视镜下取椎间孔内DRGn,放入双酶消化体系(胰酶∶胶原酶=5∶1)中于37℃水浴孵育1h,离心后将DRGn接种于培养皿中。模型组DRGn均给予50mmol/L葡萄糖。将DRGn分为6组,即空白对照组(DRGn完全培养基)、模型+空白外泌体组(模型组DRGn+空白对照组SCs EXOs)、模型组(模型组DRGn+模型对照组SCs EXOs)、PF1低剂量组(模型组DRGn+PF低剂量组SCs EXOs)、PF10中剂量组(模型组DRGn+PF中剂量组SCs EXOs)和PF100高剂量组(模型组DRGn+PF高剂量组SCs EXOs),培养24h后检测相关指标变化。
5.SCs来源 EXOs的形态观察:取超速离心法提取的EXOs,加入戊二醛于 4℃保存,送至首都医科大学医学实验与测试中心形态学研究测试室制备电镜样本,使用Hitachi7700透射电子显微镜观察EXOs形态。
6.SCs来源EXOs的内化实验:取EXOs与2μl PKH26染料,分别加入0.25ml Diluent C中,将二者合并混匀后常温避光孵育4min。混合液转移到离心管中,加入完全培养基中止染色,100000×g离心70min清除多余染料,沉淀部分即为标记完成的EXOs。将DRGn接种到腔室载玻片中,加入标记后的EXOs培养18h后,4%多聚甲醛固定 10min,进行DAPI细胞核染色、封片后采用激光共聚焦法观察EXOs内化情况。
7.Western blot法检测蛋白表达:(1)取SCs来源EXOs,BCA法进行蛋白定量,SDS-PAGE电泳后转膜,5%脱脂奶粉室温孵育1h后用CD63抗体(稀释度均为1∶2000)Nrf2与HO-1抗体(稀释度为1∶500)4℃孵育过夜。次日用二抗室温孵育1h后,加入ECL发光液进行曝光显影。应用Image J软件针对蛋白条带进行分析,获得灰度值以反映蛋白含量。(2)收集分组培养24h后的DRGn,提取细胞总蛋白,BCA法检测蛋白浓度后检测DRGn中GADD153、Bcl-2、Bax(稀释度为1∶500)的表达。应用Image J进行分析获得灰度值,以β-actin为内参,计算相对蛋白含量。
8.统计学方法:采用SPSS 19.0统计学软件对数据进行统计分析。分析前检验数据是否服从正态分布,符合正态分布的数据采用均数±标准误(Mean±S.E)描述。多组独立样本比较采用单因素方差分析(One-wayANOVA),方差齐性(equal variances assumed)条件下,选择最小显著性差异(least significant difference,LSD)分析,方差不齐性(equal variances not assumed)条件下,选择Tambane′sT2 分析,以P<0.05为差异有统计学意义。
结 果
1.SCs来源EXOs的鉴定:透射电镜法观察SCs来源EXOs的形态,如图1A所示,观察到EXOs直径定位在30~100nm,呈圆形囊泡状,具有双层膜结构。Western blot法检测结果表明(图1B),外泌体标志蛋白CD63在空白对照组以及模型对照组中均有表达,模型对照组蛋白表达较空白对照组明显升高,差异有统计学意义(P<0.05)。

图1 SCs来源EXOs的鉴定A.透射电镜法观察外泌体形态(×40000);黄色箭头指向EXOs的双层膜状结构;B.外泌体表面特异性蛋白的表达。n=4
2.SCs来源EXOs中氧化应激相关蛋白表达:与空白对照组比较,模型对照组Nrf2、HO-1蛋白表达升高(P<0.05),PF各组Nrf2、HO-1蛋白表达明显升高(P<0.01);与模型对照组比较,PF10中剂量组、PF100高剂量组Nrf2蛋白表达明显升高(P<0.01),PF1低剂量组、PF10中剂量组的HO-1蛋白表达升高(P<0.01,n=4),差异有统计学意义。PF能增加高糖环境下SCs来源 EXOs中抗氧化应激蛋白Nrf2以及HO-1的表达(图2)。
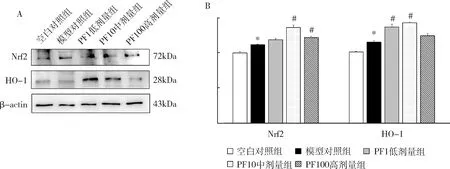
图2 SCs来源EXOs中Nrf2、HO-1蛋白表达水平A.Western blot法检测图像;B.蛋白表达水平, n=4,与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.01
3.SCs来源EXOs的内化实验:SCs分泌EXOs作用于受体DRGn。激光共聚焦显微镜下,观察到绿色部分为DRGn细胞骨架,SCs来源EXOs被PKH26标记呈现红色荧光,位于DRGn细胞的胞质内,分布于蓝色的DRGn细胞核周围,证明DRGn能够摄取SCs来源EXOs。
4.各组EXOs干预后 DRGn中细胞凋亡相关蛋白表达:与空白对照组比较,模型对照组促凋亡蛋白GADD153和Bax蛋白表达明显升高(P<0.01),抗凋亡蛋白Bcl-2蛋白表达显著降低(P<0.01);与模型对照组比较,PF各剂量组促凋亡蛋白GADD153和Bax显著降低(P<0.01),抗凋亡蛋白Bcl-2表达明显升高(P<0.05),差异有统计学意义(图4)。
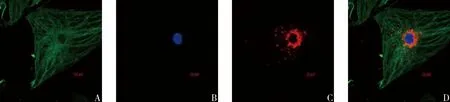
图3 DRGn内化SCs来源EXOs(×1000)A.β-tubulin染色;B.DAPI染色;C.PKH26染色;D.合并后图像

图4 DRGn中GADD153、Bcl-2和Bax蛋白表达水平A.Western blot图像;B.蛋白表达水平, n=4。与空白对照组比较,*P<0.01;与模型对照组比较,#P<0.01
讨 论
EXOs是一种分子直径为40~100nm的亚细胞双层膜囊泡[6]。EXOs表面的四跨膜蛋白超家族如CD9、CD63和CD81,常作为EXOs的特异性标志物。EXOs既可以通过质膜受体直接激活受体细胞,也可以通过转运蛋白质、mRNA、miRNA甚至细胞器进入受体细胞内,同时通过携带处于不同病理状态下的细胞所含有的特异性物质,从而在生理学和病理学上都发挥着重要作用[7,8]。EXOs介导的细胞间交流主要有3种形式,即表面信号分子的直接作用、膜融合时RNAs的直接调节以及生物活性成分的细胞外释放[9]。本实验中SCs释放到培养基中的EXOs含有Nrf2、HO-1。从差速离心技术获取的EXOs,采用Western blot法对EXOs特异性标志蛋白CD63进行验证,证实了从SCs培养上清中分离得到的EXOs特异性,高糖环境下比空白对照组EXOs分泌更多的CD63。电子显微镜观察到囊泡的直径呈40~100nm和双层膜结构,证实了分离的EXOs的大小范围和形态。
SCs可以通过分泌EXOs影响DRG的轴突生长[10]。糖尿病长期的高糖环境可以改变SCs来源EXOs内物质组成,被DRGn摄取后发生神经元细胞凋亡[11,12]。受体细胞摄取EXOs可通过内吞作用、简单融合和EXOs表面配体作用[13]。EXOs携带的货物分子直接影响受体细胞功能[14]。有研究表明DRGn的轴突内化SCs来源于EXOs,促进其在损伤后的再生[15]。DRGn细胞凋亡与缺失是DPN发病机制中的重要环节[10]。SCs与DRGn密切相关,SCs来源的EXOs可以被周围神经轴突内化,促进神经生长,而高糖环境下SCs分泌的EXOs,携带氧化应激信息,内化入DRGn,影响了DRGn的轴突生长[16]。
氧化应激是DPN的主要发病机制,持续的高糖刺激产生大量活性氧(reactive oxygen species,ROS),损伤抗氧化系统,进而导致氧化应激的发生[17]。Nrf2能够通过调节多种抗氧化蛋白、解毒酶和外源转运蛋白的表达,维持细胞内环境稳定,是机体抵抗氧化应激的重要防御性传导蛋白[18]。氧化应激发生时,Nrf2被丝氨酸激酶磷酸化,引起Keapl和Nrf2解离,Nrf2激活进入细胞核,激活下游基因血红素单加氧酶1(heme oxygenase 1,HO-1)的表达,抵抗ROS对细胞的侵害[19]。ROS的堆积导致抗氧化应激信号通路受到抑制,刺激Bax流入线粒体,抑制Bcl-2蛋白的表达,同时直接激活半胱氨酸蛋白酶家族蛋白caspase-3表达,引发神经元细胞凋亡[20]。
PF为毛茛科植物芍药(PaeonialactifloraPall.)或川赤芍(P.veitchiiLynch)的主要有效成分和指标性成分[21]。体内实验证明,PF能够抗自由基损伤。体外细胞实验认为,PF能够明显减弱H2O2对细胞内ROS浓度和线粒体跨膜电位的影响,从而减轻细胞凋亡[22]。本研究结果显示,PF干预SCs分泌的EXOs,携带抗氧化应激防御分子Nrf2、HO-1,通过受体细胞DRGn内化,影响高糖环境下DRGn凋亡蛋白的表达,降低DRGn中促凋亡蛋白GADD153和Bax的表达,增加抗凋亡蛋白Bcl-2蛋白的表达水平,从而丰富其细胞防御机制,以减轻自身的氧化应激状态所致的细胞损伤,发挥抗细胞凋亡作用,保护DRGn,改善DPN。
