STEAP1对乳腺癌细胞增殖、侵袭迁移及Wnt/β-catenin信号通路的影响
2020-12-24李卿明张胜亮徐庭华宋金珂
李卿明 张胜亮 徐庭华 宋金珂
(贵州省中医药大学第一附属医院外科,贵阳 550001)
乳腺癌的发生受多种因素影响,其中原癌基因激活和抑癌基因失活在乳腺癌发生发展中具有重要作用[1]。前列腺跨膜上皮抗原(prostate transmembrane epithelial antigen 1,STEAP1)最早被发现于前列腺癌,为前列腺特异性细胞表面抗原家族成员,在多种恶性肿瘤中高表达,发挥癌基因作用[2,3]。STEAP1在乳腺癌组织中低表达,可能发挥抑癌基因作用,但作用机制尚未明确[4]。Wnt/β-catenin信号通路在乳腺癌细胞的增殖、侵袭和迁移中发挥重要作用。本文研究过表达或沉默STEAP1对乳腺癌细胞增殖、侵袭迁移及Wnt/β-catenin信号通路的影响,探讨STEAP1对乳腺癌的可能作用机制。
1 材料与方法
1.1材料 人乳腺癌BT549细胞(中国科学院上海细胞库),载有STEAP1 cDNA转染的慢病毒、载有STEAP1特异性RNA干扰的慢病毒及相应阴性对照病毒(上海吉凯公司),兔抗人STEAP1单克隆抗体、兔抗人PCNA单克隆抗体、兔抗人Vimentin单克隆抗体、兔抗人MMP9单克隆抗体、兔抗人Wnt单克隆抗体、兔抗人β-catenin单克隆抗体、兔抗人E-cadherin单克隆抗体(美国Santa Cruz公司),TRIzol试剂、ECL化学发光试剂盒、反转录试剂盒、RT-PCR试剂盒(美国BPB公司),CCK8试剂、DMEM培养基、胰蛋白酶(美国Sigma公司)。
1.2方法
1.2.1细胞培养 BT549细胞置于DMEM培养基(含10%胎牛血清和青霉素、链霉素)培养,细胞生长至90%以上融合度时,胰酶消化并收集细胞,传代培养,取对数生长期、生长状态良好的细胞用于后续实验。
1.2.2细胞转染与分组 将转染STEAP1 cDNA慢病毒的BT549细胞作为STEAP1过表达组(LV-STEAP1),转染STEAP1 RNA干扰慢病毒作为沉默STEAP1组(siR-STEAP1),并设空白对照组(BC)及阴性对照组(NC)。将生长良好的BT549细胞制成细胞悬液,加入96孔板(1×106个/孔),培养24 h,转染前1 h更换不含青霉素和链霉素的培养基培养,细胞融合85%以上时进行转染,LV-STEAP1组加入STEAP1 cDNA转染的慢病毒,siR-STEAP1组转染STEAP1 RNA干扰慢病毒,NC组加入阴性对照慢病毒,BC组不转染病毒,培养48 h后Western blot和RT-PCR测定转染效率。
1.2.3Western blot检测BT549细胞STEAP1蛋白水平 取各组转染48 h细胞,每组设7个复孔,加入RIPA裂解液裂解细胞,10 000 r/min离心10 min,取上清,BCA法测定蛋白浓度,取30 μg蛋白煮沸变性5 min,行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转入聚偏乙烯膜,加入脱脂奶粉封闭2 h,加入一抗(1∶300)孵育过夜,加入二抗(1∶5 000)孵育1 h,以β-actin为内参,ECL法发光,检测各蛋白条带灰度值,STEAP1蛋白水平以STEAP1蛋白条带灰度值/β-actin条带灰度值表示。
1.2.4RT-PCR测定BT549细胞STEAP1 mRNA水平 取转染48 h后的BT549细胞,加入TRIzol裂解5 min,提取总RNA,分光光度计测定RNA浓度和纯度,逆转录为cDNA,PCR测定STEAP1 mRNA水平,以β-actin为内参。PCR反应条件:95℃ 15 s;95℃ 5 s,58℃ 30 s,共40个循环,以2-ΔΔCt表示。
1.2.5CCK8测定BT549细胞增殖 将转染后各组BT549细胞接种于96孔板(2×103个/孔),每组设7个复孔,分别于1、3和5 d时加入10 μl CCK8溶液,培养1 h,测定450 nm处吸光度。
1.2.6Transwell法测定BT549细胞侵袭能力 将Matrigal胶用无血清培养基稀释后均匀铺于Transwell小室上室,孵育2 h,取转染48 h的BT549细胞悬液加入铺有Matrigal胶的上室,下室加入完全培养基孵育24 h,取上室液体,擦去上室细胞,多聚甲醛固定30 min,结晶紫染色15 min,树胶封片,显微镜下观察穿过底膜的细胞数即为侵袭细胞数。
1.2.7划痕实验测定BT549细胞迁移能力 将转染48 h的各组BT549细胞接种于6孔板,每组设7个复孔,培养至90%融合度时用200 μl枪头垂直划线,显微镜下测量划痕距离(0 h),将划痕后细胞放入培养箱中培养24 h取出,显微镜下测量划痕距离(24 h),计算细胞迁移距离(迁移距离=0 h划痕距离-24 h划痕距离)。
1.2.8Western blot检测BT549细胞PCNA、Vimentin、MMP9、Wnt、β-catenin、E-cadherin蛋白水平 分别以兔抗人PCNA单克隆抗体、兔抗人Vimentin单克隆抗体、兔抗人MMP9单克隆抗体、兔抗人Wnt单克隆抗体、兔抗人β-catenin单克隆抗体、兔抗人E-cadherin单克隆抗体为一抗进行测定,Western blot方法同1.2.3。
2 结果
2.1过表达和沉默STEAP1对BT549细胞STEAP1表达的影响 与BC组和NC组相比,LV-STEAP1组细胞STEAP1蛋白和mRNA水平升高(P<0.05),siR-STEAP1组细胞STEAP1蛋白和mRNA水平降低(P<0.05),见表1、图1和表2、图2。
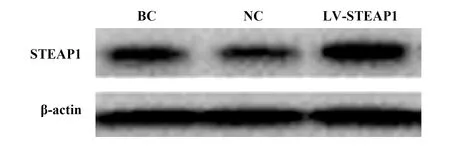
图1 Western blot检测过表达STEAP1对STEAP1蛋白表达的影响Fig.1 Western blot for effect of overexpressed of STEAP1 on STEAP1 protein levels
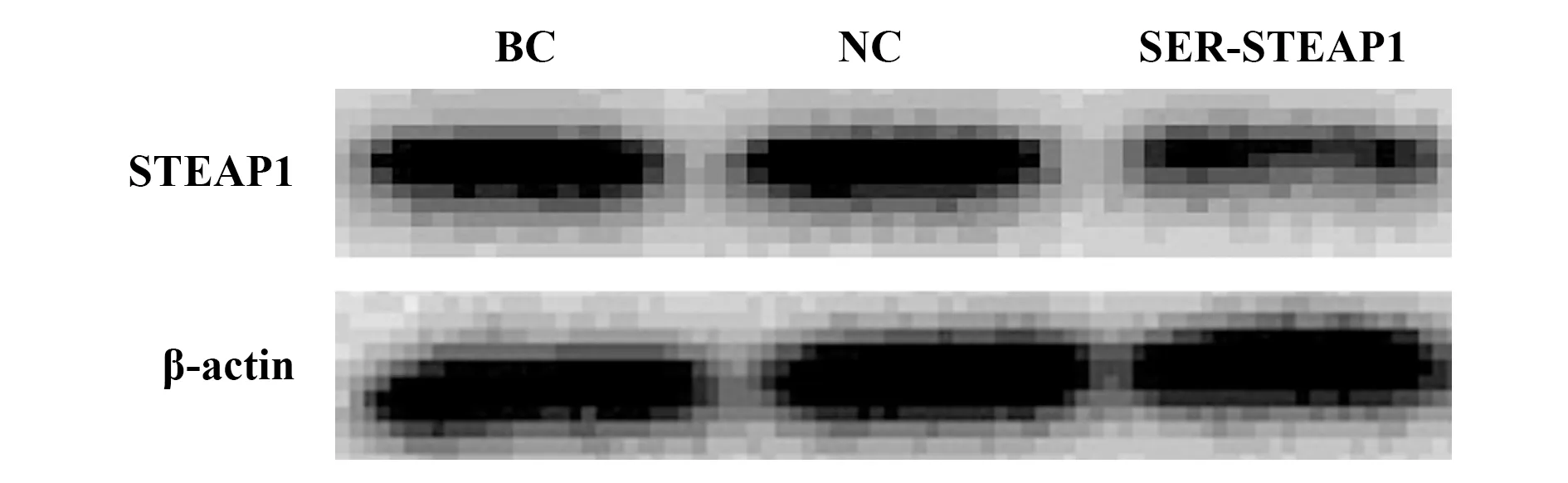
图2 沉默STEAP1对STEAP1蛋白表达的影响Fig.2 Effect of silence of STEAP1 on STEAP1 protein level

表1 过表达STEAP1对STEAP1蛋白和mRNA水平的影响Tab.1 Effect of overexpressed of STEAP1 on STEAP1 protein and mRNA

表2 沉默STEAP1对STEAP1蛋白和mRNA水平的影响Tab.2 Effect of silence of STEAP1 on STEAP1 protein and mRNA
2.2过表达和沉默STEAP1对BT549细胞增殖的影响 与BC组和NC组相比,1 d时各组细胞增殖率差异无统计学意义(P>0.05),3 d和5 d时LV-STEAP1组细胞中增殖率降低(P<0.05),siR-STEAP1组细胞增殖率升高(P<0.05),见表3、4。

表3 过表达STEAP1对BT549细胞增殖的影响Tab.3 Effect of overexpressed STEAP1 on proliferation in BT549

表4 沉默STEAP1对BT549细胞增殖的影响Tab.4 Effect of silence STEAP1 on proliferation of BT549
2.3过表达和沉默STEAP1对BT549细胞侵袭和迁移的影响 与BC组和NC组相比,LV-STEAP1组侵袭细胞数减少,迁移距离缩短(P<0.05),siR-STEAP1组侵袭细胞数减少,迁移距离延长(P<0.05),见表5、6和图3~6。

表5 过表达STEAP1对BT549细胞侵袭数和迁移距离的影响Tab.5 Effect of overespressed STEAP1 on number of inva-sive cells and migration distance of BT549

表6 沉默STEAP1对BT549细胞侵袭数和迁移距离的影响Tab.6 Effect of silence STEAP1 on number of invasive cells and migration distance of BT549
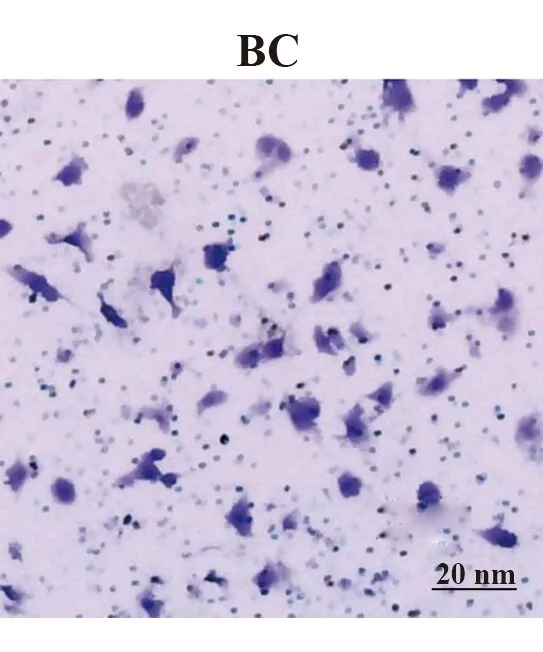
图3 Transwell测定过表达STEAP1对BT549细胞侵袭能力的影响(×400)Fig.3 Transwell to determine effect of overexpresseol STEAP1 on invasive ability of BT549 cells (×400)
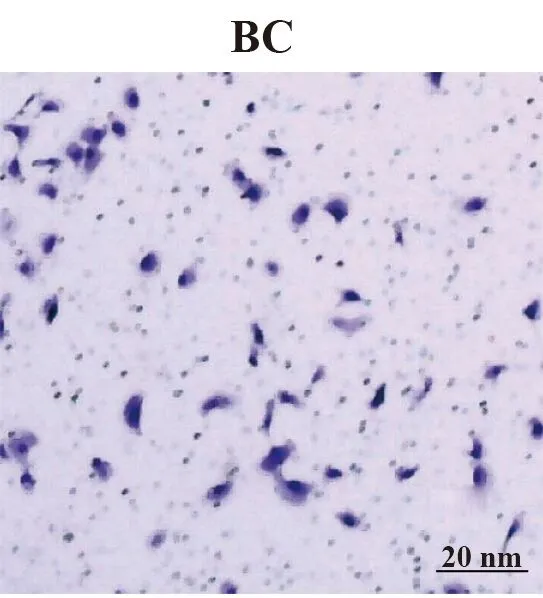
图4 Transwell测定沉默STEAP1对BT549细胞侵袭能力的影响(×400)Fig.4 Transwell to determine effect of silence STEAP1 on invasive ability of BT549 cells (×400)

图5 划痕实验测定过表达STEAP1对BT549细胞迁移能力的影响(×200)Fig.5 Scratch test to determine effect of overexpressed migration ability of BT549 cells (×200)

图6 划痕实验测定沉默STEAP1对BT549细胞迁移能力的影响(×200)Fig.6 Scratch test to determine effect of silence STEAP1 on migration ability of of BT549 cells (×200)
2.4过表达和沉默STEAP1对BT549细胞PCNA、Vimentin、MMP9蛋白水平的影响 与BC组和NC组相比,LV-STEAP1组细胞PCNA、Vimentin、MMP9蛋白水平降低(P<0.05),siR-STEAP1组细胞PCNA、Vimentin、MMP9蛋白水平升高(P<0.05),见表7、图7和表8、图8。
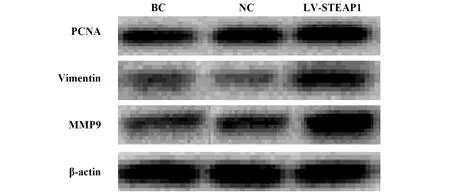
图7 Western blot检测过表达STEAP1对PCNA、Vimentin、MMP9蛋白水平的影响Fig.7 Western blot for effect of overexpressed STEAP1 on PCNA,Vimentin and MMP9 protein levels
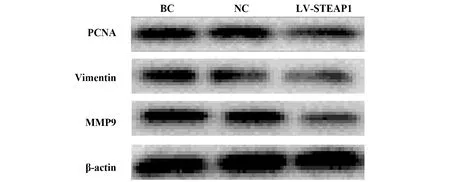
图8 Western blot检测沉默STEAP1对PCNA、Vimentin、MMP9蛋白水平的影响Fig.8 Western blot for effect of silence of STEAP1 on PCNA,Vimentin and MMP9 protein levels
表7 过表达STEAP1对PCNA、Vimentin、MMP9蛋白表达的影响Tab.7 Effect of overexpressed STEAP1 on PCNA,Vimen-tin and MMP9 protein

表8 沉默STEAP1对PCNA、Vimentin、MMP9蛋白表达的影响Tab.8 Effect of silence of STEAP1 on PCNA,Vimentin and MMP9 protein
2.5过表达和沉默STEAP1对BT549细胞Wnt、β-catenin、E-cadherin蛋白水平的影响 与BC组和NC组相比,LV-STEAP1组细胞Wnt、β-catenin蛋白水平降低(P<0.05),E-cadherin蛋白水平升高(P<0.05),siR-STEAP1组细胞Wnt、β-catenin蛋白水平升高(P<0.05),E-cadherin蛋白水平降低(P<0.05),见表9、图9和表10、图10。
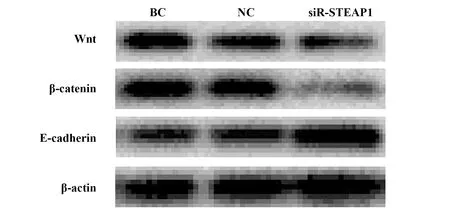
图9 过表达STEAP1对Wnt、β-catenin、E-cadherin蛋白水平的影响Fig.9 Western blot for effect of overexpressed on Wnt,β-catenin and E-cadherin protein levels
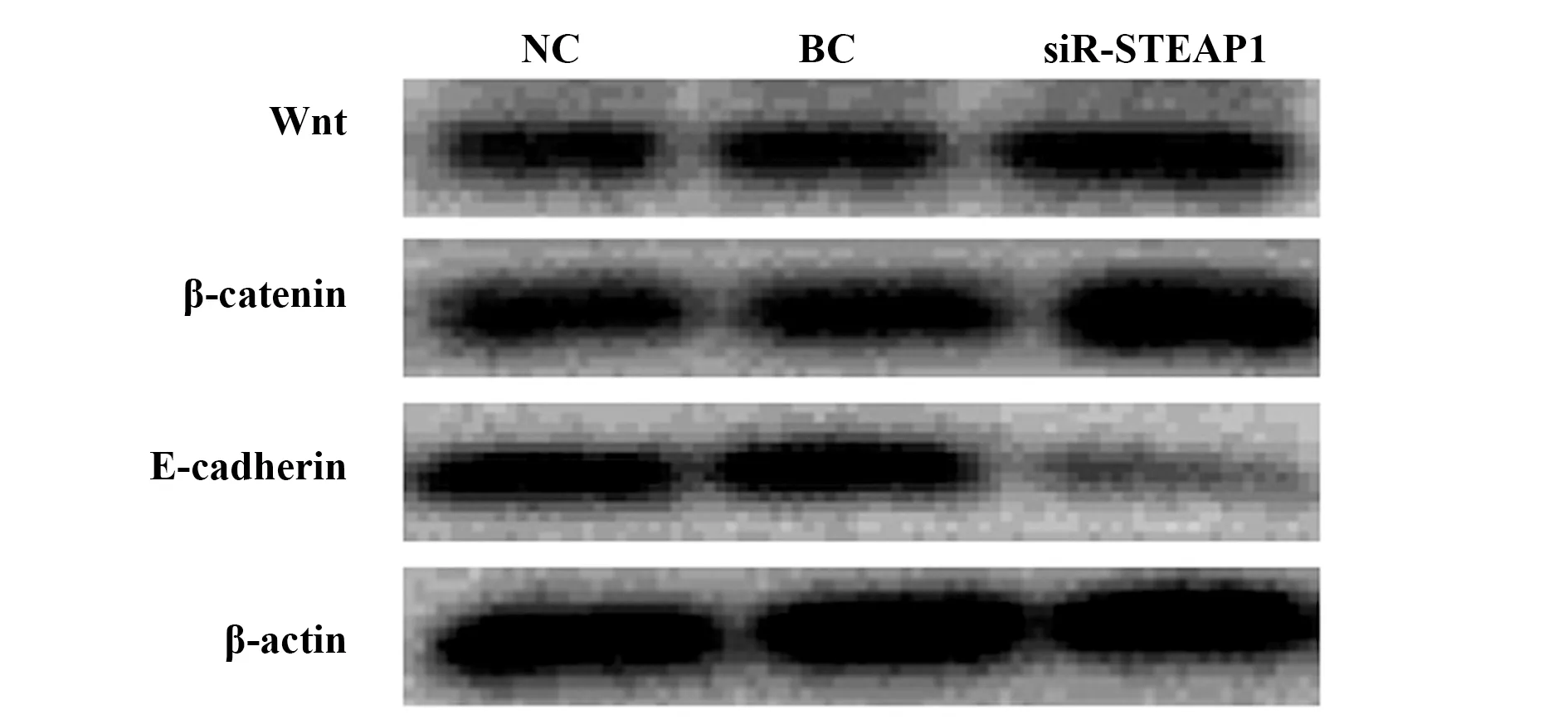
图10 沉默STEAP1表达对Wnt、β-catenin、E-cadherin蛋白水平的影响Fig.10 Western blot for effect of silence of STEAP1 on Wnt,β-catenin and E-cadherin protein levels

表9 过表达STEAP1对Wnt、β-catenin、E-cadherin蛋白水平的影响Tab.9 Effect of overexpressed STEAP1 on Wnt,β-catenin and E-cadherin protein

表10 沉默STEAP1对Wnt、β-catenin、E-cadherin蛋白水平的影响Tab.10 Effect of silence of STEAP1 on Wnt,β-catenin and E-cadherin protein
3 讨论
乳腺癌的发生发展受表观遗传、基因改变及微环境变化等因素影响,癌基因和原癌基因的转变在乳腺癌发生发展中发挥重要作用[5,6]。STEAP1主要位于细胞膜,是细胞表面抗原,在膀胱癌、结肠癌、卵巢癌、前列腺癌等恶性肿瘤中高表达,具有促进肿瘤细胞增殖和侵袭的作用[7-10]。随着研究深入,STEAP1在乳腺癌组织中的表达受到关注。如Xie等[11]研究发现STEAP1在人乳腺癌中的表达低于正常乳腺组织,在乳腺癌MCF-7、BT549等细胞中表达低于正常乳腺上皮细胞,敲低STEAP1表达可增强乳腺癌细胞的侵袭和迁移能力,但不影响乳腺癌细胞增殖,表明STEAP1可能参与乳腺癌发生发展,可能发挥抑癌基因作用。本文对乳腺癌BT549细胞进行研究,发现过表达STEAP1可抑制乳腺癌BT549细胞增殖、侵袭和迁移,沉默STEAP1可促进乳腺癌细胞BT549增殖、侵袭和迁移,表明STEAP1在乳腺癌中可能发挥抑癌基因作用,与既往研究结论一致。但既往研究发现STEAP1对乳腺癌细胞增殖无明显影响,而本文发现STEAP1可抑制乳腺癌细胞增殖,原因可能为研究方法不完全相同,尚需进一步研究。PCNA、Vimentin、MMP9与恶性肿瘤细胞的增殖、侵袭、迁移关系密切,其表达水平下降可抑制恶性肿瘤细胞的增殖、侵袭、迁移[12-14]。本研究发现过表达STEAP1可抑制乳腺癌BT549细胞中PCNA、Vimentin、MMP9蛋白表达,沉默STEAP1可促进乳腺癌BT549细胞中PCNA、Vimentin、MMP9蛋白表达,表明STEAP1可抑制乳腺癌BT549细胞增殖、侵袭和迁移。
侵袭和迁移为乳腺癌的主要特征,乳腺癌转移不仅受细胞遗传特性驱动,还受肿瘤微环境(细胞黏附、血管生成等因素)影响。乳腺癌细胞获得侵袭能力、侵入基底膜是乳腺癌转移的开始,乳腺癌细胞脱离乳腺癌组织后穿透基底膜,向周边浸润生长,并通过淋巴管、血管等输送至靶器官,黏附于靶器官内皮细胞,穿透基底膜进入靶器官间质,并于靶器官生长和增殖,形成乳腺癌细胞转移[15,16]。上皮间质转化(epithelial-mesenchynal transition,EMT)在乳腺癌进展、转移和治疗中发挥重要作用,上皮细胞具有极性,且细胞间连接紧密,可限制细胞移动,在EMT过程中,细胞形状和骨架发生变化,上皮细胞极性丧失,运动性增强,获得间充质细胞特征,增强细胞迁移和侵袭能力[17]。Xie等[11]研究发现敲低STEAP1表达在增强细胞侵袭和迁移能力的同时上调EMT相关基因MMP2、MMP9、MMP13等表达,反之,增强STEAP1表达在显著抑制细胞侵袭和迁移能力的同时降低EMT相关基因表达,表明STEAP1抑制乳腺癌细胞侵袭和迁移与其抑制乳腺癌细胞EMT有关。但STEAP1抑制乳腺癌细胞EMT的机制尚未明确。
Wnt/β-catenin信号通路在恶性肿瘤的增殖和侵袭转移中发挥重要作用,在EMT中也发挥重要作用,阻断Wnt/β-catenin信号通路可抑制乳腺癌EMT,抑制乳腺癌侵袭迁移[18-20]。β-catenin为Wnt/β-catenin信号通路的核心因子,Wnt可抑制β-catenin磷酸化降解,降低β-catenin复合物稳定性,导致细胞质中β-catenin累积,进而转入细胞核,激活Wnt/β-catenin通路,促进下游基因表达。β-catenin在细胞质中与E-cadherin蛋白结合,形成黏附性连接,E-cadherin水平下降可减弱细胞黏附力,提高恶性肿瘤细胞侵袭和迁移[21,22]。本研究发现过表达STEAP1可降低乳腺癌BT549细胞中Wnt、β-catenin蛋白水平,上调E-cadherin蛋白水平,沉默STEAP1可上调乳腺癌BT549细胞Wnt、β-catenin蛋白水平,降低E-cadherin蛋白水平。表明STEAP1可能通过抑制Wnt/β-catenin信号通路降低细胞质β-catenin水平,与E-cadherin蛋白结合减少,导致细胞质中E-cadherin蛋白水平升高,形成细胞间黏附力,抑制乳腺癌细胞侵袭和迁移。
综上所述,STEAP1在乳腺癌中可能发挥抑癌基因作用,上调STEAP1表达可能通过抑制Wnt/β-catenin信号通路活性抑制乳腺癌细胞增殖和侵袭。
