副溶血弧菌TDH快速免疫胶体金检测板的研制①
2020-12-24杨靖亚陆晓帆
杨靖亚 方 艳 陆晓帆 张 建 赵 勇
(上海海洋大学食品学院,农业部水产品贮藏保鲜质量安全风险评估实验室,上海 201306)
副溶血弧菌是革兰氏阴性嗜盐菌,存在于沿海栖息地和河口,是导致日本海产品相关胃肠炎的主要原因[1,2]。副溶血弧菌是人类病原体,可引起胃肠炎、伤口感染和败血症[3]。毒性副溶血弧菌菌株通常产生热稳定的直接溶血素(thermostable direct hemolysin,TDH)和/或TDH相关溶血素(TRH),被认为是物种致病性分子标记[4-7]。TDH可引起Wagatsuma琼脂培养基中称为神奈川现象(Kanagawa phenomenon,KP)的β型溶血,大部分临床分离株均为KP阳性[8,9]。
现已开发了副溶血弧菌的多重PCR检测方法,同时使用物种特异性基因和毒素基因用于毒性特异性检测和非毒性副溶血菌株检测,但灵敏度和特异性不高,经常出现假阳性和假阴性结果[10-14]。因此相继开发了针对TDH的新型检测方法,如质谱-脉冲电泳-PCR连用技术、斑点ELISA方法、CPA-核酸试纸条法,但具有耗时、成本昂贵等缺陷[15-17]。目前急需一种便捷、经济、快速的检测方法以满足市场需求。向辉等[18]研发了新型纳米标记免疫层析技术,但待测样本的前处理较为繁琐。
胶体金试纸条检测法是一项发展迅速的新型检测手段,使用便捷、检测速度、灵敏度高、特异性强,但目前国内对于将胶体金技术用于副溶血弧菌TDH的快速检测鲜有报道[19]。本研究旨在研制针对副溶血弧菌TDH快速检测的快速免疫胶体金检测板,以满足大批量样品快速高效检测的需要。
1 材料与方法
1.1材料 副溶血弧菌(ATCC33846)、沙门氏菌、大肠杆菌、单核细胞增多性李斯特菌(上海海洋大学食品安全实验室惠赠),抗TDH单克隆抗体T6D4、T9H4和毒素TDH(本实验室纯化制备),氯金酸(HAuCl4,Sigma公司),牛血清蛋白、Tween 20 (上海正极生物有限公司),Tris、sucrose (上海生工生物有限公司),Whatman AE99、Pall Vivid 170、Sartorius CN140、Millipore 135 硝酸纤维素膜(上海杰一生物科技有限公司)。
1.2方法
1.2.1制备胶体金溶液 参考文献[20],将待用玻璃器皿洗净、浸泡于5%二氯二甲基硅烷的氯仿溶液中,超纯水冲净干燥。100 ml 0.01% HAuCl4置于恒温磁力搅拌器煮沸,迅速加入1.2 ml新鲜配制的1% 柠檬酸三钠持续加热,不断搅拌至液体颜色转变为酒红色并继续煮沸10 min。待胶体金溶液冷却至室温后补充超纯水至100 ml,收集于棕色玻璃瓶并置于4℃冰箱中备用。
1.2.2胶体金-抗体复合溶液制备 磁力搅拌器室温匀速搅拌60 min,使胶体金溶液中的金颗粒与待标记TDH单克隆抗体T6D4充分吸附平衡,加入10% BSA 0.01 mol/L PBS(pH7.4),封闭处理金颗粒上未结合单克隆抗体的结合位点,使复合物溶液中BSA终浓度为1%,室温匀速继续搅拌60 min,13 000 r/min 离心60 min,去上清,加入2 ml 0.01 mol/L PBS(pH7.4)保存液重悬沉淀,4℃保存备用。
1.2.3胶体金颗粒与待标记抗体的标记试验 选择单克隆抗体T6D4作为捕获抗体与胶体金颗粒标记,制备胶体金-抗体的复合物溶液。加入0.1 mol/L K2CO3调整胶体金溶液pH值,设置pH为 6.0、6.5、7.0、7.5、8.0、8.5、9.0,每试管胶体金溶液中分别加入0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0 μl 1 mg/ml的待标记单克隆抗体T6D4,充分混匀后室温静置30 min,每管添加100 μl 10% NaCl溶液观察溶液颜色,进行pH和抗体标记量优化。
1.2.4金标溶液最佳释放条件的优化 设置不同蔗糖浓度的金标溶液稀释液和不同浓度Tween 20样品垫预处理液。分别为1%、3%、5%蔗糖的1%BSA 0.01 mol/L PBS(pH7.4);含0.5%、1%、2%Tween 20的0.01 mol/L PBS(pH7.4)。
1.2.5假阳性消减试验 选用2 mg/ml浓度羊抗小鼠的抗体包被试纸条上的C线作为质控线;选用2 mg/ml的T9H4单抗包被试纸条上的T线,作为检测线;选用含5% sucrose的1% BSA 0.01 mol/L PBS(pH7.4)溶液以1∶1含稀释金标抗体溶液包被金标垫。为防止假阳性结果,在洗涤液中加入一定量盐离子,分别设置含0.1%、0.2%、0.3%、0.4% NaCl的1% Tween 20 0.01 mol/L PBS(pH7.4)洗涤液,检测空白样本,得到最佳盐离子浓度,进一步优化检测体系。
1.2.6NC膜上检测抗体T9H4的稀释缓冲液及检测浓度的优化 稀释溶液的pH值会对检测结果的显色造成影响,分别选用pH7.0、7.4、8.0的3种0.01 mol/L PBS溶解检测抗体T9H4,点于NC膜上。选定最佳检测抗体溶解液后,分别设置0.5、1.0、1.5 mg/ml浓度的检测抗体T9H4,点于T线,以期寻找出最佳检测浓度。
1.2.7不同型号NC膜的比较 选择Whatman AE99、Pall Vivid 170、Sartorius CN140、Millipore 135硝酸纤维素膜4种硝酸纤维素膜进行组装,检测结果。
1.2.8快速免疫胶体金检测板的组装及使用 试纸条PVC底板用切条机裁剪为8.0 cm×0.5 cm,依次将NC膜、吸水垫、金标结合垫、样品垫黏附于PVC胶板;其中金标结合垫为单克隆抗体T6H4标记的胶体金溶液,NC膜的检测线为单克隆抗体T9H4、质控线C线上采用羊抗小鼠抗体,37℃恒温条件下干燥60 min后组装。
1.2.9快速免疫胶体金检测板的灵敏度检测 在最佳检测体系下分别检测不同稀释度的TDH,分析所制备的快速免疫胶体金检测板的最低检测限。
1.2.10快速免疫胶体金检测板的特异性检测 37℃、180 r/min下,对副溶血弧菌(含TDH)、沙门氏菌、大肠杆菌、单核细胞增多性李斯特菌和非致病性副溶血弧菌F188菌株进行液体增菌摇床培养24 h,8 000 r/min离心10 min,取上清作为阴性检测样本和TDH阳性样本(2 μg/ml)检测结果比对,确定所制备的快速免疫胶体金检测板对TDH检测的特异性。
2 结果
2.1胶体金溶液质量分析 柠檬酸三钠还原法制备溶液,紫外可见分光光度法测定400~700 nm处胶体金溶液吸光度,在527 nm处出现最大吸收峰,对应金颗粒大小约为40 nm,吸收曲线平滑、峰值单一、峰谷较窄,由此推断所制备的40 nm金颗粒大小的胶体金溶液不含杂质,颗粒大小均匀,见图1。
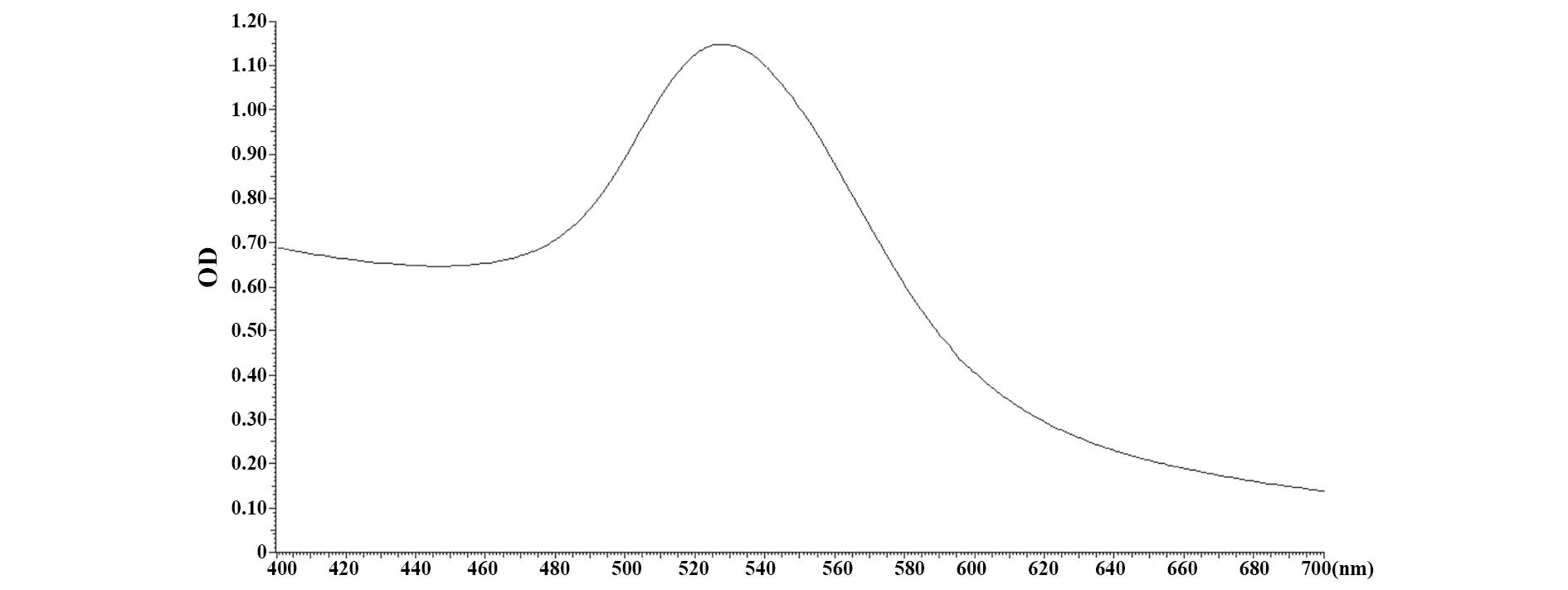
图1 纳米胶体金颗粒的全波长扫描Fig.1 Full wavelength scaning for nanogold
2.2抗体与金颗粒的标记结果 pH=8.0时,抗体T6D4可与40 nm大小的金颗粒稳定结合,即在加入10%NaCl后,溶液平衡不受外界离子破坏,溶液仍保持酒红色,2 μg/ml的金溶液呈抗体最佳结合量,见图2。

图2 最佳抗体标记量分析Fig.2 Analysis of optimal antibody labeling quantity
2.3金标溶液最佳释放条件 8号试纸条的金标垫完全呈白色,表明金标垫上的金标抗体溶液具有高复溶性及强释放率,因此选定样品垫采用含2%Tween 20的0.01 mol/L PBS(pH7.4)处理,金标垫用含3% sucrose 1% BSA 0.01 mol/L PBS(pH7.4)处理,作为初始溶液体系用于后续研究,见图3。

图3 金标溶液的最佳释放条件Fig.3 Best condition on release of gold-labled solutionNote:1.1% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 0.5% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);2.3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 0.5% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);3.5% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 0.5% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);4.1% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 1% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);5.3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 1% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);6.5% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 1% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);7.1% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 2% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);8.3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 2% Tween 20 0.01 mol/L pH7.4 PBS (sample pad);9.5% sucrose 1%BSA 0.01 mol/L pH7.4 PBS (gold-labled pad) and 2% Tween 20 0.01 mol/L pH7.4 PBS (sample pad).
2.4假阳性消减试验分析 NaCl含量为0.1%~0.4%时假阳性结果的消减呈现剂量依赖性。
2.5NC膜上检测抗体T9H4的稀释缓冲液及最适检测浓度的确定 以1 μg/ml的TDH阳性样本进行检测,当选用pH7.4时的0.01 mol/L PBS作为T9H4的包被溶液时,显色性较好。在选定最佳检测抗体包被液后,以1 μg/ml的TDH阳性样本进行检测,当包被浓度达到1 mg/ml后,结果显色性基本保持不变,均呈现良好的阳性结果,因此最终选定最佳T线抗体包被浓度为1 mg/ml,见图4。

图4 快速免疫胶体金检测板最低检测限分析Fig.4 Analysis of minimum detection limit of immunochromatographic test strips
2.6NC膜型号的选择 对于同样检测500 ng/ml的TDH阳性样本,4款膜的阳性结果显色效果中,Sartorius CN140表现最佳且检测结果重复性好,虽然Sartorius CN140的跑水速度较慢,但金标抗体溶液在膜上的跑动效果最好。因此,选定Sartorius CN140硝酸纤维素膜作为本次实验的胶体金检测板,见图5。

图5 快速免疫胶体金检测板的特异性分析Fig.5 Specificity analysis of immunochromatographic test stripNote:A.E.coli;B.Salmonella;C.Listeria monocytogenes;D.F188;E.ATCC33846(TDH).
3 讨论
研究表明TDH具有呈剂量和时间依赖性的肝毒性和非常迅速的致死效应[21,22]。快速便捷地进行TDH检测对于预防和监控TDH相关疾病具有重要意义。传统TDH检测技术包括常规分离培养、电化学法等,但检测时间较长、特异性较差。PCR检测需要昂贵的检测仪器以及专业的操作人员。随着检测方法的不断深入,近年来更多的学者倾向于利用免疫效应开发新型检测手段[23,24]。
本实验利用2株TDH单克隆抗体成功地制备了能够特异性检测副溶血弧菌TDH的快速免疫胶体金检测板,样品垫采用2% Tween 20 0.01 mol/L pH7.4 PBS处理、金标垫采用3% sucrose 1%BSA 0.01 mol/L pH7.4 PBS处理,所得金标抗体溶液复溶性高,释放率强。选用pH7.4时的0.01 mol/L PBS作为T9H4的包被溶液时,显色性较好,确定最佳T线抗体包被浓度为1 mg/ml。人工组装的快速免疫胶体金检测板检测限为500 ng/ml,且具有较强特异性。
目前国内对于将胶体金技术用于副溶血弧菌TDH的快速检测鲜有报道,本实验所得的快速免疫胶体金检测板显著降低了样品的前处理要求,可在5 min 内完成检测,显著缩短了检测时间,本研究为副溶血弧菌TDH的现场、快速、简单、无需设备的检测提供了新的手段。
