趋化因子CXCL5通过调控ERK/MAPK信号通路抑制肿瘤免疫促进鼻咽癌恶化的机制研究①
2020-12-24谭爱丽
阮 鹏 谭爱丽
(武汉大学人民医院肿瘤科,武汉 430060)
鼻咽癌(nasopharyngeal carcinoma,NPC)是耳鼻咽喉恶性肿瘤的主要癌种和病死原因,70%的患者被确诊时已是晚期[1,2]。随着我国人口老龄化不断加快,NPC的发病率与死亡率可能还将不断上升,由此带来的癌症负担也将持续增长[1,3]。目前,NPC的治疗仍以放化疗为主,远处转移是治疗失败的主要原因[4]。肿瘤免疫已成为近年肿瘤研究的热点之一,越来越多的研究表明免疫治疗在肿瘤中有着广阔前景[5,6]。肿瘤的免疫治疗利用肿瘤的免疫学特性改变机体的抗肿瘤免疫应答水平,进而杀伤与抑制肿瘤[7]。研究证实,多种细胞因子在肿瘤免疫中发挥作用,已被用于肿瘤的免疫治疗[8]。
趋化因子是指能使细胞发生趋化运动的细胞因子,不仅参与了免疫反应,也是肿瘤发生发展的重要调节因子[9]。CXC趋化因子配体-5(CXC chemokine ligand-5,CXCL5)是CXC趋化因子的家族成员[10]。CXCL5可通过与其特异性受体CXCR2结合介导一系列生物学效应进而促进肿瘤的生长、浸润和转移[11]。报道指出,CXCL5在多种肿瘤组织中的表达高于正常组织[12-15]。而针对CXCL5在NPC中的作用尚无报道,本次研究的目的是探讨CXCL5在NPC中的作用及其潜在的分子机制。
1 资料与方法
1.1资料
1.1.1临床资料 本次研究共纳入2017年6月~2019年2月我院收治的98例NPC患者作为研究对象;其中男性59例,女性39例;年龄26~63岁,平均年龄(43.7±12.4)岁。参照中华医学会头颈外科学分会制定的NPC诊断标准对所有患者进行诊断,所有患者均经病理活检或术后病理学确诊,均未进行过任何治疗。所有患者的TNM分期:Ⅰ期9例、Ⅱ期24例、Ⅲ期41例、Ⅳ期24例;病理学分型:Ⅰ型5例、Ⅱ型11例、Ⅲ型82例。排除标准:①近期或长期服用影响机体免疫药物的患者;②有放化疗史的患者;③复发性NPC患者;④并发其他肿瘤患者;⑤临床资料不全的患者;⑥伴有严重心肝肾功能障碍的患者;⑦伴有全身感染性疾病的患者;⑧长期营养不良患者;⑨妊娠期或哺乳期女性。另选取38例同期在我院进行体检的健康志愿者作为对照,其中男性24例,女性14例;年龄29~67岁,平均年龄(46.1±17.3)岁。两组患者的性别、年龄相比差异无统计学意义(P>0.05),具有可比性。本研究获得医院伦理委员会批准,所有患者均签署知情同意书。
1.1.2实验动物与主要试剂 人CXCL5 ELISA试剂盒(美国R&D Systems);重组人CXCL5蛋白(武汉艾美捷科技有限公司);CXCL5抗体、p-AKT抗体、AKT抗体、p-ERK1/2抗体、ERK1/2抗体、p-MAPK抗体、MAPK抗体、p-NF-κB抗体、NF-κB抗体(美国Santa Cruz公司);p-PI3K抗体、PI3K抗体、β-actin抗体(美国Abcam公司);ERK/MAPK信号通路特异性抑制剂SCH772984(美国Selleckchem公司);流式抗体包括:APC标记的CD4抗体、FITC标记的CD8抗体、PE标记的CD16抗体、FITC标记的CD56抗体(美国BioLegend公司);DMEM培养基、胎牛血清(FBS)(美国Gibco公司);青霉素、链霉素(美国Sigma公司);Lipofectamine®2000转染试剂(Thermo Fisher);小鼠淋巴细胞分离液(天津灏洋生物制品科技有限公司);SDS-PAGE试剂(上海碧云天生物技术有限公司);BALB/c小鼠及CNE-2细胞购自武汉大学实验动物中心。
1.1.3主要设备 CO2培养箱、超净工作台、流式细胞仪、Bio-Rad垂直电泳仪、Western blot化学发光成像系统购自Bio-Rad公司。
1.2方法
1.2.1ELISA 抽取NPC患者和健康志愿者清晨空腹静脉血10 ml,置于促凝管中,自然凝固后将样品1 000 g离心20 min之后进行直接检测或于-80℃储存待检。按照产品说明书,使用CXCL5 ELISA试剂盒检测患者的血清CXCL5水平,采用Tecan酶标仪进行测量。
1.2.2细胞处理 构建pLenti-CMV-CXCL5过表达质粒,采用Lipofectamine®2000转染293T细胞包装慢病毒,慢病毒感染CNE-2细胞后用嘌呤霉素筛选稳定表达CXCL5的CNE-2细胞。用Western blot检测对照与稳定表达CXCL5的CNE-2细胞中PI3K/AKT、ERK/MAPK及NF-κB信号通路的表达水平。
1.2.3Western blot 研磨NPC患者肿瘤及癌旁正常组织或小鼠肿瘤组织,采用RIPA裂解液(含cocktail蛋白酶抑制剂)进行裂解提取总蛋白,用BCA试剂盒测定蛋白浓度。配置12%的分离胶和5%的浓缩胶,每孔上样80~120 μg蛋白进行SDS-PAGE电泳,转至PVDF膜。经5%BSA封闭后,分别加入CXCL5抗体、p-AKT抗体、p-ERK1/2抗体、p-MAPK抗体、p-PI3K抗体、p-NF-κB抗体(1∶1 000);AKT抗体、ERK1/2抗体、MAPK抗体、PI3K抗体、NF-κB抗体(1∶2 000);β-actin抗体(1∶5 000),4℃孵育过夜,经洗涤,加入二抗(1∶5 000)孵育,洗涤,DBA显色。
1.2.4免疫组化染色 每例患者和健康志愿者各取1块活检标本并用10%甲醛溶液固定过夜后石蜡包埋。采用SP法检测组织CXCL5、CXCR2或p-ERK1/2的水平。将所有石蜡切片常规脱蜡至水,0.01 mol/L枸橼酸缓冲液(pH6.0)高压锅抗原热修复,加3%H2O2室温避光孵育30 min,PBS洗涤5 min×3次。用10%正常非免疫羊血清37℃孵育60 min,滴加CXCL5或p-ERK1/2一抗工作液,4℃过夜,PBS洗5 min×3次。滴加二抗工作液,37℃孵育60 min,PBS洗5 min×3次。滴加辣根过氧化物酶标记的链霉卵白素,37℃孵育60 min,PBS洗5 min×3次。DAB显色、苏木素复染、脱水、二甲苯透明、中性树胶封片。显微镜下每个切片随机选取5个视野进行拍照。计算阳性染色的平均光密度。
1.2.5小鼠模型的建立 取对数期生长的对照与稳定表达CXCL5的CNE-2鼻咽癌细胞,胰酶消化,1 000 r/min 离心5 min,计数后调整细胞浓度至1.0×107个/ml的单细胞悬液,无菌条件下接种于小鼠左前肢腋窝结合部皮下,0.1 ml/只。接种后每隔1 d观察一次小鼠,连续观察60 d,观察时记录小鼠的肿瘤大小和死亡情况。绘制小鼠的肿瘤生长与生存曲线。IHC与Western blot分析各组小鼠肿瘤组织中CXCL5与p-ERK1/2的表达水平。流式细胞术检测各组小鼠甲状腺癌组织中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞数量。
1.2.6流式细胞术检测 取新鲜小鼠鼻咽癌肿瘤组织,RPMI1640培养基中消化过夜后进行研磨,经不锈钢网过网,制成单细胞悬液,将细胞悬液加入离心管,根据说明书加入适当比例的待测抗体(CD4、CD8、CD56或CD16),混匀后室温避光孵育30 min。1 500 r/min离心5 min,弃上清。加PBS洗5 min×3次,弃上清。加0.5 ml PBS重悬细胞,混匀上流式细胞仪检测。
1.2.7NK细胞活性检测 根据产品说明书分离BALB/c小鼠的PBMC。将分离的PBMC进行体外培养,分别用重组CXCL5与ERK/MAPK抑制剂SCH77298处理。计数细胞,按2×105个/孔铺于96孔板中。将CNE-2细胞作为靶细胞,按效应细胞∶靶细胞=50∶1加入靶细胞,并设效应细胞和靶细胞对照,每孔总液量200 μl,于培养箱中孵育4 h后弃去100 μl上清,加入15 μl MTT再孵育4 h,每孔加100 μl MTT溶解液培养箱孵育8 h,酶标仪测570 nm OD值(参考波长630 nm)。根据以下公式计算:NK细胞活性=[靶细胞对照孔OD-(反应孔OD-效应细胞对照孔OD)]/靶细胞对照孔OD。

2 结果
2.1患者的基本信息 研究初期共纳入123例NPC患者,其中7例近期或长期服用影响机体免疫药物;5例有放化疗史;5例为复发性鼻咽癌;2例并发其他肿瘤;2例临床资料不全;1例伴有严重心肝肾功能障碍;1例伴有全身感染性疾病;1例长期营养不良;1例妊娠期女性。
2.2NPC患者血清及组织CXCL5水平分析 ELISA结果显示,NPC患者的血清CXCL5水平显著高于健康志愿者[(247.9±23.6)ng/L vs(144.8±14.7)ng/L,P<0.05]。IHC与Western blot结果显示,NPC患者肿瘤组织中CXCL5与CXCR2的水平均显著高于癌旁正常组织(P<0.05),见图1。
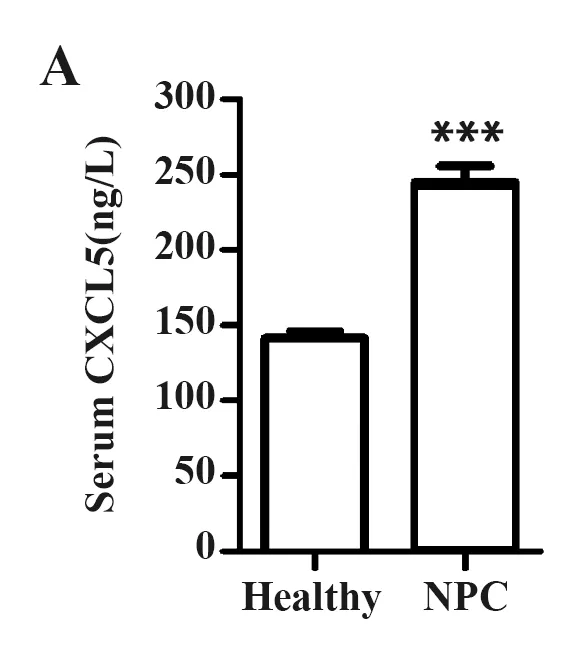
图1 NPC患者血清及癌组织CXCL5水平Fig.1 Expression of CXCL5 in serum and tumor tissue of NPC patientsNote:A.ELISA analysis;B.IHC staining result (×20);C.Western blot of 8 NPC patients.***.P<0.001 vs Healthy Normal.
2.3肿瘤CXCL5水平与临床特征的关系 根据患者肿瘤组织中CXCL5的表达水平,以所有患者的平均光密度值为界限将所有患者分为CXCL5低表达组(CXCL5Low)与CXCL5高表达组(CXCL5High)。CXCL5低表达组55例,CXCL5高表达组43例。NPC患者中CXCL5高表达与CXCL5低表达组的年龄、性别、原发肿瘤范围与病理学分型相比差异无统计学意义(P>0.05)。CXCL5高表达组患者的TNM分期、淋巴结转移和远处转移的发生率均显著高于CXCL5低表达组(P<0.05),见表1。
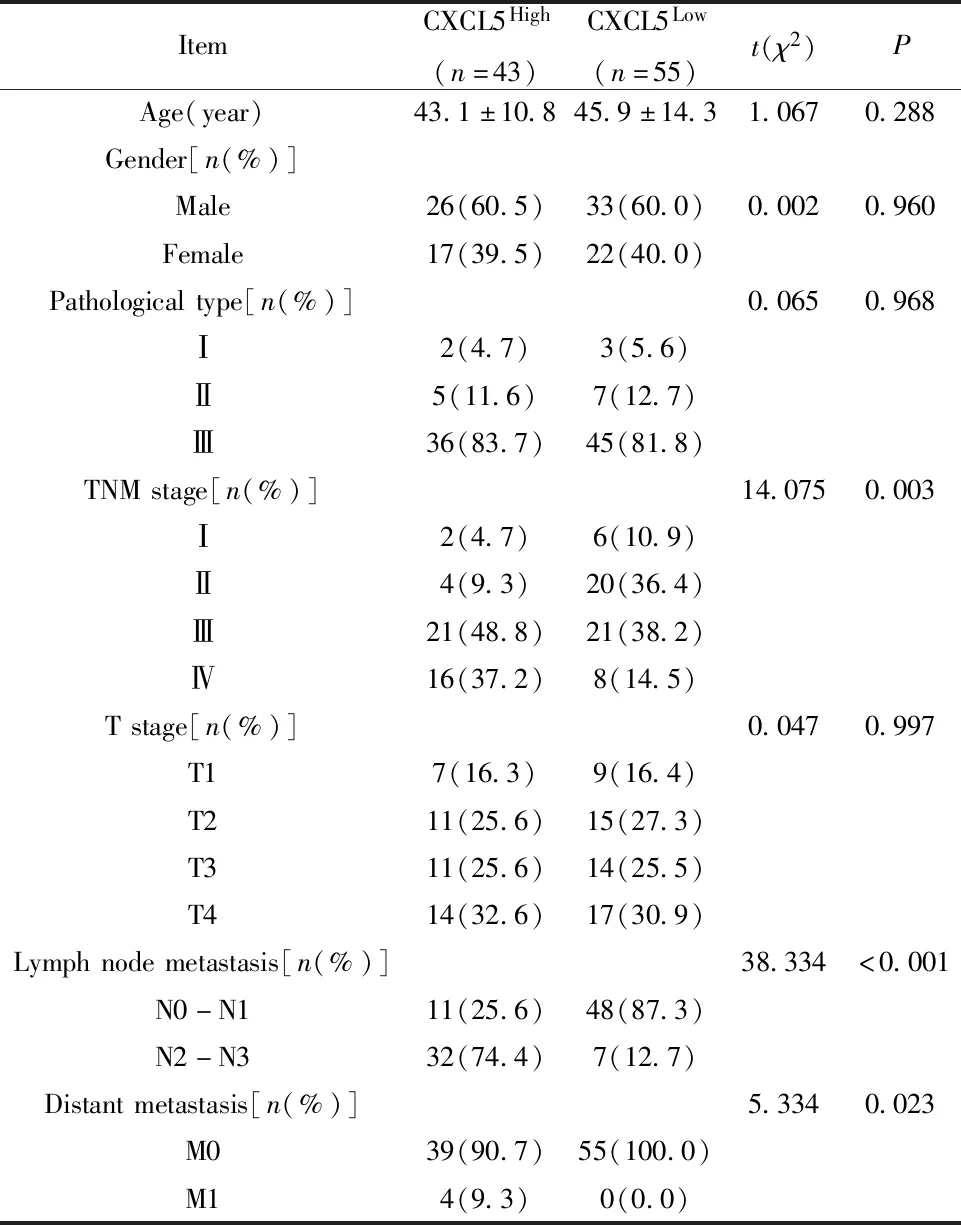
表1 肿瘤组织CXCL5与临床特征的关系Tab.1 Relation between level of CXCL5 in tumor tissues and clinical characteristics
2.4CXCL5对NPC细胞信号通路的影响 Western blot显示CXCL5过表达与重组CXCL5蛋白(rCXCL5)处理能显著提高CNE-2细胞p-ERK1/2与p-MAPK的表达水平,而不影响p-PI3K、p-AKT与p-NF-κB的表达提高,见图2。
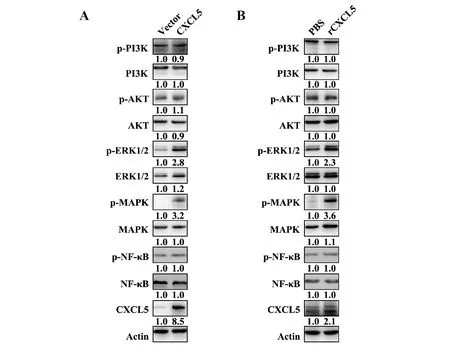
图2 CXCL5对NPC细胞信号通路的影响Fig.2 Effect of CXCL5 on signal pathways of NPC cellsNote:A.Effect of CXCL5 overexpression on PI3K/AKT,ERK/MAPK and NF-κB signals of CNE-2 cells;B.Effect of rCXCL5 (100 ng/ml) on PI3K/AKT,ERK/MAPK and NF-κB signals of CNE-2 cells.
2.5小鼠模型的建立与分析 CXCL5过表达组小鼠的肿瘤生长曲线与生存曲线与对照组小鼠具有显著差异(P<0.05)。Western blot结果显示过表达CXCL5组小鼠肿瘤组织CXCL5与p-ERK1/2的表达水平均显著高于对照组小鼠。流式分析显示过表达CXCL5组小鼠肿瘤组织中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞数量均显著低于对照组小鼠(P<0.05),见图3。

图3 小鼠模型分析Fig.3 Mice model analysisNote:A.Photographic illustration of tumors from mice;B.Tumor growth curve of mice;C.Survival curve of mice;D.Expression level of CXCL5 and p-ERK1/2 in mice tumor tissue;E.Flow cytometry analysis of CD4+ T and CD8+ T cells in mice tumor tissue;F.Flow cytometry analysis of CD56+CD16+ NK cells in mice tumor tissue.***.P<0.001 vs vector.
2.6CXCL5对NK细胞活性的影响 分离正常BALB/c小鼠PBMC,分别用rCXCL5与SCH772984处理。rCXCL5能显著降低PBMC中NK细胞的活性,而不影响ERK/MAPK信号通路抑制剂SCH772984预处理的PBMC中NK细胞的活性(P>0.05),见图4。
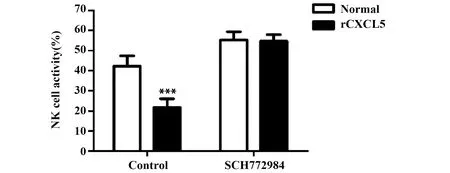
图4 rCXCL5对PBMC中NK细胞活性的影响Fig.4 Effect of rCXCL5 on activity of NK cells in PBMCNote:***.P<0.001 vs Normal.
3 讨论
NPC的浸润性高、侵袭性强,临床上以放射治疗为主要治疗策略[1,4]。近年来,随着放疗技术的进步与综合治疗的进展,NPC的疗效有所提高[2,4]。早期NPC患者的疗效尚可,5年生存率可达80%以上[2]。然而,由于鼻腔位置隐蔽,且临床症状表现多样,约75%的患者确诊时已是中晚期,其5年生存率不到50%[2,4]。针对这类患者,临床多采用放疗、化疗与分子靶向相结合的综合治疗策略[4]。随着研究的不断深入,已经发现许多基因与鼻咽癌的发生、发展、局部淋巴转移等密切相关[2]。分子靶向治疗,如靶向表皮生长因子受体、血管生成抑制剂与环氧化酶(COX)-2抑制剂的治疗已逐步应用于临床并取得一定的进展[2,4]。而NPC的发病机制尚未被完全阐明。因此,进一步探讨NPC的发病机制,寻找新的治疗靶点至关重要。本研究旨在探讨趋化因子CXCL5通过抑制肿瘤免疫促进NPC的作用,并研究其潜在的分子机制。
CXCL5又名上皮来源的中性粒细胞活化肽78(ENA-78),可通过ELR功能区与其特异性受体CXCR2结合,进而促进血管新生,介导肿瘤的生长、浸润和转移[12,16]。近年来,CXCL5在肿瘤中的作用逐渐引起人们的关注。研究指出,CXCL5在肝癌、胃癌、前列腺癌、非小细胞肺癌等肿瘤组织中的表达显著升高,CXCL5可促进胃癌与非小细胞肺癌等肿瘤的发生、发展与转移[12-15]。而针对CXCL5在鼻咽癌中的作用尚无人报道,本研究结果显示,NPC患者的血清与肿瘤组织中的CXCL5水平均出现显著升高,且过表达CXCL5组小鼠的生存曲线和移植瘤生长曲线均显著差于对照组小鼠,提示CXCL5及其受体CXCR2可能参与了鼻咽癌的发生与发展机制。
研究指出,鼻咽癌肿瘤组织中的p-ERK1/2水平显著高于正常组织,ERK/MAPK信号通路的持续激活可能参与了NPC的发生与发展过程[17,18]。本研究显示,重组CXCL5蛋白能显著增加CNE-2细胞p-ERK1/2与p-MAPK的表达水平,而不影响p-PI3K、p-AKT与p-NF-κB的表达水平,提示CXCL5可能通过ERK/MAPK信号通路发挥促NPC的作用。
近年来,免疫治疗已经成为肿瘤学的一个热门研究方向[5]。目前免疫治疗已在黑色素瘤、淋巴瘤等的治疗中取得良好疗效[6]。针对NPC的免疫治疗主要有肿瘤疫苗、免疫节点抑制剂及过继性免疫治疗等[19]。本研究显示,过表达CXCL5组小鼠肿瘤组织中CD4+T细胞、CD8+T细胞与CD56+CD16+NK细胞数量均显著低于对照组小鼠。且重组CXCL5处理能显著降低小鼠PBMC中NK细胞的活性,而不影响ERK/MAPK信号通路抑制剂SCH772984预处理的PBMC中NK细胞的活性。因此,CXCL5可能通过ERK/MAPK信号通路发挥抑制NPC肿瘤免疫的作用。
综上所述,NPC患者血清及肿瘤组织中CXCL5表达水平均显著增高,CXCL5可能通过调控ERK/MAPK信号通路抑制CD4+T细胞、CD8+T细胞和NK细胞的活性进而发挥促进鼻咽癌的作用。
