黄芩苷激活胆碱能抗炎途径改善脂多糖诱发的子痫前期大鼠症状
2020-12-24李亚梅王燕侠
李亚梅 王燕侠
(甘肃省妇幼保健院科研中心,复发性流产诊所,兰州 730000)
子痫前期(preeclampsia,PE)是一种在妊娠20周以后出现高血压、蛋白尿等症状的多系统疾病。PE在孕妇中的发生率约为2%~8%,是导致早产、新生儿和产妇死亡的主要原因[1]。然而,对PE的治疗仍然是一个挑战,目前尚缺乏对其的有效治疗方法[2]。正常妊娠会引起轻度的全身炎症反应,而PE与过度的炎症反应相关[3]。来自动物和人类研究的数据显示,炎症介质在PE的发病机制中发挥重要作用[4]。临床研究表明,PE妇女比正常血压妇女表现出更高的血清和胎盘促炎辅助性Th1细胞因子水平[5]。此外,研究表明母体通过核因子κB(nuclear factor κB,NF-κB)激活免疫细胞是炎症的关键调节途径[6]。
越来越多的证据表明,迷走神经可以有效调节炎症反应,迷走神经被称为胆碱能或烟碱类抗炎途径[7-9]。α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)在该调节途径中起关键作用[10]。黄芩苷是一种中药,具有多种抗炎和抗凋亡的潜在生物学功能[11,12]。然而,目前尚无文献报道黄芩苷对PE大鼠胆碱能抗炎途径的调节作用。本文主要研究黄芩苷对PE大鼠的影响及其对胆碱能抗炎途径的调控作用。
1 材料与方法
1.1材料
1.1.1实验动物 本研究已获得伦理委员会批准,伦理审查批件(FJ/04-IRB/C/018-V3.0),严格按照实验动物的护理和使用原则进行。70只8~10周龄雌性SD大鼠,体质量200~240 g购自上海中医药大学实验动物中心。大鼠饲养温度23~26℃,相对湿度50%~60%,上午6:00~下午18:00之间给予光照,标准饲料喂养并自由饮水。将雌性大鼠与可育的雄性大鼠交配过夜。阳性的阴道涂片确定为妊娠的第0天(gestation day 0,GD 0)。大鼠阴道分泌物涂片如图1所示。

图1 大鼠阴道分泌物中的精子Fig.1 Sperm in vaginal secretion of rats
1.1.2主要试剂与仪器 黄芩苷(baicalin,Bai)和LPS购自美国Sigma-Aldrich公司;胆碱能拮抗剂α-bungarotoxin购自德国merck millipore公司;TNF-α、IL-1β、IL-6的Bio-Plex Pro Rat Cytokine 8-Plex Panel Luminex试剂盒购自美国Bio-Rad公司;RNeasy mini试剂盒、Quantitect反转录试剂盒、QuantiFast SYBR Green PCR Kit购自德国Qiagen公司;α7nAChR的大鼠单克隆抗体、山羊抗大鼠二抗购自美国Abcam公司。分光光度计、ECL化学发光系统购自美国Thermo Scientifc公司;LightCycler480Ⅱ实时荧光定量PCR系统购自美国罗氏公司。
1.2方法
1.2.1分组与建模 70只SD大鼠随机平均分为7组:未妊娠组(NP)、妊娠组(P)、妊娠+黄芩苷组(P+Bai)、妊娠+α-bungarotoxin组(P+α-bun)、子痫前期组(PE)、子痫前期+黄芩苷组(PE+Bai)和子痫前期+α-bungarotoxin +黄芩苷组(PE+α-bun+Bai)。参考文献[13]所述方法,在GD 14时,将2 ml的LPS(1 mg/kg)无菌盐水溶液通过输液泵注入大鼠尾静脉 (输注速度为2 ml/h) 来诱导实验性PE大鼠模型。GD 14~GD 19时,P+Bai组、 PE+Bai组和PE+α-bun+Bai 组大鼠腹腔注射100 mg/kg·d的黄芩苷。在黄芩苷注射前30 min分别对P+α-bun组和PE+α-bun+Bai组大鼠腹腔注射1 mg/kg·d的α-bungarotoxin。对照组大鼠在相同的时间注射等体积的生理盐水溶液(0.9%NaCl)。
1.2.2收缩压(systolic blood pressure,SBP)的测定 使用美国KENT公司CODA系列动物无创血压测定系统通过容量压力记录法(VPR)在GD 6、11、14(LPS输注前)、16和18(上午9:00~12:00)时测定大鼠SBP。每只大鼠进行3次测定并记录平均值。
1.2.3尿白蛋白的测定 在GD 7、12、17和19时,将大鼠放在单独的代谢笼中24 h以获取尿液样本。尿液样品在室温下2 000 r/min离心15 min,并将上清液保存在20℃下用于后续的蛋白质水平分析。使用全自动生化分析仪测定尿蛋白浓度。在GD 20时,将大鼠麻醉,从下腔静脉获取血液样本。取出胎鼠和胎盘并称重。所有样品均储存于-80℃冰箱。
1.2.4Luminex检测 60 mg胎盘组织于600 ml RIPA裂解缓冲液中匀浆并制备裂解物。试剂盒测定细胞因子TNF-α、IL-1β和IL-6水平。根据说明书,以Luminex 200系统和Bioplex HTF进行多次测定。使用Bio-Plex Manager 5.0软件进行数据分析,并以浓度pg/(ml·mg)表示。
1.2.5RT-qPCR 研磨胎盘组织,RNeasy mini试剂盒提取总RNA。分光光度计测定RNA浓度。Quantitect反转录试剂盒将RNA(500 ng)反转录为cDNA。QuantiFast SYBR Green PCR Kit进行RT-qPCR实验。引物序列如下:α7nAChR 5′-CTCACAGCATGCAATCCAAGTACACTA-3′(F),5′-CAGGACCGAAGGCTAAAAGAGCA-3′(R)。β-actin 5′-CCGGAGCTTCACCAATTGACACA-3′(F),5′-CAGACGCAGGAGCAGTTAATCA-3′(R)。 以β-actin为内参。反应程序如下:95℃ 5 min预变性,95℃ 10 s变性,60℃ 30 s退火/延伸,40个循环。使用2-ΔΔCt方法进行数据分析。
1.2.6Western blot分析 从胎盘中提取蛋白质样品。将样品煮沸5 min,冰上冷却,经12% SDS-PAGE后转移至硝酸纤维素膜。于Tris缓冲盐水Tween 20中用5%脱脂牛奶封闭后,以抗α7nAChR的大鼠单克隆抗体(1:500稀释度)4℃过夜孵育。将膜在含0.05%Tween 20的PBS溶液中洗涤3次,每次5 min。将膜与辣根过氧化物酶(HRP)标记的山羊抗大鼠二抗(稀释度为1∶3 000)于37℃孵育1 h,将膜在含0.05%Tween 20的PBS溶液中洗涤3次,每次5 min。通过ECL化学发光系统显影。以β-actin为内参。
1.2.7免疫组织化学测定 将大鼠胎盘组织固定于中性福尔马林,石蜡包埋并制作3 μm厚切片,将切片微波处理以进行抗原修复,并用0.3%H2O2进行预处理,随后将切片与山羊血清和含有兔抗NF-κBp65抗体的一抗共同4℃孵育过夜。使用HRP标记的二抗37℃下孵育1 h,并用苏木精复染,在光学显微镜下观察组织。 NF-κB活化程度表示为核NF-κBp65阳性细胞占胎盘细胞总数的百分比。

2 结果
2.1黄芩苷降低了PE大鼠的SBP 如图2所示,与NP组大鼠相比,PE组大鼠在GD 16和18时SBP显著升高(P<0.05)。用黄芩苷治疗的PE+Bai组大鼠的SBP明显低于PE组大鼠(P<0.05)。然而,PE+α-bun+Bai组大鼠的SBP值明显高于PE+Bai组(P<0.05)。GD 6、GD 11和GD 14时各组SBP水平差异无统计学意义。

图2 各组大鼠的SBP变化Fig.2 SBP changes of rats in each groupNote:Compared with NP group,*.P<0.05; compared with PE group,#.P<0.05; compared with PE+Bai group,&.P<0.05.
2.2黄芩苷改善了PE大鼠的尿白蛋白水平 如图3所示,与NP组大鼠相比,PE组大鼠在GD 17和GD 19时的平均24 h尿白蛋白水平显著升高(P<0.05)。与PE组相比,PE+Bai组大鼠在GD 17和GD 19时的平均24 h尿白蛋白水平显著降低(P<0.05)。与PE+Bai组相比,PE+α-bun+Bai组大鼠在GD 17和GD 19时的平均24 h尿白蛋白水平显著升高(P<0.05)。
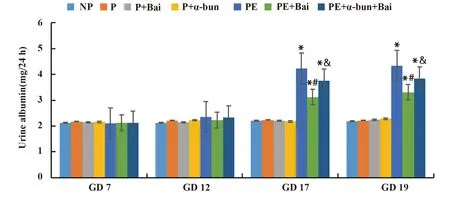
图3 各组大鼠的尿白蛋白变化Fig.3 Urine albumin changes of rats in each groupNote:Compared with NP group,*.P<0.05; compared with PE group,#.P<0.05; compared with PE+Bai group,&.P<0.05.
2.3黄芩苷降低了PE大鼠胎盘中的促炎细胞因子水平 如图4所示,与NP组大鼠相比,P+α-bun组和PE组大鼠胎盘中细胞因子TNF-α、IL-1β和IL-6水平显著升高(P<0.05)。与PE组相比,PE+Bai组大鼠胎盘中TNF-α、IL-1β和IL-6水平显著降低(P<0.05)。与PE+Bai组相比,PE+α-bun+Bai组大鼠胎盘中TNF-α、IL-1β和IL-6的水平显著升高(P<0.05)。
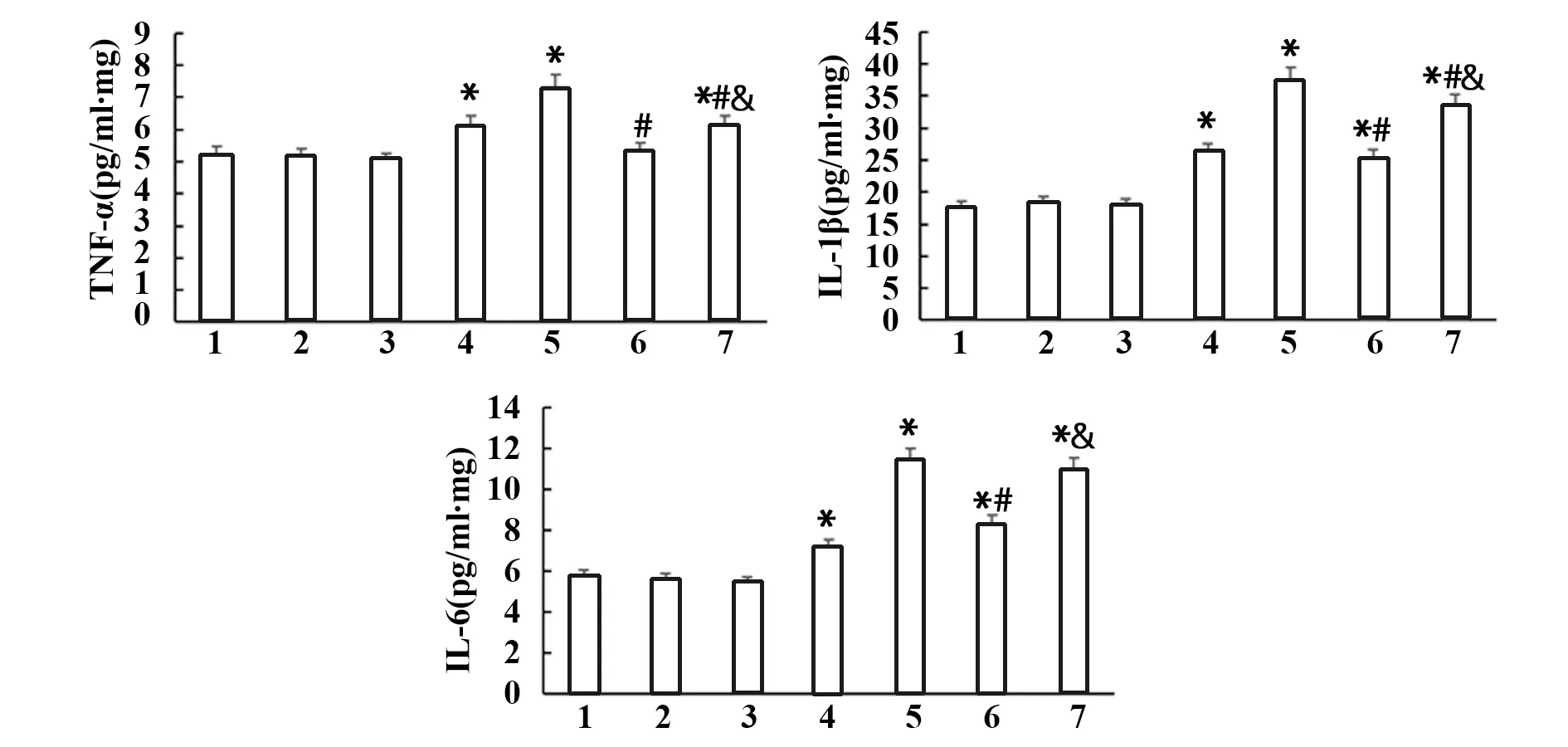
图4 各组大鼠胎盘中细胞因子TNF-α、IL-1β和IL-6的水平Fig.4 Levels of cytokines TNF-α,IL-1β and IL-6 in placenta of rats in each groupNote:1.NP;2.P;3.P+Bai;4.P+α-bun;5.PE;6.PE-Bai;7.PE+α-bun+Bai;compared with NP group,*.P<0.05; compared with PE group,#.P<0.05; compared with PE+Bai group,&.P<0.05.
2.4黄芩苷增加了PE大鼠胎盘中α7nAChR表达 RT-qPCR结果显示(图5),与NP组大鼠相比,PE+Bai组大鼠胎盘中α7nAChR的mRNA和蛋白表达水平显著升高(P<0.05)。与NP组大鼠相比,PE组大鼠胎盘中α7nAChR的mRNA表达水平显著升高(P<0.05),而蛋白表达水平无显著变化(P>0.05)。与PE组相比,PE+Bai组大鼠胎盘中α7nAChR的mRNA和蛋白表达水平升高(P<0.05)。与PE+Bai组相比,PE+α-bun+Bai组大鼠胎盘中α7nAChR的mRNA和蛋白表达水平显著降低(P<0.05)。
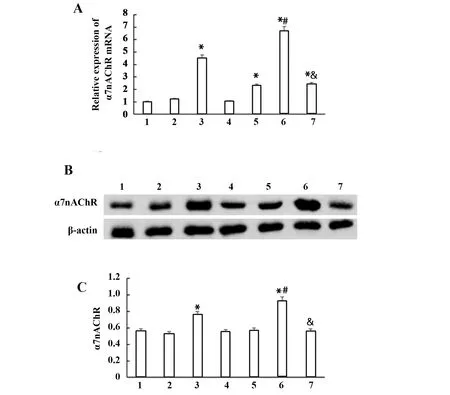
图5 各组大鼠胎盘中α7nAChR mRNA和蛋白的表达Fig.5 α7nAChR mRNA and protein expressions in plac-enta of each group of ratsNote:1.NP;2.P;3.P+Bai;4.P+α-bun;5.PE;6.PE-Bai;7.PE+α-bun+Bai;compared with NP group,*.P<0.05; compared with PE group,#.P<0.05; compared with PE+Bai group,&.P<0.05.
2.5黄芩苷抑制了PE大鼠胎盘中NF-κBp65的激活 如图6所示,与NP组大鼠相比,PE组大鼠胎盘中核NF-κBp65的阳性细胞率显著升高(P<0.05)。与PE组相比,PE+Bai组胎盘中核NF-κBp65的阳性细胞率显著降低(P<0.05)。与PE+Bai组相比,PE+α-bun+Bai组胎盘中核NF-κBp65的阳性细胞率显著升高(P<0.05)。
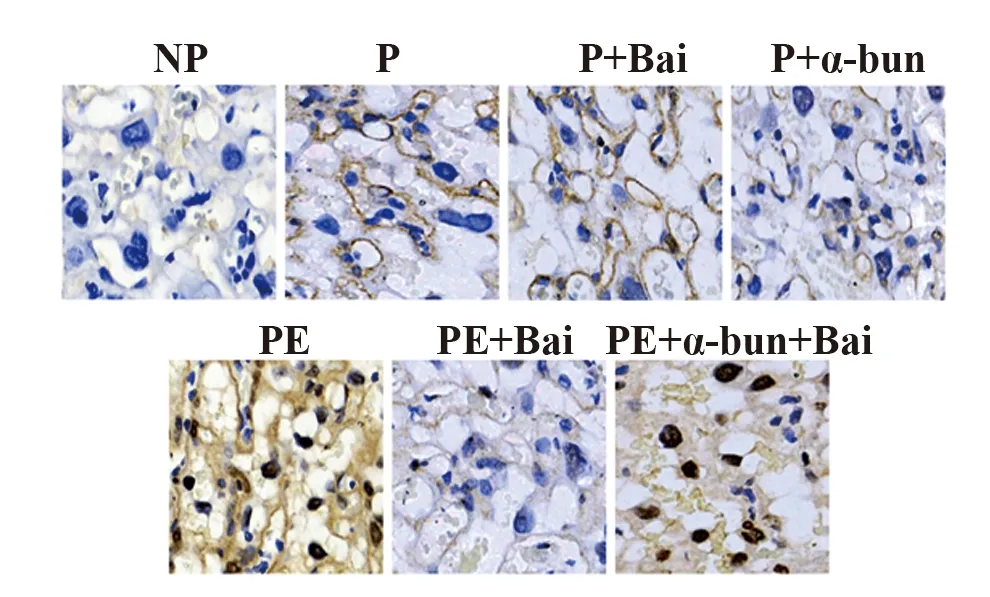
图6 免疫组织化学染色检测各组大鼠胎盘中NF-κBp65的表达(×400)Fig.6 Expression of NF-κBp65 in placenta of rats in each group detected by IHC staining(×400)Note:Compared with NP group,*.P<0.05; compared with PE group,#.P<0.05; compared with PE+Bai group,&.P<0.05.
3 讨论
PE的症状包括高血压、蛋白尿、水肿等,并且伴随全身异常的炎症反应,包括白细胞和内皮细胞的激活[14]。最近,一些学者集中研究了抗炎干预在PE治疗中的作用。高血压大鼠在妊娠期用抗炎细胞因子IL-10治疗可使血压和尿蛋白排泄正常化并降低IFN-g水平[15]。用MgSO4处理可显著降低LPS诱导的PE模型大鼠的TNF-α和IL-1β水平。免疫抑制剂环孢霉素A改善了PE大鼠模型的症状并减弱了炎症反应[14]。这些数据表明抗炎药物可通过减弱炎症反应改善PE大鼠模型的临床症状。
黄芩苷是一种天然植物药,有研究报道黄芩苷可通过改变几种蛋白质的表达来预防严重的急性胰腺炎,如Bax、Bcl-2和Caspase-3,还可预防铁过量导致的肝、肾和心脏损伤[16,17]。以上结果表明黄芩苷可以保护心脏、肝脏和肾脏免受其他疾病引起的伤害。有研究表明黄芩苷在很大程度上降低了PE动物模型的收缩压和舒张压症状,并降低尿蛋白水平[18]。黄芩苷通过抑制大鼠胎盘中的滋养层细胞凋亡并通过调节X-连锁凋亡抑制蛋白表达和下调Caspase-9表达改善线粒体的超微结构,从而发挥治疗先兆子痫的作用[19]。在本研究中LPS诱导的PE妊娠大鼠模型中,黄芩苷可有效减轻SBP和尿蛋白排泄,并可抑制胎盘中促炎细胞因子的产生。
据报道,胆碱能抗炎途径可以抑制促炎细胞因子的过量产生[20]。越来越多的证据表明,α7nAChR在胆碱能抗炎途径中至关重要。在人和大鼠胎盘中也观察到了α7nAChR的表达。胎盘中内源性释放的乙酰胆碱(ACh)与巨噬细胞上的a7AChRs结合,从而抑制细胞因子的产生[21]。用α7nAChR激动剂(如烟碱、PNU282987、GTS-21和胆碱)处理鼠巨噬细胞系可抑制促炎细胞因子[22]。本研究发现注射黄芩苷可提高胎盘中α7nAChR的mRNA和蛋白水平。同时,当用α-bungarotoxin处理PE大鼠时,黄芩苷对PE大鼠的保护作用被抵消。α7nAChR可以控制NF-κB途径。本研究表明,黄芩苷治疗可抑制PE胎盘中核NF-κBp65表达,而α-bungarotoxin则显著拮抗这些作用;黄芩苷通过胆碱能抗炎途径减弱LPS诱导的PE大鼠模型中的炎症反应,从而改善PE样症状的基础。
综上,黄芩苷通过激活α7nAChR从而激活了胆碱能抗炎性途径,进而减少PE大鼠模型症状,同时抑制了胎盘的炎症。而应用α7nAChR拮抗剂α-bungarotoxin处理则可逆转黄芩苷的上述作用,表明激活胆碱能抗炎途径可能有助于减轻PE,黄芩苷发挥的保护作用可能取决于其对α7nAChR的激活。
