干扰素调节因子7(IRF7)与系统性硬化症关系研究进展
2020-12-24闭雄杰
闭雄杰
(广西科技大学第一附属医院,柳州 545002)
系统性硬化症(systemic sclerosis,SSc)是一种以血管病变、皮肤和内脏纤维化、免疫调节紊乱为特征的慢性、多系统自身免疫性疾病[1,2]。目前,SSc的病因尚不清楚,尚无有效的治疗方案。近年来,相关研究结果表明,Ⅰ型干扰素(IFN)在SSc纤维化的发病中起着重要作用,但是其诱导的下游分子如何参与SSc病理生理的确切机制尚不清楚。最近研究发现,IRF7被认为是Ⅰ型IFN的最主要调节因子,其过度激活可能参与SSc纤维化的发病机制,现就有关研究进展综述如下。
1 IRF7基因结构
IRF7,被称为淋巴特异性因子。人IRF7基因位于11p15.5染色体上,有4种剪接体,分别是IRF7A、-B、-C和-H,不同的剪接体表现某一个结构域的缺失(图1),通过随机基因敲除的方法确定IRF7识别的序列为5′-GAAA/TNC/TGAAANT/C-3′。IRF7的氨基端含有一个由115个氨基酸组成的可与DNA结合的结构域(DNA binding domain,DBD),其中DBD能特异性结合IFN于ISRE,DBD确定为1~149位氨基酸,紧邻DBD结构域的是CAD(constitutive activation domain),即活化结构域,确定为150~246位氨基酸。SRD(signal response domain)位于278~305位氨基酸,称为病毒功能结构域,增加病毒诱导产生的活性。ID位于372~467位氨基酸称为抑制结构域,主要抑制反式激活作用。C末端为VAD(virus activated domain),是副诱导区域,同时这个区域也是IRF7 的磷酸化位点所在区域。上述区域是根据其诱导IFN过程中的作用进行的划分[3]。

图1 IRF7的4种剪接体示意图[3]Fig.1 Four splicing variants of IRF7[3]Note:Four splicing variants of IRF7 have been identified,named IRF-7A,IRF-7B,IRF-7C,and IRF-7H.DBD is localized in the N-terminal region of IRF7.C-terminal region of IRF-7 contains multiple domains,including constitutive activation domain (CAD),virus-activated domain(VAD),inhibitory domain (ID),and signal response domain (SRD).
IRF7受Ⅰ型IFN的调控,也受TLR3、TLR4、TLR7/9的调控[4]。激活的IRF7可导致大量Ⅰ型IFN 的分泌。据研究报道,已经确定IRF7基因有几个易感位点与自身免疫性疾病相关,其中位点rs1131665与SSc密切有关[5,6]。
2 IRF7的激活
Ⅰ型IFN、TNF-α、IL-1β和病毒感染均可诱导IRF7在脾脏、胸腺和外周血淋巴细胞的B细胞浆、浆细胞树突状细胞(pDCs)和单核细胞中持续表达。未活化的IRF7存在于细胞质中。在病毒感染的早期,病原体与识别受体(PRRs)结合,激发TLR9/7诱导IRF7磷酸化;IRF7磷酸化后与磷酸化的IRF3(受TLR3、TLR4诱导)进入细胞核内,与其他协同激活因子(如P300结合蛋白)形成转录复合物;该转录复合物与IFN-α和IFN-β启动子中的病毒应答物质(VRES)结合诱导产生少量Ⅰ型IFN[7]。这些少量Ⅰ型IFN与细胞膜上的IFN受体(IFNR)结合,激活JNK激酶信号,导致信号转导子和转录激活因子(STAT)-1和-2的磷酸化而激活;激活的STAT-1和-2与IRF9形成复合物“IFN刺激的基因因子3”;该复合物与IRF7启动子上的IFN刺激反应物结合,诱导合成更多的IRF7。新合成的IRF7通过正反馈调节促进生成更多的IFN而产生强大的放大效应。除TLR9/7和IFN受体外,炎症细胞因子IL-1β也能刺激人星形胶质细胞IRF7的表达。IL-1β是一种由活化的单核/巨噬细胞和上皮细胞产生的炎症细胞因子,对宿主产生炎症、感染性或免疫攻击的反应[8]。动物模型研究结果表明,IL-1β诱导的急性肺炎症、重塑和纤维化依赖于IL-1R1和MyD88信号通道。在培养的小鼠IRF7缺失的胚胎成纤维细胞中,病毒诱导的MyD88信号通道对IFN-α/β mRNA水平不升高反而明显降低[9]。此外,IRF7诱导pDCs和单核细胞产生炎症细胞因子IL-6[10]。由此可见,IRF7在炎症、组织重塑和纤维化等方面具有重要的作用。本文根据Honda等[11]报道的IRF7在细胞内模式识别受体激活及在Ⅰ型干扰素基因正反馈调控中的作用机理,提出IRF7激活的可能机制(图2)。

图2 可能的IRF7激活机制示意图[11]Fig.2 Possible mechanisms of IRF7 activation[11]Note:DNA or RNA of virus in the cytosol of virus-infected cells triggers type Ⅰ IFN gene induction through TLR pathway;TLR3/TLR4 recognizes dsRNA;TLR7 mediates recognition of ssRNA;TLR9 recognizes CpG DNA of viruses.TLR3 utilizes TRIF;TLR4 utilizes TRAF6.TLR7,TLR9 use only MyD88;Phosphorylated IRF3,enabling IRF7 interact with P300,initiate efficient transcription of target genes;After initial activation of type Ⅰ IFN genes is achieved by IRF7,positive-feedback regulation comes into effect.
3 IRF7与SSc
IRF7与包括SSc在内的多种自身免疫性疾病有关[5,12]。基因芯片研究显示早期SSc患者外周IRF7 mRNA表达上调[13]。最近一项研究也表明[14]:与健康对照组相比,SSc患者的外周血单个核细胞中IRF7 mRNA表达升高;此外,对不同类型的SSc患者分析,结果显示局限性皮肤系统硬化症患者的IRF7 mRNA表达显著高于健康对照组,而弥漫性皮肤系统硬化症患者IRF7 mRNA表达不升高,这可能与IRF7基因多态性有关。另一项独立研究表明,IRF7基因区域的变异与SSc患者自身抗体ACA的产生密切有关,并对疾病的发生发展起关键作用[6]。另一项研究显示,SSc患者外周血单个核细胞IRF7转录水平与对照组相比差异无统计学意义,可能与该研究样本为晚期SSc疾病患者且样本量较小有关[15]。因此,IRF7在SSc发病中的作用机制需要进一步研究。
4 IRF7在SSc发病中的作用机制
4.1IRF7参与Ⅰ型IFN诱导基因的转录调控 IRFs在哺乳动物中该家族由9名成员组成:IRF1、IRF2、IRF3、IRF4(又称LSIRF、PIP或ICSAT)、IRF5、IRF6、IRF7、IRF8(又称ICSBP)和IRF9(又称ISGF 3γ),其最主要特征是参与Ⅰ型IFN和IFN诱导基因的转录调控,在调节先天和适应性免疫反应中发挥关键作用[12,16]。
Ⅰ型IFN是天然免疫系统的关键调节因子,对免疫细胞的分化、增殖和促进炎症细胞因子的产生起关键的调节作用[17]。近年来,研究发现SSc患者外周血细胞中存在Ⅰ型IFN诱导基因功能失调和早期阶段甚至在没有发生皮肤纤维化之前血清中存在Ⅰ型IFN系统激活[18-20]。有报道,接受IFN-α治疗慢性病毒性肝炎的患者中并发SSc[21]。此外,对早期SSc患者皮下注射IFN-α治疗组与安慰剂治疗组相比,IFN-α治疗导致肺功能恶化,皮肤评分也没有改善[22]。有研究小组也报告了SSc患者外周血和皮肤组织中异常调控的Ⅰ型IFN诱导基因的转录模式[23-25]。有证据表明TLR的激活触发细胞内信号转导通路而参与了SSc的病理生理过程[26]。最近的研究结果显示,TLR3配体Poly I∶C刺激SSc皮肤成纤维细胞Ⅰ型IFN和TGF-β反应基因的表达[27];Ⅰ型IFN也通过上调SSc中TLR3的表达而增加真皮成纤维细胞的炎症潜能[28]。Bhattacharyya等[29]通过激活典型的Smad信号和抑制抗纤维化的microRNA miR-29的表达,证实了TLR4信号激活成纤维细胞,促进胶原合成并增加组织重塑和细胞外基质基因的表达。因此,Ⅰ型IFN信号通路是通过TLR激活促进SSc纤维化。虽然Ⅰ型IFN激活系统的存在,但这种调控异常的Ⅰ型IFN信号转导和干扰素诱导下游分子参与SSc病理生理的确切机制尚不清楚。而近年来研究结果表明,在免疫反应中IRF7被认为是Ⅰ型IFN的最主要调节因子可能参与SSc纤维化的发生和发展[9]。
4.2IRF7参与促进单核/巨噬细胞的表达 单核/巨噬细胞系具有相当的多样性和可塑性,受信号分子、转录因子和表观遗传机制的复杂网络调控。单核/巨噬细胞是由循环血液单核细胞进入组织内转变而来。在组织内单核/巨噬细胞受到刺激做出反应,并显著改变其生理活性。单核/巨噬细胞大致可分为经典激活(M1型)和交替激活(M2型)两种类型[30]。两类单核/巨噬细胞功能并不相同,M1型主要参与炎症性的反应,而M2型被更多认为参与组织重塑和纤维化[31]。据有关报道,SSc患者血清中IL-4、IL-13表达增加,而IL-4或IL-13能够激活单核/巨噬细胞变成为M2型[32-34]。SSc患者皮肤活检结果表明M2单核/巨噬细胞表达增加[35]。目前研究结果认为,SSc患者M2单核/巨噬细胞表达增加与IL-6水平升高关系密切,使用IL-6受体阻滞剂能减少SSc患者皮肤M2的表达[36,37];Maier等[38]认为磷酸二酯酶4(PDE4)抑制剂通过干扰M2单核/巨噬细胞中的IL-6释放从而降低SSc皮肤纤维化的发生。最近报道,用博莱霉素(BLM)诱导的小鼠模型中,IRF5+/+小鼠中单核/巨噬细胞皮肤和肺内表达显著上升,但是在IRF5-/-小鼠则明显下降[39]。由于IRF7和IRF5具有高度的同源性,IRF7如何促进单核/巨噬细胞的表达,目前确切机制尚不清楚[40]。皮肤真皮组织中可能的M2型单核/巨噬细胞激活机制的示意图[30]。见图3。
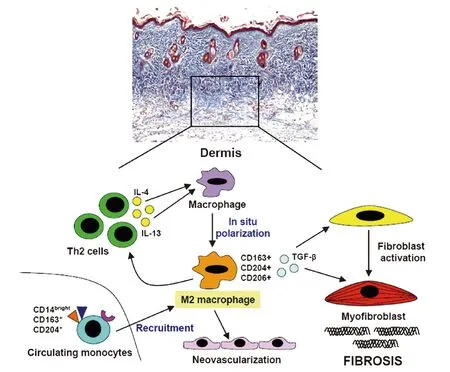
图3 皮肤真皮纤维化中的巨噬细胞替代激活的可能机制和功能Fig.3 Possible mechanisms and functions of alternative activation of macrophages in dermal fibrosisNote:In the early inflammatory phase of the fibrotic process,in situ M2 polarization of macrophages may be induced by infiltrating Th2 cells via the release of several mediators,mainly IL-4 and IL-13.In particular,M2 macrophages may further promote Th2 effector responses,neovascularization,and contribute to the transition of fibroblasts into apoptosis-resistant profibrotic myofibroblasts via the production and release of fibrogenic cytokines and growth factors,such as TGF-β.
4.3IRF7激活参与β转化生长因子(TGF-β)信号转导 SSc发病机制主要是由正常组织结构被渐进性的纤维化组织代替所致。最近的研究阐明,在许多重要的致纤维化的细胞因子和炎症介质中,TGF-β被认为是在SSc发生纤维化过程中起最重要作用的因子[41]。TGF-β促进成纤维细胞的增殖、分化、迁移、黏附和活化,并诱导细胞因子分泌,最重要的是促进胶原和细胞外基质的合成。鉴于TGF-β在SSc发病中的关键作用,TGF-β已成为一种潜在的治疗靶点。目前,TGF-β抗体已经在动物模型和临床SSc患者中进行了应用研究,并取得良好的治疗效果[42]。
有研究表明,TLR 3激动剂Poly(Ⅰ∶C)在体外和体内均能激活皮肤纤维化及Ⅰ型IFN表达升高[43];升高的Ⅰ型IFN通过激活Smad2/3 促进TGF-β表达升高,而升高的TGF-β对SSc纤维化起关键作用[44]。有研究证实,Smad转录因子家族的C-末端区域与IRF7的C末端区域同源,诱导TGF-β的反应,其中Smad3是刺激TGF-β信号通路中生成胶原的关键成分[45]。Smad3与IRF7相互作用并在TGF-β/Smad3信号转导中调控IRF7的转录活性。IRF7激活后与其他IRF(如IRF3)形成转录复合物,该转录复合物与另一个转录共激活因子P300结合蛋白结合,参与Smad依赖性TGF-β信号转导并促进胶原合成。IRF7与P300结合蛋白四个不同区域相互作用不仅刺激了IRF7的内在转录活性,而且增强其与其他转录因子协同的能力[46]。IRF7与CBP/P300的相互作用有助于形成更多稳定蛋白转录复合物CBP/P300,增强TGF-β的转录反应从而促进胶原蛋白过度生成[47]。
5 展望
SSc 10年生存率约为66%,且伴随内脏受侵犯生存率骤降为38%[48],Elhai等[49]的一项40年2 691例SSc患者的队列荟萃分析发现SSc是致死风险非常高的风湿免疫性疾病,过去40年其死亡风险并未得到改善,而首要死因就是心肺并发症,包括肺纤维化和肺动脉高压。因此,如何破解SSc的纤维化难题、有效改善肺纤维化,是降低SSc患者死亡率的关键。IRF7单核苷酸多态性(SNP)与SSc易感性有关,其中多态性位点rs1131665与SSc易感性关系最密切。IRF7参与Ⅰ型IFN诱导基因的转录调控及促进单核/巨噬细胞的表达和TGF-β信号转导。因此,IRF7作为Ⅰ型IFN的主要调节因子,其过度表达和激活可能参与了SSc纤维化的发病机制,可作为抗炎和抗纤维化药物发展的合适治疗靶点,从而减缓SSc的纤维化进程。
