腌制臭鸡蛋中微生物多样性分析及关键物质含量测定
2020-12-13谷新晰谈苏慧卢海强
陈 伟,李 杨,谷新晰,谈苏慧,卢海强,
(1.河北农业大学食品科技学院,河北 保定 071001;2.河北农业大学教务处,河北 保定 071001)
“臭”味食品源自食腐文化,是饮食的一个重要分支,如我国臭豆腐、瑞典鲱鱼罐头及日本的臭鱼干等。臭鸡蛋是一种极具地域特色食品,在河北省唐山、沧州、邢台和石家庄等地区较为常见。臭鸡蛋蛋体呈灰白色,有淡淡的臭味,入口后酯香浓郁、余味悠长。当前,臭鸡蛋生产仍以家庭生产方式进行,产品质量不稳定,其关键原因是臭鸡蛋中的微生物菌落结构信息不详。因此,探究臭鸡蛋中微生物群落结构、微生物群落结构与化学特性的关系十分重要。
发酵食品微生物多样性研究主要为发酵食品中微生物种群的类别、丰度、分布、结构变化及微生物群落功能的多样性。以此为改进传统食品发酵工艺、探究发酵食品风味形成机理等方面提供技术支持。中国传统发酵食品种类众多且大多采用独特的生产方法,涉及复杂的微生物群落,采用传统的培养方法对它们进行分析显然已经远无法满足研究的需要。随着分子生物学技术的快速发展,尤其是聚合酶链式反应(polymerase chain reaction,PCR)这一技术的成熟,建立了单链构象多态性[1]、变性梯度凝胶电泳[2]和末端限制性片段长度多样性[3]等环境微生物多样性分析方法,并成功应用于食品微生物多样性的研究。近年来,高通量测序以其检测快速、准确、信息全面丰富等优点,被广泛应用于发酵食品微生物多样性的研究[4-5]。戴玲瑛等[6]运用高通量测序技术对虾酱中的细菌群落组成和多样性进行分析,加深了对虾酱中微生物群落组成和多样性的认识,为优化虾酱的生产工艺提供理论依据。Zang Jinhong等[7]运用16S rRNA和ITS1高通量测序技术研究酸鱼过程中微生物群落的动态、多样性和演替,研究发现酸鱼发酵过程中微生物群落是动态的,接种混合发酵剂抑制了许多与食品腐败有关的微生物的生长,有利于酸鱼产品质量的提高。
发酵食品在生产的过程中,微生物将对原材料中的物质进行降解、转换及分泌自身代谢产物等物质,而这些物质会对产品的风味、营养及安全性造成一定的影响。如传统发酵食品中普遍存在生物胺,尤其是原料富含蛋白质的传统发酵食品,如我国的豆豉、臭豆腐、腐乳[8-10],国外的奶酪和发酵香肠等[11-12]。食用过多含有生物胺的食物,可能会引起中毒,导致偏头疼、高血压、呼吸紊乱等不良反应[13-14]。鸡蛋中富含胆固醇等脂类及氨基酸,会对产品的风味及营养价值造成很大影响,而到目前为止,鲜有臭鸡蛋中上述物质含量相关的报道。
本研究以传统腌制臭鸡蛋为材料,开展微生物(细菌和真菌)多样性及氨基酸、生物胺与胆固醇等物质含量分析,以加深对臭鸡蛋中微生物多样性及其化学特征的认识,强化臭鸡蛋的质量与安全,提高臭鸡蛋的品质,为优化和规范臭鸡蛋的标准化生产提供科学依据。
1 材料与方法
1.1 材料与试剂
臭鸡蛋样品购自河北省河间市堪泰家庭农场有限公司。
17 种氨基酸标准品(天冬氨酸、谷氨酸、丙氨酸、甘氨酸、组氨酸、精氨酸、半胱氨酸、丝氨酸、脯氨酸、酪氨酸、缬氨酸、甲硫氨酸、苏氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸) 美国Agilent公司;内标(正亮氨酸、异硫氰酸苯酯)、8 种生物胺标准品(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺) 美国Sigma-Aldrich公司;丹磺酰氯 上海源叶试剂有限公司;总胆固醇(total cholesterol,T-CHO)测试盒、甘油三酯(triglyceride,TG)测试盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测试盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测试盒 南京建成生物工程研究所。
1.2 仪器与设备
液相色谱系统(包括二元泵、2489紫外-可见光检测器、2707自动进样器、1500柱温箱) 沃特科技(上海)有限公司;酶标仪 美国Bio-Rad公司;L600系列高效液相色谱仪 北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 样品的采集
利用无菌取样器对臭鸡蛋腌制卤汁进行取样,并于-20 ℃保存备用,进行臭鸡蛋的微生物多样性的测定;选取外观完整的臭鸡蛋,贮存于-20 ℃,进行臭鸡蛋生物胺、氨基酸和脂肪酸等指标的测定。
1.3.2 微生物群落的高通量测序分析
采集臭鸡蛋发酵后期的卤汁100 mL,选用十六烷基三甲基溴化铵法提取DNA,目标片段PCR扩增采用NEB公司的Q5高保真DNA聚合酶,扩增细菌16S rDNA的V3-V4区域和真菌的ITS1区域,细菌V3-V4 F:ACTCCTACGGGAGGCAGCA;细菌V3-V4 R:GGACTACHVGGGTWTCTAAT。真菌ITS1 F:GGAAGTAAAAGTCGTAACAAGG;真菌ITS1 R:GCTGCGTTCTTCATCGATGC。扩增体系(25 μL):5×Reaction Buffer 5 μL,5×GC Buffer 5 μL,dNTP(2.5 mmol/L)2 μL,Forward Primer(10 μmol/L)1 μL,Reverse Primer(10 μmol/L)1 μL,DNA Template 2 μL,ddH2O 8.75 μL,Q5 DNA Polymerase 0.25 μL。扩增参数:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,30 个循环;72 ℃终延伸5 min。采用AXYGEN公司的凝胶回收试剂盒对扩增产物进行胶回收纯化。将PCR扩增回收产物进行荧光定量,荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,使用MiSeq测序仪进行2×300 bp的双端测序,相应试剂为MiSeq Reagent Kit V3。
为整合原始双端测序数据,首先采用滑动窗口法对FASTQ格式的双端序列逐一做质量筛查,随后利用FLASH软件进行配对连接,最后根据样本所对应的Barcode序列对获得每个样本的有效序列。运用QIIME软件和R软件剔除疑问序列并统计序列数,用QIIME软件的UCLUST对前述获得的序列按97%的序列相似度进行归并和可操作分类单元(operational taxonomic unit,OTU)划分,选取每个OTU中丰度最高的序列作为该OTU的代表序列。采用UNITE数据库对真菌的ITS序列进行物种分类信息的划分,采用Greengenes数据库对细菌16S rRNA进行物种分类信息的划分。最后基于上述分析结果,运用QIIME软件进行对样本进行α多样性分析,在物种水平上进行物种的差异分析和相关分析等。
1.3.3 游离氨基酸和水解氨基酸含量的测定
采用反相高效液相色谱法测定臭鸡蛋样品中游离氨基酸和水解氨基酸含量。游离氨基酸和水解氨基酸待测溶液的制备参照张薇等[15]的方法。氨基酸标准品溶液的制备、衍生试剂异硫氰酸苯酯的配制及衍生、氨基酸标准曲线的建立和色谱条件等均参照董蕊等[16]的方法并稍作改动,以正亮氨酸为内标物,与氨基酸标准品溶液、游离氨基酸和水解氨基酸待测液混合后浓度为250 μmol/L。
1.3.4 生物胺含量的测定[17]
标准溶液的配制:精确称取8 种生物胺标准品各100 mg,用0.1 mol/L HCl溶液溶解,制备成4 mg/mL生物胺标准储备液。分别吸取相同体积标准储备液进行混合,用0.1 mol/L HCl溶液稀释成最终质量浓度分别为500、250、100、50、25、10、5 μg/mL的混合标准溶液。
样品的处理:将臭鸡蛋在研钵中研磨成糜,取2 g加入20 mL 0.1 mol/L HCl溶液,16 000 r/min搅拌分离器均质1~2 min,7 422×g、4 ℃离心30 min,取上清液过滤。
衍生:取1 mL生物胺的标准混合溶液或样品,加入200 μL 2 mol/L NaOH溶液,然后加入300 μL饱和NaHCO3溶液,再加入1 mL丹磺酰氯溶液(10 mg/mL丙酮),涡旋1 min,置于42 ℃水浴锅中避光水浴45 min,取出后向样液中加入100 μL氨水,避光反应30 min,最后用色谱级乙腈定容至5 mL,并用0.45 μm有机膜过滤后用于高效液相色谱分析。
色谱柱为Agilent EclipseXDB-C18(4.6 mm×250 mm,5 μm),流动相A为0.1 mol/L乙酸铵溶液,流动相B为乙腈,柱温40 ℃,采用梯度洗脱程序,流速1 mL/min,紫外检测器波长254 nm,进样量20 μL。
1.3.5 胆固醇相关物质含量的测定
准确称取去壳臭鸡蛋和鲜鸡蛋质量,按料液比1∶9(g/mL)加入无水乙醇。在冰水浴的条件下进行机械匀浆1~2 min,2 500 r/min、4 ℃离心10 min,取上清液待测,采用试剂盒测定臭鸡蛋和鲜鸡蛋中的T-CHO、TG、HDL-C、LDL-C含量,具体步骤参照试剂盒说明书进行。
1.4 数据处理
每次实验重复测定3 次,利用Excel 2010和SPSS 19.0软件对测定结果进行统计分析,数据结果采用平均值±标准误差表示。
2 结果与分析
2.1 微生物多样性分析
2.1.1 微生物的α多样性分析
基因组DNA PCR扩增产物通过2%琼脂糖凝胶电泳检测(图1),并对目标片段进行切胶回收,回收浓度到扩增的要求,可用于后续的研究分析。通过细菌V3-V4和真菌ITS1测序,分别获得66 229 个和94 033 个序列。运用QIIME软件和R软件剔除疑问序列并统计序列数,分别获得39 605 个和53 649 个序列。所得序列在97%的相似水平下进行OTU统计分析,分别获得2 748 个和712 个OTU。

图1 琼脂糖凝胶电泳检测图Fig. 1 Agarose gel electrophoresis of PCR amplified products of bacterial and fungal genomic DNA

表1 臭鸡蛋菌群微生物多样性指数Table 1 Microbial diversity indexes of stinky eggs
由表1可知,臭鸡蛋卤汁样品中细菌和真菌的微生物群落种群多样性和总体丰度相对较高。从Chao1指数和ACE指数可以看出,臭鸡蛋卤汁样品中细菌的群落丰度高于真菌。在采样数量不足5 000 个OTU时,细菌与真菌的Shannon指数便进入了平台期,表明测序结果已足够反映臭鸡蛋卤汁样本所包含的多样性,臭鸡蛋样品的测序深度已满足后续生物信息学分析的要求。
2.1.2 臭鸡蛋卤汁样品中不同水平细菌群落组成分析
臭鸡蛋卤汁样品中共鉴定出7 个细菌门,分别为变形菌门(Proteobacteria)、盐厌氧菌门(Halanaerobiaeota)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)。
由图2A可知,盐厌氧菌是卤汁的细菌中最占优势的菌群,由门水平至属水平其相对丰度均在53%以上;Proteobacteria和Firmicutes所占比例略低,相对丰度分别为30.62%和15.05%。在变形菌门中γ-变形菌纲(Gammaproteobacteria)为优势菌纲,其相对丰度为30.26%。γ-变形菌纲中有很多病原菌,如沙门氏菌属和弧菌属等,在腌制臭鸡蛋的过程中控制变形菌的生长,利于提高臭鸡蛋的安全性。在厚壁菌门中芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)占主导地位,相对丰度分别为7.56%和7.48%。

图2 基于GraPhlAn的样本总体分类等级树图(A)及属水平分布图(B)Fig. 2 GraPhlAn-based sample classification hierarchy tree (A) and horizontal distribution map at genus level (B)
臭鸡蛋卤汁中鉴定出的细菌属主要有20 个(图2B)。在这20 个细菌属中,嗜盐耐盐的菌属有盐厌氧菌属(Halanaerobium)、盐单胞菌属(Halomonas)、源洋菌属(Idiomarina)、盐乳芽孢杆菌属(Halolactibacillus)、海杆菌属(Marinobacter)、Kosakonia、嗜盐嗜碱菌属(Alkalibacterium)等,总相对丰度将近90%。这与臭鸡蛋的制作工艺有关,在高盐浓度发酵的环境中会存在嗜盐耐盐微生物,李春生等[18]在研究传统鱼露发酵过程中细菌群落演替中发现Halanaerobium是鱼露发酵过程中最主要的菌群,在发酵3 个月,其相对丰度达到92.1%;鱼露发酵末期,Halomonas成为优势菌群,其相对丰度为25.8%,同时发现Halanaerobium与三甲胺(鱼腥味)呈显著正相关,Halomonas与2-甲基丙醛(麦芽香味)呈显著正相关;韩国鱼酱油[19]在发酵过程中Halanaerobium也占据主导地位。本研究所取样品时期为臭鸡蛋发酵末期,Halanaerobium为优势菌属,相对丰度达到53.89%;其余依次为Halomonas(11.55%)、Idiomarina(9.97%)、Halolactibacillus(4.77%)、Marinobacter(4.50%)、Clostridiisalibacter(3.53%)、Clostridium_sensu_stricto_18(2.33%)、肠球菌属(Enterococcus,1.44%)、Kosakonia(1.14%)。
2.1.3 臭鸡蛋卤汁样品中不同水平真菌群落组成分析
臭鸡蛋卤汁样品共鉴定出6 个真菌门,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、毛霉亚门(Mucoromycota)、油壶菌门(Olpidiomycota)。
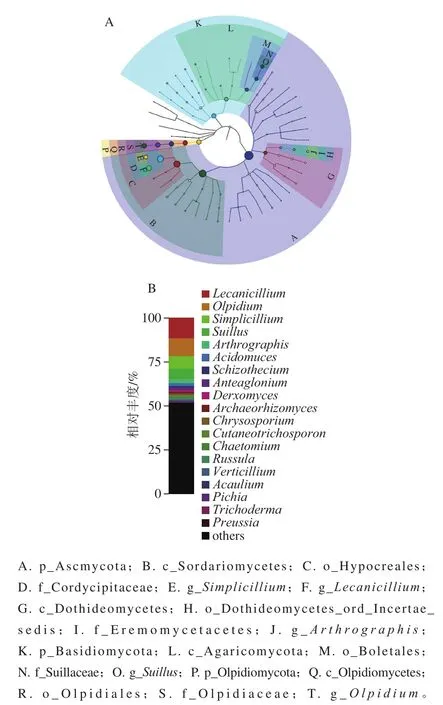
图3 基于GraPhlAn的样本总体分类等级树图(A)及属水平分布图(B)Fig. 3 GraPhlAn-based sample classification hierarchy tree (A) and horizontal distribution map at genus level (B)
由图3A可知,划分至已知分类单元的真菌的优势菌门分别为Ascomycota(35.04%)、Olpidiomycota(10.10%)、Basidiomycota(9.68%);优势菌纲分别为粪壳菌纲(Sordariomycetes,24.21%)、油壶菌纲(Olpidiomycetes,10.10%)、伞菌纲(Agaricomycetes,7.32%)、座囊菌纲(Dothideomycetes,5.65%);优势菌目分别为肉座菌目(Hypocreales,19.54%)、油壶菌目(Olpidiales,10.10%)、牛肝菌目(Boletales,5.87%)、Dothideomycetes_ord_Incertae_sedis(2.33%);优势菌科分别为虫草菌科(Cordycipitaceae,18.95%)、油壶菌科(Olpidiaceae,10.10%)、乳牛肝菌科(Suillaceae,5.84%)、沙漠壳菌科(Eremomycetaceae,2.33%)。
臭鸡蛋卤汁样品中鉴定出的真菌属主要有20 个(图3B),而相对丰度大于1%的属有蜡蚧菌属(Lecanicillium,11.64%)、油壶菌属(Olpidium,10.10%)、拟青霉属(Simplicillium,7.10%)、乳牛肝菌属(Suillus,5.84%)、Arthrographis(2.33%)、Acidomyces(1.58%)、裂壳菌属(Schizothecium,1.20%)、Anteaglonium(1.07%)、Derxomyces(1.04%)。对比酸鱼、红腐乳、东北大酱和发酵乳制品(酸牛奶、酸马奶和酸驼奶)等[7,20-22]我国传统发酵食品的真菌菌属,Lecanicillium和Olpidium是臭鸡蛋样品中独有的菌属,其中Lecanicillium是从轮枝孢属(Verticillium)真菌中分离出来的一类真菌,寄生在农业害虫和植物病原真菌中;Olpidium菌体寄生于藻类和植物细胞内,属于植物致病菌。目前,未见Lecanicillium和Olpidium参与食品发酵的报道,在臭鸡蛋样品中含有Lecanicillium和Olpidium,可能是发酵后期遭到了污染。
2.2 水解氨基酸含量分析
鸡蛋在腌制过程中,大量微生物的演替,伴随着微生物的代谢活动,鸡蛋中蛋白质大分子分解成小肽和游离氨基酸,产生并积累具有臭味的风味物质和生物胺等物质,氨基酸测定结果如表2所示。
鲜鸡蛋样品中水解氨基酸总量为(11.10±0.331)%,必需氨基酸为(4.69±0.169)%,非必需氨基酸为(6.41±0.162)%;臭鸡蛋样品中水解氨基酸总量为(6.89±0.440)%,必需氨基酸为(3.14±0.203)%,非必需氨基酸为(3.75±0.237)%。与鲜鸡蛋样品相比,臭鸡蛋样品的水解氨基酸总量减少了37.93%。
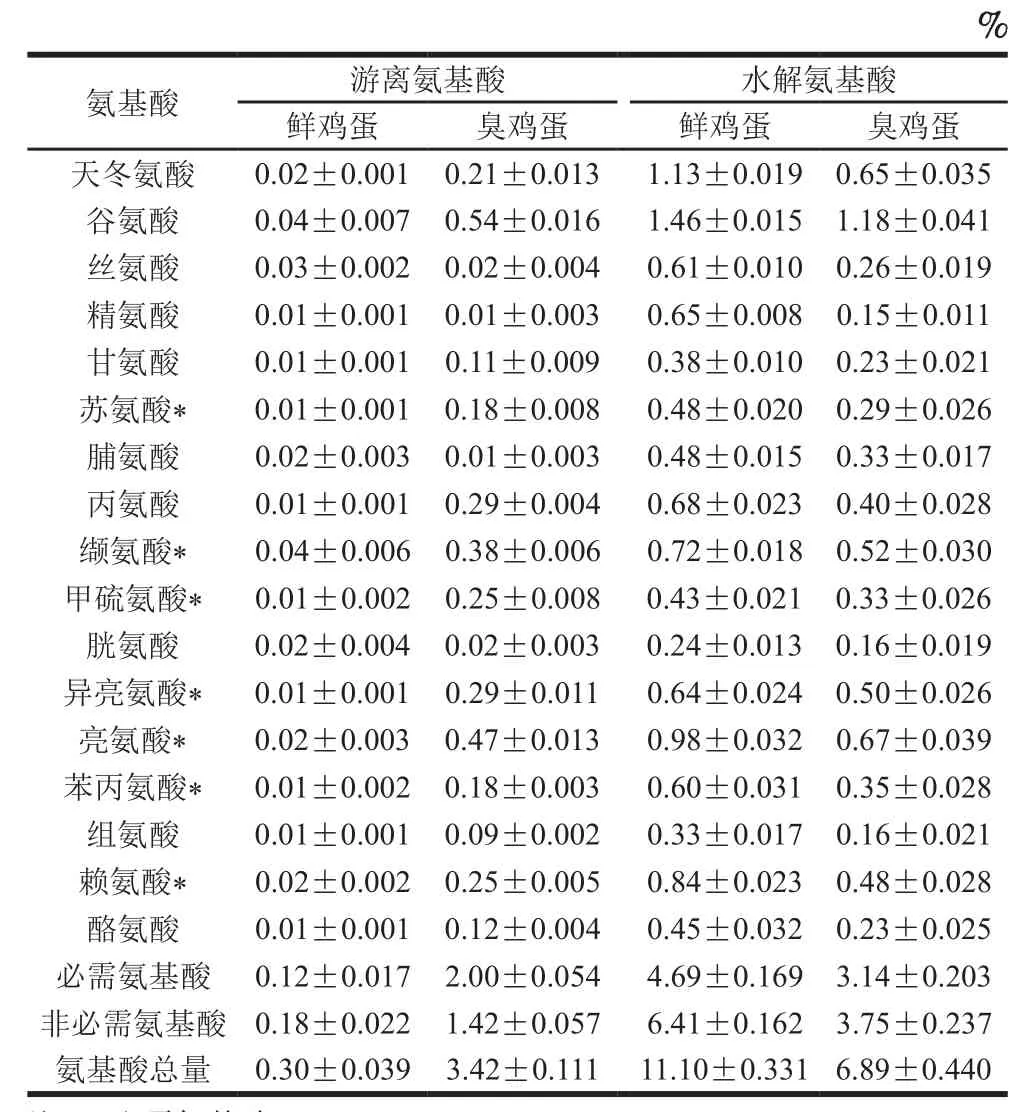
表2 鲜鸡蛋与臭鸡蛋试样中氨基酸质量分数Table 2 Amino acid composition of fresh and stinky eggs
臭鸡蛋样品水解氨基酸的必需氨基酸含量占其总氨基酸质量分数的45.57%,高于世界卫生组织/联合国粮农组织(World Health Organization/Food and Agriculture Organization,WHO/FAO)理想蛋白质标准所规定的40%。水解氨基酸中的非必需氨基酸含量占其总氨基酸质量分数的54.43%,其中必需氨基酸/非必需氨基酸为83.73%,远高于WHO/FAO理想蛋白质标准所规定的60%[23]。这说明臭鸡蛋中的营养物质虽然有所损失,但臭鸡蛋的氨基酸组成与WHO/FAO理想蛋白质标准十分接近,能够为人体提供较为丰富的必需氨基酸。
2.3 游离氨基酸含量分析
游离氨基酸是重要的呈味物质,臭鸡蛋样品中游离氨基酸总量为(3.42±0.111)%,为鲜鸡蛋样品((0.30±0.039)%)的11.4 倍。其中丙氨酸、甘氨酸和丝氨酸呈甜味,谷氨酸和天冬氨酸呈鲜味,精氨酸、组氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸和甲硫氨酸呈苦味[24]。臭鸡蛋中呈甜味、鲜味和苦味的游离氨基酸分别是鲜鸡蛋的8.4、12.5 倍和15.2 倍,臭鸡蛋鲜味氨基酸、甜味氨基酸和苦味氨基酸分别占总游离氨基酸的21.93%、12.28%、48.83%。
2.4 生物胺含量分析
目前我国还没有完善的监管标准或规定限制食品中8 种生物胺含量以及总生物胺含量。唯一涉及生物胺的标准只是针对水产品,即GB 2733—2015《鲜、冻动物性水产品》[25],标准中规定高组胺鱼类中组胺含量不可超过400 mg/kg,其他海水鱼类中组胺含量不可超过200 mg/kg。由图4可知,在臭鸡蛋样品中共检测出3 种生物胺,分别为色胺(69.02±0.74)mg/kg、组胺(8.33±0.53)mg/kg和酪胺(129.45±1.12)mg/kg,总生物胺含量为(206.80±2.39)mg/kg。结果表明,臭鸡蛋中的生物胺含量相对较低。
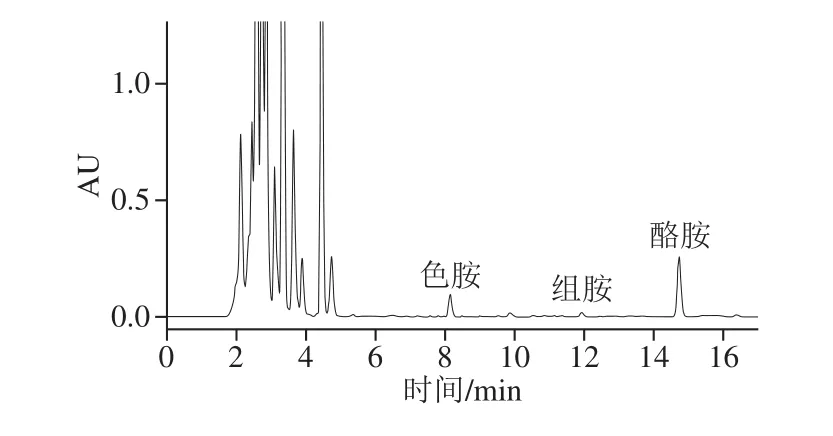
图4 臭鸡蛋样品生物胺高效液相色谱图Fig. 4 HPLC chromatograms of biogenic amines in stinky egg samples
2.5 T-CHO、TG、HDL-C及LDL-C含量分析
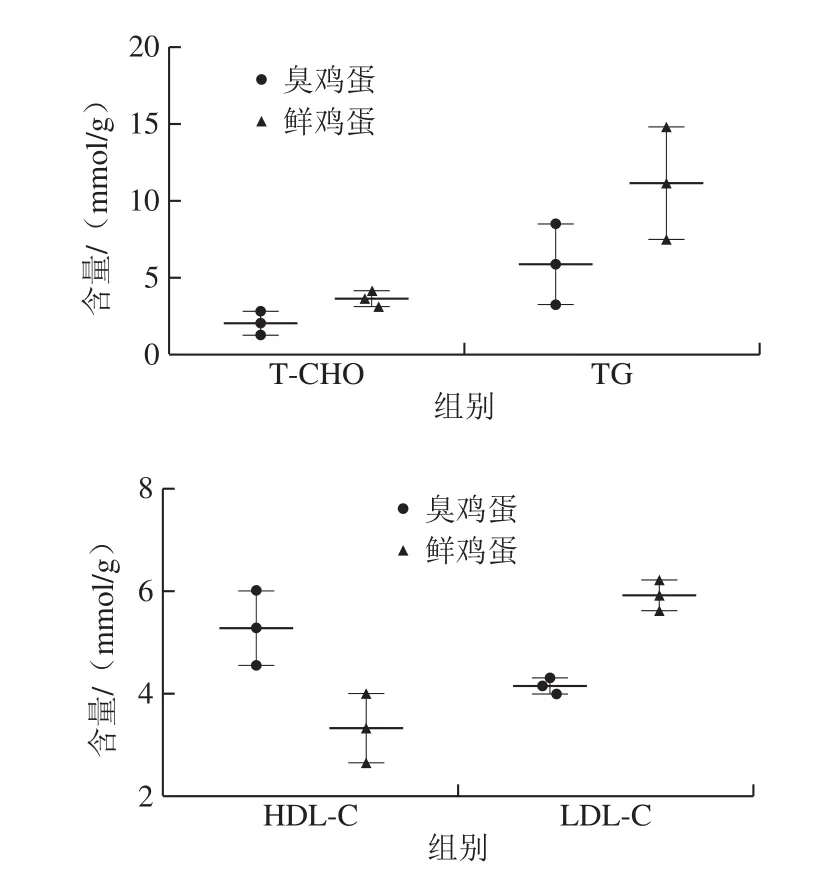
图5 臭鸡蛋与鲜鸡蛋中的T-CO、TG、DL-C、LDL-C含量Fig. 5 Contents of T-CHO, TG, HDL-C and LDL-C in stinky and fresh eggs
人体血液中T-CHO、TG和LDL-C含量超过正常标准会增高动脉粥样硬化、冠心病等心血管疾病的发病率。而HDL-C可以降低动脉粥样硬化、冠心病等心血管疾病的发病率。由图5可知,臭鸡蛋样品中T-CHO、TG和LDL-C含量相比于鲜鸡蛋减少44%、47%和30%;臭鸡蛋样品中的HDL-C含量相比于鲜鸡蛋增加59%。
3 讨 论
本研究通过高通量测序技术对臭鸡蛋发酵后期卤汁的细菌和真菌群落结构进行研究,发现臭鸡蛋卤汁与我国其他传统发酵臭味食品相比在细菌和真菌群落结构均存在一定差异。臭鸡蛋卤汁中的乳酸菌和酵母菌种类不及臭豆腐和臭卤水丰富,但含有丰富的嗜盐耐盐细菌[26]。这可能是因为臭鸡蛋仅以食盐和香辛料熬制的卤水浸泡腌制,而在发酵臭卤水的原料中有大量蔬菜。臭鸡蛋卤汁中细菌属水平有相对丰度将近90%的嗜盐耐盐细菌,大部分嗜盐菌会产出蛋白酶、脂肪酶和脂酶。其中臭鸡蛋中的Halomonas(11.55%)、Idiomarina(9.97%)、Marinobacter(4.50%)和Stenotrophomonas(0.01%)等菌属,均从其中筛选出了产蛋白酶、酯酶和脂肪酶的菌株[27-31]。真菌方面,有41.9%的OTU经UNITE数据库进行分类学注释,未能归属到任何已知分类单元。而划分至已知分类单元的真菌的优势菌属为Lecanicillium(11.64%)和Olpidium(10.10%),本研究用于高通量测序的样品为发酵后期卤汁,对真菌的演替变化不得而知,但推测是发酵后期遭到了污染。
生物胺在发酵食品中是潜在的食品安全隐患。此次臭鸡蛋样品中仅检测出3 种生物胺,分别为色胺(69.02±0.74)mg/kg、组胺(8.33±0.53)mg/kg和酪胺(129.45±1.12)mg/kg,总生物胺含量为(206.80±2.39)mg/kg。而臭豆腐[9,26]和豆豉[32]测定出8 种生物胺,其中臭豆腐组胺和酪胺含量分别为0~34.5 mg/kg和67.8~178.0 mg/kg,且总生物胺含量高于臭鸡蛋;豆豉的组胺和酪胺含量分别为0~24.71 mg/kg和0~117.59 mg/kg,且总生物胺含量为71.40~231.24 mg/kg。研究表明,在发酵食品中组胺、酪胺、β-苯乙胺和总生物胺含量分别为50~100、100~800、30、100~200 mg/kg,是可接受水平[33]。由以上对比结果,可知臭鸡蛋中的生物胺含量在一个安全可接受的范围中。
臭鸡蛋卤汁中含有相对丰度为1.44%的Enterococcus、0.26%的肠杆菌属(Enterobacter)和0.92%的不动杆菌属(Acinetobacter),有研究发现其与酪胺、组胺、尸胺和腐胺等生物胺的产生有关[34-35]。同时,臭鸡蛋卤汁中含有总相对丰度接近3.5%的芽孢杆菌属(Bacillus)、柠檬酸杆菌属(Citrobacter)、梭菌属(Clostridium)、克雷伯氏菌属(Klebsiella)、假单胞菌属(Pseudomonas)、变形菌属(Proteus)和链球菌属(Streptococcus)等可产生一种或多种生物胺[36],有研究发现其中假单胞菌属的丰度与组胺和尸胺的浓度呈正相关[37]。臭鸡蛋卤汁中产生物胺的微生物在属水平的相对丰度仅为6.12%,发酵食品中生物胺的产生和积累是多种因素及其相互作用的结果,臭鸡蛋样品中仅含有少量色胺、酪胺和组胺,可能是因为产生物胺的微生物相对丰度较低。
臭鸡蛋经发酵后,营养物质虽有一定的损失。但水解氨基酸的必需氨基酸/总氨基酸和必需氨基酸/非必需氨基酸较高,氨基酸组成符合FAO/WHO的理想模式,仍可作为补充人体蛋白质的优质蛋白源。臭鸡蛋中呈甜味、鲜味和苦味的游离氨基酸分别是鲜鸡蛋的8.4、12.5 倍和15.2 倍,臭鸡蛋鲜味氨基酸、甜味氨基酸和苦味氨基酸分别占总游离氨基酸的21.93%、12.28%、48.83%。苦味氨基酸明显多于甜味氨基酸和鲜味氨基酸,鲜味、甜味和苦味与各自的阈值有关。胱氨酸和甲硫氨酸等含硫氨基酸在微生物的作用下可能产生一定量的硫化氢等含硫化合物,使鸡蛋产生臭味。有报道称Halanaerobium和Halomonas分别与三甲胺(鱼腥味)和2-甲基丙醛(麦芽香味)呈显著正相关[18]。可能正是这些物质造就了臭鸡蛋的独特风味。与此同时,臭鸡蛋中T-CHO、TG和LDL-C含量相比于鲜鸡蛋减少44%、47%和30%,HDL-C含量相比于鲜鸡蛋增加59%。这一变化符合现今人们营养需求,对消费者的健康有利。由此可见,臭鸡蛋是一种具有营养的和风味特殊的传统发酵食品。
本研究利用高通量测序对臭鸡蛋中的微生物多样性进行了解析,同时探讨了微生物组成与生物胺之间的相关性,这为全面了解臭鸡蛋发酵过程中的优势菌群和今后臭鸡蛋发酵菌种筛选和规模化生产工艺的研究奠定基础。
4 结 论
本研究利用高通量测序技术分析臭鸡蛋发酵后期的卤汁中的微生物多样性,研究发现细菌共有7 个细菌门、10 个纲、21 个目、37 个科、68 个属;真菌共有6 个门、14 个纲、14 个目、36 个科、41 个属。盐厌氧菌是卤汁细菌中最占优势的菌群。在属水平嗜盐耐盐的细菌总相对丰度将近90%,Halanaerobium占53.89%。而真菌有41.9%的OTU经UNITE数据库进行分类学注释,未能归属到任何已知分类单元,属水平的优势菌群为Lecanicillium和Olpidium,推测是发酵后期遭到了污染。通过探讨臭鸡蛋卤汁中的细菌与真菌群落组成,了解了其优势菌群的分布情况及对臭鸡蛋的风味、安全和营养等品质的影响。
臭鸡蛋中的蛋白含量虽然有所损失,但仍能为人体提供较为丰富的必需氨基酸。臭鸡蛋游离氨基酸为鲜鸡蛋的11.4 倍,丰富的游离氨基酸参与构成了臭鸡蛋的特殊风味。臭鸡蛋样品中仅含色胺、组胺和酪胺,总生物胺为(206.80±2.39)mg/kg,含量在一个安全可接受的范围中。臭鸡蛋样品中T-CHO、TG、LDL-C和HDL-C含量变化符合现今人们营养需求,对消费者的健康有利。
