鸭茅幼苗对开花期白三叶不同部位化感作用的响应机理
2020-12-10张美艳刘彦培杨国盟黄梅芬薛世明
张美艳,刘彦培,杨国盟,张 艳,黄梅芬,薛世明*
(1. 云南省草地动物科学研究院,云南 昆明 650212;2.云南省种畜繁育推广中心,云南 昆明 650212)
【研究意义】化感作用(Allelopathy)是植物生态生理研究热点之一,又称为异株克生或他感作用,指的是一种植物通过向生长环境中释放其产生的某些化学物质,进而对其周围其他植物的生长发育产生有利或有害的影响[1-3]。化感作用在植物中广泛存在[4-6]。【前人研究进展】白三叶对多年生黑麦草(Loliumperenne)、高羊茅(Festuca elata)、紫花苜蓿(Medicagosativa)、红三叶(Trifoliumpratense)和萝卜(Raphanussativus)等存在一定程度的化感效应[7-10]。鸭茅种子萌发及幼苗生长对紫花苜蓿(Medicagosativa)和紫茎泽兰(Eupatoriumadenophorum)存在明显的化感响应,且鸭茅对不同浓度水提液化感作用的感应强度不同[11-13]。【本研究切入点】白三叶+鸭茅混播草地在中国西南地区有着广泛应用[14-15],而放牧是白三叶+鸭茅混播草地最主要的利用方式[16-17]。而关于化感作用在白三叶+鸭茅混播草地建植和利用中的研究报道较少。【拟解决的关键问题】文章主要探讨白三叶开花期不同部位浸提液对鸭茅幼苗生长发育的影响,旨在为鸭茅和白三叶混播草地的建植和高效管理提供指导依据。
1 材料与方法
1.1 供试材料
试验所用提取液的供体牧草白三叶来自云南昆明北郊试验基地(N 25°11′,E102°59′,海拔1995 m)。受体植物是鸭茅(品种为安巴)。
1.2 试验方法
1.2.1 样品采集与处理 挖取开花期白三叶植株,先用自来水冲洗,再用无菌双蒸水冲洗2~3次,直至冲洗干净。再用无菌滤纸吸干植株表面的水分,分离茎、叶、根,再分别剪成1~2 cm小段样品备用。
1.2.2 白三叶浸提液的制备 母液的制备:将处理好的白三叶根、茎、叶样品分别进行称重,置于500 mL锥形瓶,按样品l g加无菌双蒸水4 mL进行配制,封口后置于摇床25 ℃下浸泡震荡48 h,之后进行二重过滤,滤液即是浸提液母液,浓度为0.25 g/mL,保存在4 ℃冰箱备用。
处理溶液的制备:按照稀释比例,用无菌双蒸水将母液稀释成不同浓度(0.005、0.01、0.05、0.10和0.15 g/mL)的处理溶液,如不立即施用,处理液也需在4 ℃下保存。对照处理为无菌蒸馏水。
1.2.3 试验处理 利用人工气候培养箱(一恒MGC-350)进行幼苗培育。用发芽盘进行鸭茅种子萌发,20 ℃黑暗3 d,第4天开始每天光照25 ℃10 h,黑暗20 ℃14 h,培养12 d(鸭茅幼苗长度4~5 cm)时,挑选生长一致幼苗,移栽至发芽盒(19 cm×13.5 cm×8 cm)上,每个发芽盒装有全浓度霍格兰德(Hoagland)营养液800 mL,营养液每3 d更换1次。培养12 d后,用预选配好的茎、叶、根浸提液替换营养液,进行浸提液处理。处理期间,每天25 ℃10 h光照,20 ℃14 h,无菌双蒸水为对照处理。处理10 d采集样品进行指标测定。
1.3 指标测定
测定指标是鸭茅幼苗电解质渗透率、丙二醛、 超氧化物歧化酶活性、过氧化氢酶活性等,测定方法参照植物生理学实验指导测定方法[18]。
1.4 数据处理
采用SPSS 19.0进行数据方差分析,用Duncan法进行多重比较。
2 结果与分析
2.1 鸭茅幼苗叶片和根系电解质渗透率对开花期白三叶不同部位浸提液的响应
鸭茅幼苗叶片电解质渗透率对开花期白三叶茎、叶、根浸提液的响应不同。无论是白三叶的茎还是根浸提液,随着处理浓度增加鸭茅幼苗叶片电解质渗透率均呈逐步上升的趋势。根浸提液在浓度0.10 g/mL时,鸭茅幼苗叶片电解质渗透率达到最大,比对照增加122.0 %;且浓度0.10~0.15 g/mL的处理极显著高于对照(P<0.01)。茎浸提液在最大浓度0.15 g/mL时鸭茅叶片电解质渗透率达到最大,比对照增加175.0 %;0.05~0.15 g/mL浓度处理极显著高于对照(P<0.01)。然而,与白三叶根、茎浸提液不同,叶浸提液处理下鸭茅幼苗叶片电解质渗透率无明显上升趋势(P>0.05)。由此得出鸭茅叶片电解质渗透率对开花期白三叶茎、根浸提液的响应要比叶浸提液更加敏感(表1)。
鸭茅幼苗根系电解质渗透率对开花期白三叶茎、叶、根浸提液的响应明显不同(P<0.05)。不同部位浸提液处理下,随着浓度增加鸭茅幼苗根系电解质渗透率整体上表现出上升趋势,均在最大浓度0.15 g/mL处理时,鸭茅幼苗根系电解质渗透率达到最大值,分别比对照增加189.0 %、201.0 %和63.0 %。根浸提液处理下,0.05~0.15 g/mL浓度处理极显著高于对照(P<0.01)。茎浸提液处理下,所有浓度处理均极显著高于对照(P<0.01)。叶浸提液处理下,0.005 g/mL和0.10~0.15 g/mL处理极显著高于对照(P<0.01)。相比叶浸提液,鸭茅幼苗根电解质渗透率对白三叶根、茎浸提液的响应要更加敏感,尤其是茎浸提液(表2)。
2.2 鸭茅幼苗丙二醛含量对开花期白三叶不同部位浸提液的响应
鸭茅叶片丙二醛含量对开花期白三叶不同部位浸提液的响应不一致。其中,白三叶根和茎浸提液处理下,随着处理浓度的增加鸭茅叶片丙二醛含量均呈现出明显升高的趋势(P<0.01),均在浓度0.15 g/mL处理时,鸭茅叶片丙二醛含量最高,分别是23.20和33.69 nmol/g。但是,鸭茅叶片丙二醛含量对开花期白三叶叶浸提液的响应不同于根和茎浸提液,在0.005 g/mL浓度处理时,鸭茅叶片丙二醛的含量最大,随着处理浓度不断增高呈现出先降低后升高趋势(P<0.05,表1)。表明,开花期白三叶叶浸提液对鸭茅生长的抑制作用明显高于根和茎。

表1 鸭茅幼苗叶片电解质渗透率、丙二醛和脯氨酸含量对开花期白三叶不同部位浸提液的响应
鸭茅根系丙二醛含量对开花期白三叶不同部位浸提液处理的表现较为一致,均表现出随着处理浓度的增加呈现出先升高后降低的趋势。且鸭茅根系丙二醛含量对开花期白三叶茎及叶浸提液的响应较根浸提液更为敏感。白三叶茎浸提液0.05 g/mL时,鸭茅根系丙二醛含量就达到最高(P<0.05),0.01~0.15 g/mL处理与对照差异极显著(P<0.01)。白三叶叶浸提液0.10 g/mL时,鸭茅根系丙二醛含量达到最高值,比对照增加54.2 %(P<0.01),而其余处理下的鸭茅根系丙二醛含量与对照差异不显著(P>0.05);而白三叶根浸提液不同浓度处理下的鸭茅根系丙二醛含量差异不显著(P>0.05,表2)。表明白三叶茎、叶浸提液化感潜力要高于根浸提液。
2.3 鸭茅幼苗脯氨酸含量对开花期白三叶不同部位浸提液的响应
鸭茅叶片脯氨酸含量对开花期白三叶不同部位浸提液的响应存在显著差异(P<0.05,表1)。其中,白三叶根及叶浸提液,随着浓度的增加鸭茅幼苗受到抑制作用,脯氨酸含量呈增加趋势,均在0.15 g/mL处理浓度下达到最大,高浓度(0.10~0.15 g/mL)处理显著高于对照(P<0.05)。而白三叶茎浸提液在浓度0.10 g/mL时脯氨酸含量达到最大(P<0.01)。可以看出,鸭茅幼苗叶片中脯氨酸含量均是在低浓度0.005~0.05 g/mL未受到显著影响或受抑反应较低,在高浓度0.10~0.15 g/mL处理下表现出明显的受抑反应,且鸭茅幼苗叶片脯氨酸对茎浸提液的响应要比叶和根浸提液更加敏感。
鸭茅根系脯氨酸含量对开花期白三叶不同部位浸提液的响应不一致(表2)。随着叶浸提液浓度增加,鸭茅幼苗根系脯氨酸含量呈现出不断升高趋势,在浓度0.05~0.15 g/mL处理下极显著高于对照(P<0.01)。但是,鸭茅幼苗根系脯氨酸含量对开花期白三叶根及茎浸提液的响应均是先升高后下降趋势。在根浸提液处理下,浓度0.05 g/mL处理时鸭茅根系脯氨酸含量达到最大,显著高于对照(P<0.01),其余处理间均无明显差异(P>0.05)。在茎浸提液处理下,浓度0.005~ 0.05 g/mL处理下鸭茅根系脯氨酸含量极显著高于对照,在低浓度0.005 g/mL处理时,鸭茅就表现出明显受抑效应(P<0.05);而白三叶叶及根浸提液均是在0.05 g/mL处理时鸭茅才表现出明显受抑效应(P<0.05),这表明鸭茅根系脯氨酸对白三叶茎浸提液的受抑响应要早于根及叶浸提液,这与鸭茅叶片脯氨酸的响应较为一致。

表2 鸭茅幼苗根系电解质渗透率、丙二醛和脯氨酸含量对开花期白三叶不同部位浸提液的响应
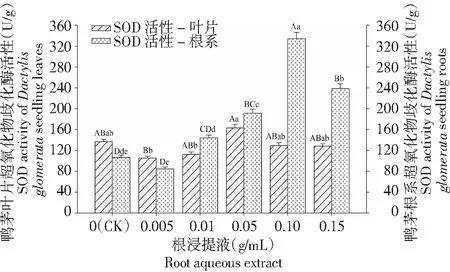
不同小写字母和大写字母分别表示同一部位不同浓度处理间5 %和1 %水平差异显著,下同Different lower case letters and upper case letters indicated significant difference between different concentration of aqueous extract from the same part of Trifolium repens at 5 % and 1 %, respectively,the same as below图1 鸭茅幼苗超氧化物歧化酶(SOD)活性对白三叶根浸提液的响应Fig.1 Effect of Trifolium repens root aqueous extract on the SOD activities of Dactylis glomerata seedling
2.4 鸭茅幼苗抗氧化酶活性对开花期白三叶不同部位浸提液的响应
2.4.1 超氧化物歧化酶(SOD)活性 白三叶根和茎浸提液处理下,鸭茅幼苗叶片中SOD活性均呈现出先上升后下降趋势。其中,根浸提液在浓度0.05 g/mL处理下鸭茅叶片SOD活性达到最大,显著高于0.005和0.01 g/mL浓度处理(P<0.05),但与对照差异不显著(P>0.05,图1)。茎浸提液处理下,0.10 g/mL浓度处理下的鸭茅叶片SOD活性达到最大,极显著高于对照和其他处理(P<0.01),低浓度0.005~0.01 g/mL处理下的SOD活性极其显著低于对照(P<0.01,图2)。然而,叶浸提液处理各浓度处理间差异不显著(P>0.05,图3)。以上表明,鸭茅幼苗叶片SOD活性对开花期白三叶不同部位浸提液的响应不一致,其中根和茎浸提液呈现出“凸”规律,在中间浓度处理下的SOD活性达到最大;而叶浸提液均为抑制作用;鸭茅幼苗叶片SOD活性对白三叶茎和根浸提液的响应要明显高于叶浸提液。
随着白三叶根、茎、叶浸提液浓度的增加,鸭茅幼苗根系SOD活性均表现出先上升后下降趋势,且均在浓度0.10 g/mL处理下SOD活性达到最大,极显著高于对照和其他处理(P<0.01),分别比对照增加214 %、465 %和180 %。由此可见,鸭茅根系SOD活性对开花期白三叶茎浸提液的响应要比根和叶浸提液更加明显(图1~3)。白三叶根和茎浸提液处理下,均是低浓度0.005 g/mL处理与对照差异不显著(P>0.05),高浓度(0.05~0.15 g/mL)与对照差异极显著(P<0.01)。而叶浸提液,低浓度0.005 g/mL处理显著低于对照(P<0.05),高浓度(0.05~0.15 g/mL)处理均显著高于对照(P<0.05,图3)。由此得出鸭茅幼苗SOD活性对开花期白三叶茎浸提液的响应要比根和叶浸提液更加明显。
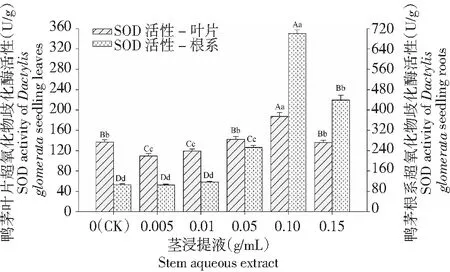
图2 鸭茅幼苗超氧化物歧化酶(SOD)活性对白三叶茎浸提液的响应Fig.2 Effect of Trifolium repens stem aqueous extract on the SOD activities of Dactylis glomerata seedling

图3 鸭茅幼苗超氧化物歧化酶(SOD)活性对白三叶叶浸提液的响应Fig.3 Effect of Trifolium repens leaf aqueous extract on the SOD activities of Dactylis glomerata seedling
2.4.2 过氧化物酶(POD)活性 白三叶根浸提液处理下,鸭茅幼苗叶片中的POD活性整体呈现出明显下降趋势(P<0.05)。其中,根浸提液处理下,鸭茅叶片POD活性均极显著低于对照(P<0.01,图4);茎浸提液处理下,不同浓度处理均与对照差异极显著(P<0.01),浓度0.005 g/mL处理下的鸭茅叶片POD活性极显著高于对照(P<0.01,图5);叶浸提液处理下,低浓度0.005、0.01 g/mL处理下的鸭茅叶片POD活性均显著大于对照(P<0.05),其余浓度处理均极显著低于对照(P<0.01,图6)。说明鸭茅叶片POD活性对白三叶茎、叶浸提液的响应要比根浸提液更加敏感。

字母下划线是表示CAT酶活性的差异性,下同Letters underline indicated the significance among CAT enzyme activity, the same as below图4 鸭茅幼苗过氧化物酶(POD)和过氧化氢酶(CAT)活性对白三叶根浸提液的响应Fig.4 Effect of Trifolium repens root aqueous extract on the POD and CAT activities of Dactylis glomerata seedling

图5 鸭茅幼苗过氧化物酶(POD)和过氧化氢酶(CAT)活性对白三叶茎浸提液的响应Fig.5 Effect of Trifolium repens stem aqueous extract on the POD and CAT activities of Dactylis glomerata seedling
白三叶不同部位浸提液处理下,鸭茅根系POD活性的响应不一致。其中,根浸提液和茎浸提液处理下,鸭茅根系POD活性呈整体上升趋势,均在高浓度0.15 g/mL处理下达到最大值,极显著高于对照和其他处理(P<0.01),分别是对照处理的70.65倍和31.84倍;茎浸提液处理下的鸭茅幼苗根系POD活性均极显著高于对照处理(P<0.01,图4~5)。叶浸提液处理下,随着浓度增加鸭茅根系POD活性呈现先升高后降低趋势, 0.01~0.15 g/mL浓度处理下鸭茅根系POD活性极显著高于对照(P<0.01,图6)。表明,鸭茅根系POD活性对白三叶根和茎浸提液的响应要比叶浸提液更加敏感。
2.4.3 过氧化氢酶(CAT)活性 鸭茅叶片和根系CAT活性对白三叶不同部位浸提液的响应不一致,且鸭茅叶片CAT活性对白三叶不同部位水浸体液的响应变化幅度整体要大于根系CAT活性的变化幅度。鸭茅叶片CAT活性对白三叶根浸体液和浸体液的响应较为一致,随着处理浓度的增加表现出先上升后下降的趋势,均在0.01 g/mL处理下达到最大,显著高于高浓度(0.05,010和0.15 g/mL)处理(P<0.05),且与低浓度0.005 g/mL和对照处理差异不显著(P>0.05,图4~5)。然而,鸭茅叶片对白三叶叶浸提液的响应不同于根和茎浸提液,随着处理浓度增加,鸭茅叶片CAT活性呈显著下降趋势,不同浓度处理下的鸭茅叶片CAT活性均极显著低于对照处理(P<0.01,图6)。

图6 鸭茅幼苗过氧化物酶(POD)和过氧化氢酶(CAT)活性对白三叶叶浸提液的响应Fig.6 Effect of Trifolium repens leaf aqueous extract on the POD and CAT activities of Dactylis glomerata seedling
鸭茅根系CAT活性对白三叶不同部位浸提液的响应也不相同。其对白三叶根浸提液和茎浸提液的响应较为一致,均随着处理浓度的增加呈现出升高的趋势;在0.15 g/mL处理下的鸭茅根系CAT活性,极显著高于对照处理(P<0.01);且对茎浸提液的响应更为敏感(图4~5)。鸭茅根系对白三叶叶浸提液的响应不同于白三叶的根和茎,随着浸提液浓度的增加,鸭茅叶片CAT活性呈降低的趋势(图6)。
3 讨 论
丙二醛(MDA)是反映膜脂过氧化和组织的抗氧化能力强弱程度的指标之一[19],同时,也是一种有害物质,能与细胞内各种成分发生反应,导致膜结构及生理完整性的破坏[20]。本研究中,随着白三叶各部位浸提液浓度的增加,鸭茅幼苗叶片MDA含量呈上升趋势,这可能是鸭茅幼苗叶片膜质过氧化程度增强,引起了细胞酶和膜的严重损伤,进而导致MDA含量增加,也可能是由于活性氧清除剂活性受到抑制而造成的[21]。这与紫茎泽兰(Eupatoriumadenophorum)叶水提液对玉米(Zeamays)、黄花蒿(Artemisiaannua)浸提液对小白菜(Brassicachinensis)和萝卜幼苗生长的化感效应的研究结果相似[19, 22]。而鸭茅幼苗根系MDA含量随着白三叶不同部位浸提液浓度的增加,呈现出先上升后下降的趋势,且在达到最大之后又出现降低现象,可能是由于鸭茅根系一些化感物质被释放,或是感应到环境胁迫时产生的一种对环境胁迫的适应机制[9]。
白三叶植株会释放酚类化感物质[23],酚类物质会影响受体植物细胞的生长分化和抗氧化物酶(SOD)活性,破坏受体植物细胞内自由基平衡和细胞膜的正常运作,影响植物的生长发育[24-25]。SOD可以清除植物体内的氧自由基,调节膜脂过氧化水平,保护细胞膜受伤,在白菜(Brassicapekinensis)等植物上的研究指出,随着白三叶茎叶浸提液浓度的增加,白菜、紫花地丁(ViolayedoensisMakino.)和萝卜幼苗SOD活性呈下降趋势[25],这与本研究的结果不同。植物SOD活性下降表明SOD酶逐渐失去活性,进而导致受体植物鸭茅生长受到的抑制逐渐增强,这可能植物抗氧化酶适应逆境胁迫的一种机制[26]。表明,植物化感作用是植物进化过程中应对周围环境胁迫形成的一种适应机制[27]。
4 结 论
通过用开花期白三叶不同部位浸提液处理鸭茅幼苗,测定鸭茅地上部和地下部电解质渗透率和SOD活性等指标的测定得出,鸭茅幼苗叶片和根系对开花期白三叶不同部位浸提液,以及同一部位不同浓度的化感作用响应不同。鸭茅叶片和根系电解质渗透率对开花期白三叶茎、根浸提液的响应要比叶浸提液更加敏感。鸭茅幼苗叶片和根系丙二醛含量对白三叶不同部位浸提液的响应是茎和叶>根。从鸭茅幼苗脯氨酸含量变化可得出,白三叶不同部位浸提液表现出“低浓度无抑制,高浓度抑制”的影响,且茎>根≈叶。综合鸭茅叶片和根系SOD、POD和CAT活性变化,均表现出茎>根≈叶。综合各项指标,得出开花期白三叶茎浸提液对鸭茅幼苗的化感作用较大,其次是根和叶。因此,在人工混播草地建植和管理环节,需严格控制混播用种白三叶的播种比例和监控其繁殖比例,将白三叶对混播草地的化感影响降到最低。
