低温停食和复温后投喂频率对奥尼罗非鱼幼鱼生长的影响
2020-12-10张宇航李文红温晴宇
张宇航,高 扬,李文红,杨 卓,温晴宇,徐 鹏
(广西大学动物科学技术学院/广西高校水生生物健康养殖与营养调控重点实验室,广西 南宁 530004)
【研究意义】罗非鱼(Oreochromisniloticus)除在海南、台湾、广东、广西及福建的部分地区可自然越冬外,在其他地区水温降至16 ℃及以下时均需采取温泉或地热水及保温大棚模式才能确保安全越冬[1]。低温停食会引起鱼体重下降和健康状况变差,生产上主要采用复温后增加饲料投喂量等措施以减少损失。奥尼罗非鱼(O.niloticus×O.aureus)幼鱼经历不同时间饥饿胁迫后,可通过提高摄食率和饲料效率获得补偿生长[2],而低温条件可导致其停止摄食,且受低温和饥饿协同胁迫[3];但低温和饥饿协同胁迫后奥尼罗非鱼幼鱼是以何种方式获得补偿生长至今尚不清楚。奥尼罗非鱼在常温条件下投喂3次/d为其最佳投喂频率[4],但目前对低温及复温后投喂最佳时间和最佳投喂量的研究极少。因此,分析低温停食和复温后投喂频率对奥尼罗非鱼幼鱼生长的影响,对建立奥尼罗非鱼越冬精准饲养技术具有重要意义。【前人研究进展】罗非鱼越冬时可按“次多量少,不留剩饵”原则进行投喂[5],以防止过度投喂使鱼肥胖,或产生过多的粪便和残饵而影响水质[6]。pH、氨氮浓度和五日生化需氧量(BOD5)显著影响罗非鱼越冬成活率[7],因此在实际生产中遇到天气突变或水温较低时通常需要减少投料或停止投料[8]。罗非鱼自然越冬水温低于15 ℃时应停止投喂[9],抗寒罗非鱼品种在水温低于14 ℃时停止摄食[10]。我国罗非鱼主要养殖品种吉富品系罗非鱼(O.niloticus,GIFT)、奥尼罗非鱼和红罗非鱼(Oreochromisspp.)各有特点[11],其中,吉富罗非鱼生长速度快,起捕率高,耐盐性好,但不耐寒;奥尼罗非鱼耐低温,生长速度快,抗逆性强,红罗非鱼耐低氧,体腔无黑膜,肉质鲜嫩。已有研究表明,奥尼罗非鱼鱼苗最佳培育温度为28~31 ℃[12],14 ℃为奥尼罗非鱼的最低摄食温度,12 ℃时奥尼罗非鱼即停食,11 ℃时14 d内全部死亡,低温及饥饿胁迫下奥尼罗非鱼由于消耗体内的蛋白质和脂肪作为能源物质,会使其肝脏受到损伤[3]。【本研究切入点】至今,关于罗非鱼胁迫的研究主要集中在其饥饿处理[13-14]、耐寒性[15]和投喂策略[16],而针对低温停食和复温后投喂频率对奥尼罗非鱼幼鱼生长影响的研究鲜见报道。【拟解决的关键问题】模拟罗非鱼越冬生产实际情况,开展奥尼罗非鱼在经历低温和停食胁迫并恢复常温后给予不同投喂频率试验,分析奥尼罗非鱼越冬后的补偿生长特点、最佳投喂时间和投喂量,为建立奥尼罗非鱼越冬精准饲养技术提供科学依据。
1 材料与方法
1.1 试验材料
供试奥尼罗非鱼由广西大学水产养殖基地提供,挑选活力较强、规格一致的幼鱼(400尾,平均体重15.33±0.60 g/尾)在广西大学水产实验室控温循环玻璃水族箱(70 cm×40 cm×60 cm)中暂养2周,水体为曝气后的自来水并通气保持溶氧充足,水温(25±0.5) ℃,pH(7.6±0.2)。暂养期间投喂罗非鱼专用浮性颗粒饲料(粗蛋白含量≥39.0 %,粗脂肪含量≥2.5 %,粗纤维含量≤8.0 %,粗灰分含量≤13.0 %,钙含量1.00 %~4.60 %,总磷含量≥0.80 %,氯化钠含量0.50 %~3.00 %,赖氨酸含量≥1.70 %),且按2次/d饱食量投喂。
1.2 试验方法
1.2.1 试验设计 参考曾兰等[17]、卢其西[18]的方法设初始水温为25 ℃,然后以0.2 ℃/3 h的速度进行降温,8 d内降至12 ℃(降温期间投喂频率为2次/d)。温度降至设定12 ℃后,挑选规格一致的奥尼罗非鱼幼鱼,分为对照组(FC)和4个试验组(第1组为RF1,第2组为RF2,第3组为RF3,第4组为RF4)开展试验,每组设3个平行(重复),每个平行为1箱,每箱有罗非鱼幼鱼25尾,共15箱。
分组后试验组低温停食胁迫持续2周[3],对照组为在25 ℃下以2次/d的频率持续投喂,试验组胁迫2周后进入恢复阶段,水体按0.5 ℃/h的速度升温[19],24 h内升至25 ℃,并在此温度下养殖至试验组特定生长率(SGR)与FC组无显著差异为止,约3周[13],试验共持续5周。在温度恢复至25 ℃(复温)后的养殖期间,各组按照以下投喂频率进行养殖:RF1组4次/2 d(间隔1 d投喂4次,分别于9:00、12:00、15:00和18:00投喂)、RF2组2次/d(分别于9:00和17:00投喂),RF3组3次/d(分别于9:00、13:30和17:00投喂)、RF4组4次/d(分别于9:00、12:00、15:00和18:00)和FC组2次/d(分别于9:00和17:00投喂)。所有组别均按饱食量投喂,即每次将饲料少量多次投入水族箱,观察奥尼罗非鱼幼鱼的进食情况,投喂3 min后,若水族箱内有残饵,则结束投喂并捞出残饵,求得摄食量[20]。
1.2.2 取样方法 在整个试验周期内,各组每隔7 d取样1次(取样时间点为早上鱼苗空腹时),每次用30 mg/L间氨基苯甲酸乙酯甲磺酸盐(鱼安定,MS-222)将鱼麻醉后[21],将各组奥尼罗非鱼幼鱼捞出现场称重,取总重的平均值为每条幼鱼体重,再从每组的3个平行中各随机取奥尼罗非鱼幼鱼样品10尾,每组30尾,用于现场体长测量,并从10尾样品中随机取3尾,每组共9尾带回实验室解剖,用于肝体比和脏体比指标测定,其余样品放回水族箱。将复温投喂后每天捞出的残饵置于37 ℃烘干箱烘干,以实际投喂量减去残饵量即为奥尼罗非鱼幼鱼摄食量[20]。
1.2.3 生长指标计算
特定生长率(SGR, %/d)=100×(lnWt2-lnWt1)/tΔ
摄食率(FR, %)=100×C/[tΔ×(Wt2+Wt1)/2]
饲料效率(FE, %)=100×(Wt2-Wt1)/CΔ
肝体比(HSI, %)=100×Wh/Wb
脏体比(VSI, %)=100×Wv/Wb
肥满度(CF)=Wb/L3
式中,Wt1为上一次测样时试验鱼的体重(g/尾),Wt2为当次测样时试验鱼的体重(g/尾),Wb为样品鱼的体重(g/尾),Wh为样品鱼的肝脏重(g/尾),Wv为样品鱼的内脏重(g/尾),L为样品鱼的体长(cm),tΔ为当次测样时间与上一次测样时间之差(d),CΔ为上一次测样至当次测样时间内的摄食量。
1.3 统计分析
采用Excel 2003进行数据整理和统计,以SPSS 16.0进行单因素方差分析(One-way ANOVA),以Duncan's新复极差法进行多重比较。
2 结果与分析
2.1 奥尼罗非鱼幼鱼体重的变化情况
在整个试验期间,FC组奥尼罗非鱼幼鱼的存活率为100.00 %,而试验组奥尼罗非鱼幼鱼在降温至12 ℃停食后,随着时间的延长有部分死亡现象;复温时RF1组奥尼罗非鱼幼鱼存活率为88.00 %,RF2组为86.67 %,RF3组为85.33 %,RF4组为88.00 %,组间无显著差异(P>0.05,下同);复温投喂后均无死亡现象。
由表1可知,胁迫期间试验组奥尼罗非鱼幼鱼的体重均明显降低,且显著低于FC组(P<0.05,下同);恢复投喂期间,各处理组奥尼罗非鱼幼鱼的体重均明显升高,其中RF2和RF1组奥尼罗非鱼幼鱼的体重间无显著差异,但始终显著低于RF3、RF4和FC组;RF4和RF3组奥尼罗非鱼幼鱼在恢复投喂的第2周体重已高于FC组水平,但相互间无显著差异,至试验结束时,RF4组奥尼罗非鱼幼鱼的体重高于FC组,显著高于RF3组,RF3组与FC组差异不显著。说明胁迫后每天投喂3或4次可促进试验奥尼罗非鱼幼鱼体重恢复,尤其以4次/d投喂频率奥尼罗非鱼幼鱼的体重恢复效果更佳;RF2组与FC组恢复投喂后的投喂频率一致,但奥尼罗非鱼幼鱼体重显著低于FC组,表明在低温停食2周后以2次/d投喂频率投喂的奥尼罗非鱼幼鱼发生了部分补偿生长。

表1 各处理组奥尼罗非鱼幼鱼体重的变化情况

表2 各处理组奥尼罗非鱼幼鱼SGR的变化情况
2.2 奥尼罗非鱼幼鱼SGR的变化情况
由表2可知,胁迫期间试验组奥尼罗非鱼幼鱼的SGR均明显下降,呈负生长,而FC组奥尼罗非鱼幼鱼幼鱼的SGR呈上升趋势;恢复常温投喂后,RF3和RF4组奥尼罗非鱼幼鱼的SGR呈下降趋势,RF1和RF2组奥尼罗非鱼幼鱼的SGR呈先上升后下降的变化趋势,而FC组奥尼罗非鱼幼鱼的SGR仍呈上升趋势,即恢复投喂第3周时FC组奥尼罗非鱼幼鱼的SGR大幅提高,表明此时奥尼罗非鱼幼鱼达生长加速时期。其中,在恢复常温投喂后第1周时RF1和RF2组奥尼罗非鱼幼鱼的SGR恢复至接近FC组水平,但组间差异不显著,而RF3和RF4组奥尼罗非鱼幼鱼的SGR差异不显著,但二者显著高于其余各处理组;在第2周时各试验组奥尼罗非鱼幼鱼的SGR无显著差异,但均显著高于FC组;在第3周时RF4组奥尼罗非鱼幼鱼的SGR最高,但各处理组间无显著差异。说明SGR的显著提高发生在恢复常温投喂后第2周,并于恢复常温投喂后第3周恢复至FC水平,表明低温和饥饿胁迫后复温投喂的3周内,奥尼罗非鱼幼鱼发生了补偿生长,且补偿生长发生有约1周的迟滞;补偿生长期间提高投喂频率可提高奥尼罗非鱼幼鱼的SGR,投喂频率为4次/d时其SGR提升最大,但补偿生长结束时提升效果不显著。
2.3 奥尼罗非鱼幼鱼SHI、VSI和CF的变化情况
由表3可知,低温停食胁迫2周时,试验组奥尼罗非鱼幼鱼的HSI、VSI和CF均显著低于FC组;复温投喂3周时,RF4和RF3组奥尼罗非鱼幼鱼的HSI与FC组无显著差异,但三者的HSI均显著高于RF2和RF1组;RF4组奥尼罗非鱼幼鱼的CF显著高于其余处理组,RF1、RF2和RF3组奥尼罗非鱼幼鱼的CF均显著低于FC组;RF4和RF3组奥尼罗非鱼幼鱼的VSI虽低于FC组,但三者间差异不显著,RF2和RF1组奥尼罗非鱼幼鱼的VSI显著低于FC组。说明复温投喂后增加投喂频率可提高奥尼罗非鱼幼鱼HSI、VSI和CF的恢复速度,其中投喂频率为4次/d的恢复效果最佳,而投喂频率为3次/d的CF恢复程度不足,投喂频率为4次/2 d和2次/d的恢复程度总体上较差。
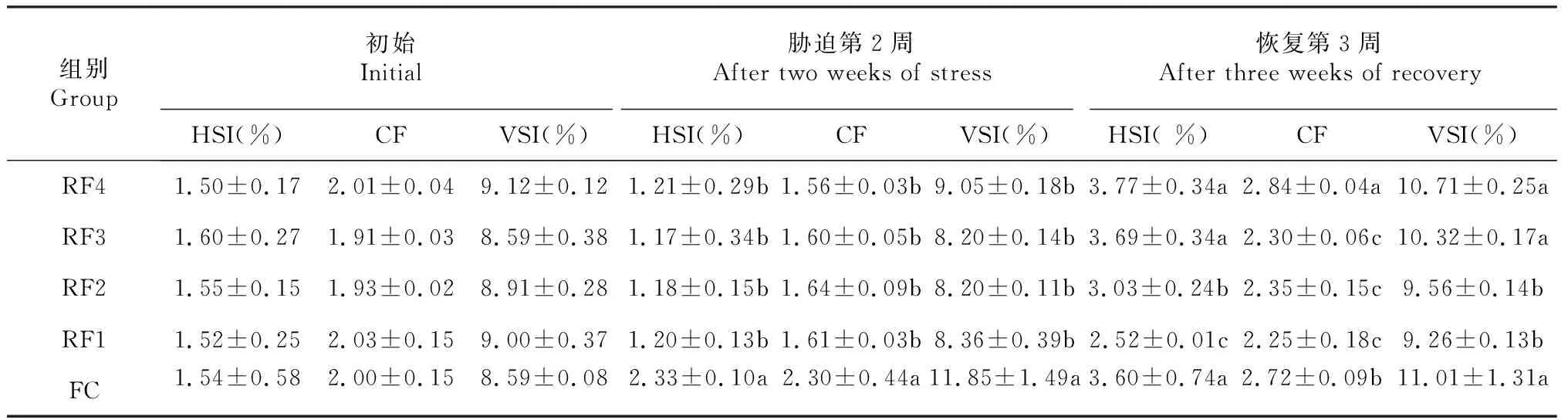
表3 各处理组奥尼罗非鱼幼鱼的HSI、VSI和CF的变化情况

表4 复温投喂后各试验组奥尼罗非鱼幼鱼FR与FE的变化情况
2.4 恢复投喂后奥尼罗非鱼幼鱼FR和FE的变化情况
由表4可知,在复温投喂期间,RF2、RF3和RF4组奥尼罗非鱼幼鱼的FR均显著高于FC组,而RF1组奥尼罗非鱼幼鱼的FR均显著低于FC组;各处理组的FR排序为RF4>RF3>RF2>FC>RF1;RF2、RF3和RF4组奥尼罗非鱼幼鱼的FR呈先上升后下降的变化趋势。在恢复投喂的前2周,各试验组的FE均显著高于FC组。其中,投喂第1周时RF4组的FE最高,显著高于其余处理组,而在投喂第3周时各处理组奥尼罗非鱼幼鱼的FE无显著差异。说明复温投喂后各组奥尼罗非鱼幼鱼的FR随着投喂频率的提高而升高,其中以4次/d投喂频率的FR最高,随后FR降低可能与补偿生长强度下降有关;RF1组间隔1 d投喂4次的FR显著低于FC与RF2组,不利于奥尼罗非鱼幼鱼摄食;因RF2组恢复投喂后的投喂频率与FC组相同,根据RF2组与FC组奥尼罗非鱼幼鱼的FR和FE比较结果,可判断低温和饥饿胁迫下奥尼罗非鱼幼鱼补偿生长的发生是通过FR和FE的共同提高而实现;补偿生长期间提高投喂频率可暂时增加FE水平,投喂频率为4次/d的FE最高,但随后提升不显著;而FC组恢复投喂第3周时FE提高,可能与此时奥尼罗非鱼幼鱼进入快速生长时期有关。
3 讨 论
3.1 低温和饥饿双重胁迫奥尼罗非鱼的补偿生长机制
动物获得补偿生长的生理机制主要有通过提高食物转化率、摄食率和同时提高摄食率和食物转化率实现3种观点[22-24]。已有研究表明,受饥饿胁迫后罗非鱼的补偿生长是通过提高摄食量而不是通过其代谢机制变化来实现[25];恢复喂食后,奥利亚罗非鱼立即进行大量细胞和细胞器合成从而实现快速生长[26];恢复投喂期间改变饲料的蛋白质和脂肪含量不会影响尼罗罗非鱼的FE[27],但饥饿胁迫后奥尼罗非鱼在补偿生长期间的FE有所升高[13-14]。在饥饿1 d、连续投喂6 d的投喂模式下,奥尼罗非鱼可通过提高饲料转化率以达到完全补偿生长目的[2]。本研究中,RF2组奥尼罗非鱼幼鱼的投喂频率与FC组相同,但恢复投喂后RF2组奥尼罗非鱼幼鱼的SGR、FR和FE均显著高于FC组,表明奥尼罗非鱼幼鱼在低温停食条件下复温投喂后发生了补偿生长,且是通过同时提高FR和FE得以实现;RF2组奥尼罗非鱼幼鱼的SGR呈先上升后下降的变化趋势,在复温投喂后第3周与FC组无显著差异,表明其补偿生长期间的快速生长阶段已停止,即补偿生长持续时间为复温投喂后3周左右。
目前,针对奥尼罗非鱼补偿生长的研究多采用不同饥饿时间和饥饿投喂循环模式处理,如27 ℃时经3~6 d饥饿胁迫的奥尼罗非鱼幼鱼可获得超补偿或完全补偿生长现象[13],在9 d以上的长时间饥饿下获得部分补偿生长[14]。本研究中,RF2组奥尼罗非鱼幼鱼的投喂频率与FC组一致,但最终体重未达FC组水平,即仅发生部分补偿生长,且在复温投喂第1周时SGR与FC组差异不显著,表明在复温投喂后2次/d的投喂频率下,奥尼罗非鱼幼鱼发生了1周的补偿生长迟滞现象。关于补偿生长是否存在迟滞现象目前尚有分歧,如经低温胁迫的大西洋鲑出现补偿生长前存在生长时滞[28],而经过长时间停食后以3次/d频率投喂的杂交罗非鱼在出现补偿生长前无明显的生长时滞[13]。本研究中产生的生长迟滞可能与低温和低投喂频率有关。
3.2 投喂频率对低温停食双重胁迫后奥尼罗非鱼生长的影响
鱼体饥饿时需要消耗较多自身储存的营养物质以维持基本的生命活动[29]。本研究结果表明,奥尼罗非鱼幼鱼在经过低温停食双重胁迫2周内,各检测指标均随胁迫时间的延长而下降,且显著低于FC组,与贾明亮[3]对奥尼罗非鱼的研究结果一致,即低温时奥尼罗非鱼停止摄食,发生负生长。
本研究中,复温投喂后试验组奥尼罗非鱼幼鱼的SGR和FR均随着投喂频率的增加而上升,与强俊等[4]的研究结果一致;随着试验时间的延长,各试验组奥尼罗非鱼幼鱼的SGR和FR呈先上升后下降的变化趋势;RF2组的奥尼罗非鱼在低温及饥饿胁迫后发生了补偿生长,致使复温投喂后SGR和FR逐渐上升,随后SGR和FR下降可能是因为补偿生长强度降低而引起;RF4组奥尼罗非鱼幼鱼在复温投喂后其FE仅在第1周显著高于其他试验组,在复温投喂的第2和第3周与其他试验组无显著差异,与强俊等[4]认为提高饲喂频率可使饲料转化率降低的观点不一致,可能是奥尼罗非鱼受到低温停食胁迫后,增加投喂频率具有提高FE的作用,但具体原因有待进一步探究。吉富罗非鱼的拐点体重为498.8 g/尾,且消化酶活力随着罗非鱼发育阶段的变化而波动变化[30],黄鳝[31]和草鱼[32]的消化酶活力也随着发育阶段的变化呈先上升后下降的变化趋势,而本研究中复温投喂后第3周时,FC组奥尼罗非鱼幼鱼的FE和SRG呈上升现象,可能是因奥尼罗非鱼幼鱼处于快速生长期其消化酶活力上升所引起,但具体原因有待进一步探究。
本研究中,复温投喂后RF2组奥尼罗非鱼幼鱼的2次/d投喂频率与RF1组幼鱼的4次/d间隔1 d循环投喂频率的平均每日投喂次数相同(均为2次/d),其HSI、VSI、CF及最终体重均显著低于FC组,可能与长时间胁迫使鱼体营养不足[33]、胃和腺体受到损伤[34]及复温投喂后平均2次/d的投喂频率无法满足鱼体恢复需求有关;RF2组奥尼罗非鱼幼鱼的FR和最终HSI均显著高于RF1组,可能是该投喂方式延长了鱼体受饥饿时间,导致鱼体健康未得到良好恢复,故2次/d的投喂频率不适于奥尼罗非鱼幼鱼低温停食胁迫后的生长恢复;RF3组奥尼罗非鱼幼鱼的体重、HSI和VSI等指标最终均恢复至FC组水平,但CF显著低于FC组,而RF4组奥尼罗非鱼幼鱼的各生长指标均达FC组水平,说明在低温停食后的补偿生长期间4次/d的饱食投喂频率可充分发挥奥尼罗非鱼的生长潜能,其生长指标可恢复至最佳。
3.3 奥尼罗非鱼越冬后的投喂频率建议
在罗非鱼越冬养殖生产中,水温较低时通常减少投料或停止投料[4],温度升高使奥尼罗非鱼的消化酶活性上升[35],越冬后应利用奥尼罗非鱼低温饥饿胁迫后的补偿生长特点,提高投喂频率,以提高其FR和FE,最大程度地补充鱼体越冬的消耗。在实际生产中,奥尼罗非鱼的低温停食胁迫条件与本研究低温胁迫条件存在差异,其补偿生长持续时间可能也存在差异,且饲料转化率随着投喂频率的增加而下降[4],在本研究中,FR随着补偿生长强度的下降而降低,因此,实际生产中可将复温后FR持续下降时间视为奥尼罗非鱼补偿生长结束时间。综合韩春艳等[2]、强俊等[4]的研究结果,提出奥尼罗非鱼越冬后投喂技术建议:第一阶段投喂量以饱食投喂为宜,投喂时间为9:00、12:00、15:00和18:00,以4次/d的频率投喂至其补偿生长后摄食量持续下降为止;第二阶段投喂量以体重的6 %为宜[4],投喂时间为8:00、12:00和16:00,投喂频率为3次/d,且采用投喂6 d停食1 d的投喂模式[2]。
4 结 论
奥尼罗非鱼幼鱼在低温和饥饿胁迫双重作用下依靠同时提高其FR和FE获得约3周时长的补偿生长,且在投喂频率为2次/d时发生补偿生长时滞;在补偿生长期间提高投喂频率可提高奥尼罗非鱼幼鱼的FR和FE,其中4次/d的投喂频率可使奥尼罗非鱼幼鱼SGR、FR和FE大幅提高,可恢复体重、HSI、VSI和CF,投喂效果最佳。
