富马酸氯马斯汀对大鼠高原缺氧肺损伤的影响
2020-12-08高温杰
周 坤,高温杰,李 宏
组织氧供减少或不能充分利用氧,导致组织代谢、功能和形态结构异常变化的病理过程称为缺氧。当健康人进入高海拔或其他低氧环境时,时常发生缺氧[1,2]。不能迅速适应缺氧会导致肺水肿、心脑血管功能障碍,甚至死亡[1,3-5]。肺的炎性反应被认为是缺氧肺损伤主要的病理生理机制之一。而H1受体介导的炎性反应被认为参与肺损伤的形成过程[6-8],其机制可能为激活的H1受体能加速生成活性氧簇,并诱导中性粒细胞及多种炎性因子的聚集[9]。富马酸氯马斯汀(clemastine fumarate, CLE)作为H1受体拮抗药已被证实在肺缺血再灌注损伤后可抑制多种炎性介质的表达,抑制细胞凋亡,起到肺保护作用。但其在急性高原缺氧肺损伤中能否发挥同样的作用目前仍没有确切证据。因此,本实验拟将CLE用于大鼠急性高原肺损伤模型,以探讨CLE对该模型的影响及可能机制。
1 材料与方法
1.1 试剂及仪器 富马酸氯马斯汀注射液购自华润双鹤利民药业(济南)有限公司;地塞米松磷酸钠注射液(天津金耀药业有限公司);苏木精-依红染色试剂盒、Western配胶试剂盒、DAB浓缩试剂盒(北京索莱宝科技有限公司);TRIzon总RNA提取试剂盒、cDNA反转录试剂盒、实时荧光定量聚合酶链反应试剂盒(江苏康为世纪生物科技有限公司);山羊抗兔免疫球蛋白G(IgG)二抗、IL-1β抗体、TNF-α抗体、TLR4抗体、NF-κB抗体(沈阳万类生物科技有限公司);PCR引物序列由生工生物工程公司合成。NanoPhotometer-NP80超微量紫外分光光度计(德国implen公司);ABI 7500 RT-PCR 仪(美国ABI 公司);DS850-I动物实验舱(山东潍坊华信氧业有限公司)。
1.2 动物分组及模型制备 无特定病原体级8周龄雄性SD大鼠40只,单只体重200~220 g,由中国食品药品检定研究所提供,合格证号为SCXK(京)2017-0005。适应性喂养1周后,按照随机数字表法将无特定病原体级8周龄雄性SD大鼠分为对照组(C组)、缺氧组(HH组)、地米组(DXM组)、治疗组(CLE组),每组10只。将HH组、DXM组、CLE组放入动物实验舱,设定海拔为7000 m、氧浓度为10%,DXM组从入舱前1 h开始以每6 h肌内注射2 mg/kg DXM,CLE组入舱前2 h按0.9 mg/kg肌内注射CLE,入舱10 h后追加一次用药,剂量仍为0.9 mg/kg,完成造模。对照组不进行任何干预。造模结束后立即处死大鼠,观察肺组织大体情况,而后取肺组织留用。本研究已通过武警特色医学中心伦理委员会审批。
1.3 肺湿/干重比测定 取右肺上叶,0.9%氯化钠注射液冲洗后用滤纸吸去组织表面液体,称重3次后取平均值即为湿重,随后放入65 ℃恒温烘箱中烘干48 h后称重3次,取平均值即为干重,计算肺湿/干重比。
1.4 苏木精-伊红(HE)染色 取右肺下叶,4%多聚甲醛固定48 h。经常规脱水、石蜡包埋后5 μm厚度切片,进行HE染色并在光镜下观察肺组织病理变化。
1.5 反转录聚合酶链反应(RT-PCR) 取100 mg肺组织,用Trizon提取细胞中的总RNA, 超微量紫外分光光度计测定RNA纯度,将RNA浓度标定为1000~2000 ng/μl,A260/A280标定在1.8~2.0,A260/A230>2;根据反转录试剂盒说明书进行反转录反应,以反转录所得cDNA为模板,进行RT-PCR实验。反应条件:95 ℃条件下预变性10 min,然后95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸32 s,共计40个循环。以β-actin为内参,以2-ΔΔCt来表示mRNA相对表达量。各引物序列见表1。

表1 RT-PCR引物序列
1.6 蛋白质印迹法(Western blot,WB) 在1 ml RIPA组织细胞裂解液中分别加入蛋白酶抑制剂和磷酸酶抑制剂各1 μl,取适量肺组织,提取总蛋白,用Bradford法蛋白浓度测定试剂盒测定浓度并定量。用SDS-聚丙烯酰胺凝胶电泳法分离蛋白,以80 V恒压电泳45 min至上层胶结束后继续以120 V恒压电泳至下层胶结束。4 ℃层析冷柜中90 V恒压下转膜60 min,将蛋白转至聚偏二氟乙烯膜上。PVDF膜于3%脱脂奶粉中封闭3 h。漂洗后加一抗(β-actin 1∶1 000、IL-1β 1∶300、TNF-α 1∶500、TLR4 1∶500、NF-κB 1∶500)4 ℃条件下孵育过夜。TBST再次漂洗后室温下加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶10 000)孵育2.5 h,漂洗后显影。用Image Lab软件分析条带灰度值,以目的蛋白与内参β-actin蛋白灰度值的比值表示目的蛋白相对表达量。

2 结 果
2.1 各组大鼠肺组织湿/干重比结果比较 HH组大鼠肺组织湿/干重比明显高于其余3组,差异有统计学意义(P<0.05);DXM组和CLE组大鼠肺组织湿干比比较差异无统计学意义(图1)。

图1 四组大鼠肺组织湿/干重比结果比较(n=10)
2.2 各组大鼠肺组织病理学改变 肺组织大体标本观察:C组大鼠肺组织表面光滑、完整;HH组大鼠肺组织可见水肿明显,表面可见散在点、片状出血灶:DXM组和CLE组大鼠肺组织标本可见轻微水肿,表面偶见点状出血灶。肺组织HE染色后观察:C组肺组织无明显病理改变;HH组肺组织可见大量炎性细胞浸润,肺泡壁毛细血管扩张、充血明显,肺泡间隔增厚,肺泡结构破坏无序、不张、融合、塌陷;DXM组和CLE组损伤程度较HH组轻(图2)。
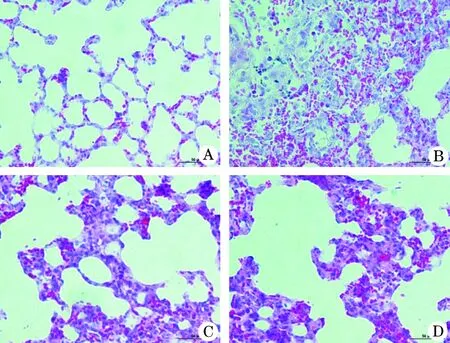
图2 四组大鼠肺组织病理学检测结果比较(HE,×400)
2.3 IL-1β、TNF-α、TLR4和NF-κB mRNA表达的比较 与C组相比,HH组中IL-1β、TNF-α、TLR4和NF-κB mRNA转录水平均明显升高(均P<0.05)。与HH组相比,DXM组和CLE组中IL-1β、TNF-α、TLR4和NF-κB 的mRNA转录水平均明显降低(均P<0.05,表2)。

表2 四组大鼠肺组织IL-1β、TNF-α、TLR4和NF-κB mRNA表达量比较
2.4 IL-1β、TNF-α、TLR4和NF-κB 蛋白表达的比较 与C组相比,HH组中IL-1β、TNF-α、TLR4和NF-κB 蛋白表达水平均明显升高,差异有统计学意义(P<0.05)。与HH组相比,DXM组和CLE组中IL-1β、TNF-α、TLR4和NF-κB 蛋白表达水平均明显降低,差异有统计学意义(P<0.05,图3,表3)。

图3 四组大鼠肺组织中IL-1β、TNF-α、

表3 四组大鼠肺组织IL-1β、TNF-α、TLR4和NF-κB 蛋白表达量比较
3 讨 论
本研究使用实验动物舱模拟大鼠在7000 m海拔环境下机体缺氧状态24 h后,肺组织W/D较C组明显升高,病理学较C组发生明显损伤性改变,提示造模成功。本研究根据CLE使用说明书所提供药物使用剂量及血药浓度达峰时间,按照体表面积进行换算后,确定CLE的给药剂量。本研究结果表明,给与CLE后,大鼠肺组织W/D较HH组明显降低,肺组织病理损伤较HH组明显减轻,缺氧引起的细胞通路蛋白及炎性因子的mRNA及蛋白表达均明显降低,提示CLE可减轻高原缺氧引起的肺损伤。而文献[10]表明DXM是迄今为止预防和治疗高原缺氧肺损伤炎性反应最常用的药物,本研究发现,DLE的治疗作用与DXM相当。
根据高原缺氧肺损伤的经典病理生理学理论,急性缺氧引起肺部血管收缩,导致肺部血液重新流入收缩较小的血管(即导致“应力衰竭”)和肺泡-毛细血管屏障的物理破坏。同时,缺氧可以通过激活肺泡巨噬细胞中的TLR4信号通路来加剧肺损伤的炎症反应,并在肺损伤的发展过程中进一步破坏肺泡-毛细血管屏障[11]。
TLR4是一种跨膜蛋白,主要分布于单核巨噬细胞表面,属于膜识别受体家族,活化后可介导并参与细胞内信号传导通路诱导炎性细胞出现相关免疫应答,是参与免疫应答的关键调节因子[12]。TLR4在桥接缺氧和炎症之间的相互作用中起着至关重要的作用[11]。NF-κB作为TLR4通路下游的分子,是一种重要的转录因子,可特异性结合多种基因启动子中的κB位点,调控免疫应答及多种炎性介质基因的表达[13]。NF-κB在生理状态下与其抑制蛋白IκB结合以无活性状态存在于细胞质中[14,15],当TLR4被激活后,使IκB激酶激活,促使激活的NF-κB进入细胞核并激活炎症信号通路,引起TNF-α、IL-1β等多种炎性因子表达[14],启动机体的免疫应答。也有研究报道TLR4通过髓样分化应答基因依赖性通路的激活最终诱导NF-κB活化产生TNF-α、IL-1β等促炎因子加重肺损伤[16]。另有研究表明,NF-κB还可作为缺氧应答转录因子[17]直接调节炎性细胞反应继而参与肺损伤过程[18]。因此,TLR4/NF-κB通路作为组织缺氧和急性肺损伤的中央环节,在缺氧肺损伤后的炎症发生发展过程中起着重要的作用。本研究结果也提示,HH组肺组织中IL-1β、TNF-α、TLR4和NF-κB mRNA转录水平及蛋白表达水平较C组明显升高。
H1受体是组胺受体的一种亚型,在支气管平滑肌和肺内皮细胞高表达。H1受体属于G蛋白偶联受体家族,其激活可通过Gαq/11和Gβγ亚基介导NF-κB活化,同时,还可通过上调TLR4的表达活化NF-κB[19,20]。CLE作为新型二代抗组胺药已广泛用于临床。本研究试图通过已知机制,来论证CLE是否具有减轻高原缺氧造成的肺损伤。研究结果显示,CLE可以明显减轻大鼠缺氧后肺水肿程度,IL-1β、TNF-α、TLR4和NF-κB mRNA转录水平及蛋白表达水平较HH组有明显降低,且降低程度和DXM组相当,CLE组和DXM组组间比较未见统计学差异,说明CLE的疗效和DXM相仿。
综上所述,本研究通过构造高原缺氧肺损伤大鼠模型,从抑制组胺受体活化以抑制炎性反应的角度探讨了CLE的肺保护作用,发现CLE可能是通过抑制TLR4/NF-κB通路从而抑制肺的炎性反应。提示我们未来CLE作为高原缺氧肺损伤治疗药物的可能性。
