阿司匹林抗肿瘤研究进展
2020-12-08严晨强综述审校
严晨强 综述 黄 河 审校
阿司匹林(aspirin,acetylsalicylic acid,ASA)化学名为乙酰水杨酸,是非甾体类抗炎药,现已被广泛使用。1852年蒙彼利埃大学化学教授Charles Gerhart 发现了水杨酸分子结构,利用水杨酸与醋酐进行了合成,由于其纯度低且不稳定未能引起重视[1]。1897年,Felix Hoffmann首次合成了ASA并纯化[2]。1899年Felix Hoffman合成的乙酰水杨酸被注册为“Aspirin”并开始用于临床[1]。我国于1958年开始生产。随着研究的逐渐深入, ASA被广泛用于镇痛、抗炎、退热、心血管疾病、内分泌疾病、肿瘤领域等。ASA与肿瘤的关系已有较多研究,叶华等[3]的一项Meta分析表明,结直肠癌患者长期口服小剂量ASA可能有助于改善预后。长期服用可导致消化道不良反应,但长期隔日服用不仅能减少不良反应,还使其抗肿瘤的净效益增加[4]。食管癌、胃癌、胆管癌、胰腺癌、前列腺癌、乳腺癌、卵巢癌、和肺癌等肿瘤中都发现了ASA的抗肿瘤作用[5,6]。笔者对ASA抗肿瘤作用及机制进行综述。
1 抗肿瘤经典途径
ASA可通过环氧酶 (cyclooxygenase,COX)、NF-κB/IκB、Bax/Bcl-2、TRAIL、诱导自噬、氧化应激等途径发挥抗肿瘤作用。
1.1 COX
1.1.1 COX COX有三种同工酶。COX-1位于正常组织,有保护消化道黏膜、调节血小板聚集(通过TXA2)、调节血管张力(通过PGI2)、调节肾血流量的作用[7]。COX-2存在于中枢神经、肾脏、炎性反应区,具有生成致炎物质的作用[8]。COX-3在不同组织中表达不同,研究发现其在疼痛中扮演重要角色[8]。
1.1.2 ASA对COX作用[8]低浓度ASA导致COX活性中心的丝氨酸乙酰化失活,该过程不可逆,TXA2生成减少,血小板聚集及血栓形成受到抑制,从而产生抗凝作用。高浓度ASA能抑制血管壁中COX,减少PGI2生成。
1.1.3 ASA抑制COX-2抗肿瘤 COX-2可使人骨髓细胞、人乳腺癌和结肠癌中花生四烯酸转化为PGE2[9,10]。PGE2通过活化磷脂酰肌醇-3激酶/蛋白激酶B(Phosphatidylinositol 3 kinase/protein kinase B,PI3K/Akt)、c-Jun氨基末端激酶(C-jun amino-terminal kinase,JNK)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)启动致癌信号通路,刺激肺癌细胞生长[11]。ASA抑制COX-2,减少PGE2的生成和抑制丝裂原活化蛋白激酶 (Mitogen-activated protein kinase,MAPK) 的活性,可使肝癌细胞增殖受到抑制[12]。COX-2在40%~50%的良性息肉和80%~90%的腺癌中过表达,ASA可抑制COX-2,降低结肠癌发生[13]。体外实验发现ASA通过抑制COX-2 能够下调PI3K信号通路的活性,并能改善PIK3CA突变结直肠癌患者的预后[14],降低特异性死亡率[14]。COX-2抑制剂可降低结直肠癌、子宫内膜癌、卵巢癌、宫颈癌等多种肿瘤的发病率[15]。另外,COX-2通过整合素avβ3,基质金属蛋白酶 (Matrix metalloproteinases ,MMPs) 合成,VEGF、bFGF等血管生成因子的表达等途径,促进肿瘤血管的生成,ASA抑制COX-2可能是预防胃癌的机制之一[16,17]。
1.1.4 ASA抑制COX-1抗肿瘤 肿瘤细胞脱离原发肿瘤进入循环并受剪切力和免疫攻击,大多数被NK细胞破坏,也有一些会触发血小板活化并形成保护性的“血小板涂层”[18]。血小板聚集可使肿瘤细胞逃避免疫系统监测,又被称为肿瘤细胞诱导血小板聚集(Tumor cells induce platelet aggregation,TCIPA)[19]。COX-1存在于血小板使其合成TXA2,TXA2促进血小板聚集[20]。COX-1可促进血小板的激活,活化的血小板产生转化生长因子-β(Transforming growth factor-beta,TGF-β)、白细胞介素-1β(interleukin-1β,IL-1β)等细胞因子与炎性因子可促进肿瘤细胞生长、转移及血管生长,协助肿瘤细胞逃脱免疫杀伤[21]。ASA通过抑制COX-1的活性,使血小板的活化和聚集受抑制,从而发挥抑制癌细胞转移的作用[22]。上皮-间充质转变 (epithelial-mesenchymal transition,EMT)在肿瘤浸润和转移过程中发挥重要的作用,结肠癌在浸润和转移过程中,癌细胞逐渐失去上皮特性,同时获得间充质细胞的表型特征,发生EMT[23]。ASA通过上调E-钙黏蛋白(E-cadherin)表达,下调N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、Snail1表达抑制结肠癌HT-29细胞EMT,从而抑制其迁移及侵袭能力[23]。
1.2 NF-κB/IκB 通常NF-κB与NF-κB抑制蛋白(IkB)结合以非活性的形式存在,NF-κB激活后诱导抗细胞凋亡基因表达(图1)。肿瘤坏死因子(Tumor necrosis factor,TNF)等磷酸化并降解IκB,NF-κB的核定位信号被暴露,并迅速转移到细胞核内,与特异性κB序列结合,诱导相关基因转录。其活化可影响许多前炎性介质如TNF-α、IL-8及COX-2等合成和释放[24]。在人类癌细胞模型、大肠癌细胞中ASA可以抑制NF-κB核易位促进肿瘤细胞凋亡[25-27]。NF-κB还可改变IκB激酶 (IKK)、ERK、p38MAPK、细胞周期依赖性蛋白激酶 (cell cycle-dependent protein kinases,CDKs)的活性,抑制肿瘤细胞生长[28]。
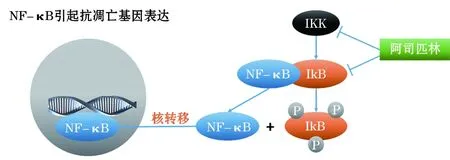
图1 NF-κB引起抗凋亡基因表达
NF-κB与IkB结合后失活,IKK可磷酸化IkB,IkB与NF-κB分离,NF-κB进入细胞核并引起抗凋亡基因表达。ASA与IκB结合阻止其被IKK磷酸化,也可与IKK-2结合抑制其活性,NF-κB不能进入细胞核,从而促进肿瘤细胞凋亡
1.3 Bcl-2 B细胞淋巴瘤/白血病-2基因(B cell lymphoma/leukemia-2,Bcl-2)家族抗凋亡成员有Bcl-2、Bcl-xL、Bcl-w、Bcl-B、Mcl-1、A1,促凋亡成员有Bax、Bak、Bok、Bid、Bim、Bik、Bad、Bmf、Hrk、Noxa、Puma[29]。Bcl-2通过增强线粒体膜电位,抑制钙离子的跨膜移动,从而使核酸内切酶无法活化,抑制细胞凋亡[30]。Bax基因通过直接激活死亡效应因子半胱氨酸天冬氨酸特异性蛋白酶 (cysteine-containing aspartate-specific proteases,caspases) ,或改变细胞膜通透性引起细胞色素C释放,伴有细胞膜通透一些离子以及小分子物质而促进细胞凋亡[30]。总之,Bcl-2和Bax两者通过特定比例调控肿瘤凋亡。Bcl-2处于高表达时,抑制细胞凋亡,而当Bax高表达时,促进细胞凋亡[31]。ASA在控制多发性骨髓瘤、卵巢癌的发生发展中,通过上调Bax基因、抑制Bcl-2基因活性也是其主要机制之一[31]。ASA促使结肠癌SW480细胞Bax表达上调, Bcl-2表达下调,从而抑制SW480细胞的增殖、迁移和侵袭能力[32]。ASA可使人小细胞肺癌A549细胞中Caspase-3活化,引起凋亡[33]。
1.4 TRAIL 肿瘤坏死因子相关诱导凋亡配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)与死亡受体4(Death receptor 4,DR4)和死亡受体5(Death receptor 5,DR5)结合时引起肿瘤细胞凋亡而对大多数正常细胞呈低毒性[34]。尤其DR5受体广泛表达于黑色素瘤、食管癌、直肠癌等肿瘤组织而在正常组织细胞中几乎不表达[33]。TRAIL介导的凋亡信号通路包括外源性通路(死亡受体凋亡通路)和内源性通路(线粒体凋亡通路)[34],见图2。实验表明,ASA可增强TRAIL诱导的肝癌SMMC-7721细胞、Hep G-2细胞凋亡作用[33]。ASA通过增强DR5的表达、引起DR5聚集、激活凋亡信号的转导途径,促进食管癌细胞凋亡[30]。干扰素及一些化疗药物这类因素,通过提高DR5的表达增加细胞对TRAIL诱导凋亡的敏感性[30]。
1.5 自噬 自噬又称为Ⅱ型程序性细胞死亡,生物膜包裹待分解物形成自噬体,运送到溶酶体后形成自噬溶酶体,胞质中绝大多数物质被分解,以满足细胞的代谢和某些细胞器更新的需求[35]。在肿瘤细胞中,自噬早期阶段通过清除肿瘤细胞内异常折叠的蛋白、功能异常的细胞器 (线粒体),抑制细胞应激反应,防止基因组损伤从而抑制癌症发生,自噬在后期阶段可促进肿瘤细胞存活,协助免疫逃逸[35]。mTOR是真核细胞启动自噬中一个关键的抑制性调节因子,受多条通路调节,激活mTOR的通路如Akt和MAPK信号通路,负调控mTOR的通路如AMPK和p53信号通路[36]。ASA通过激活AMPK促进肿瘤细胞的自噬和凋亡的[35]。结直肠癌细胞模型中,ASA对结肠直肠癌AMPK/mTOR信号通路的多个组成部分产生作用,涉及mRNA稳定性、细胞周期、自噬、蛋白质翻译和核糖体生物发生的细胞通路,ASA通过抑制mTOR和激活AMPK来诱导自噬[37],见图3。
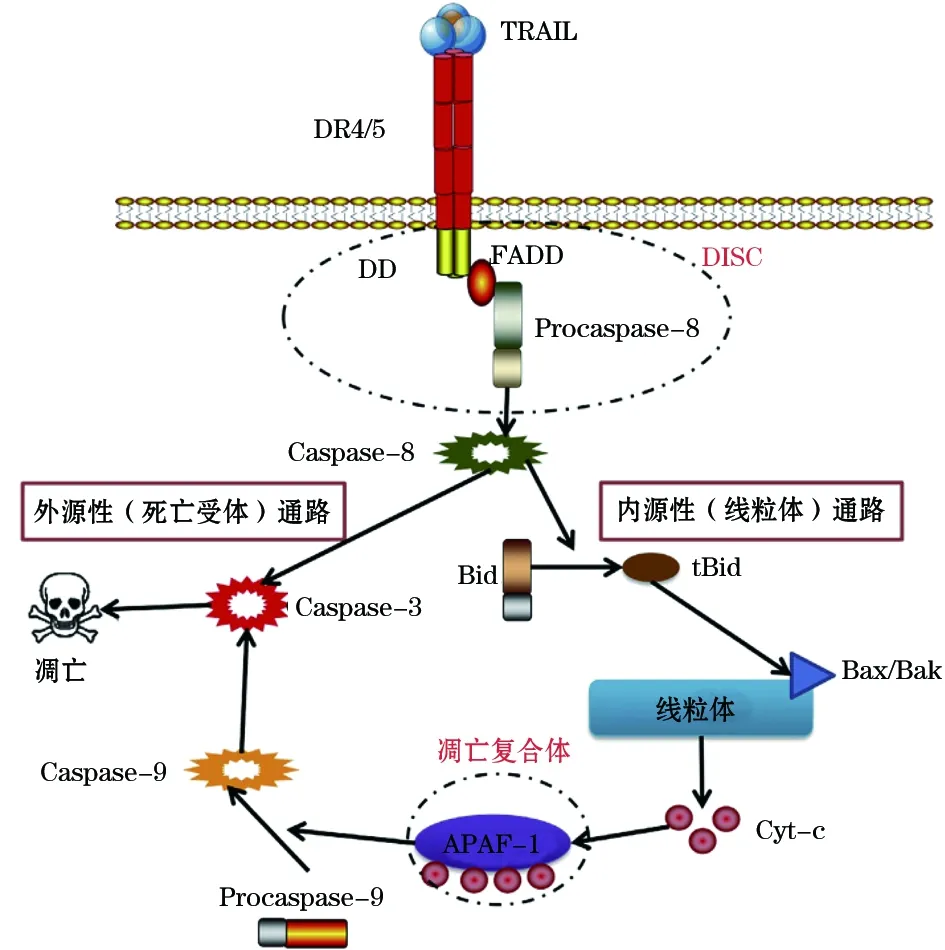
图2 肿瘤细胞中TRAIL诱导凋亡[34]
1.6 稳定MMR DNA修复途径其中之一是DNA错配修复(mismatch repair,MMR)系统。该系统由蛋白质复合物组成,对突变损伤有反应,在不利条件下能够直接修复错配碱基或者触发程序性死亡[28]。研究表明ASA可以减少肿瘤组织中遗传异常的积累[38]。在结直肠癌中,ASA可增加MMR的稳态水平,防止基因异常的累积[28]。ASA在MMR丰富的细胞中能诱导更多的细胞凋亡,表明ASA通过减少细胞突变预防肿瘤的产生[28]。
1.7 氧化应激 通过内源性途径如线粒体、过氧化物酶体、细胞色素P450,外源性途径如紫外线、放射线炎性细胞因子、病原体等产生具有细胞毒性的氧源物质,如超氧自由基、过氧化氢、单线态氧和羟基自由基,这类物质可提高氧化应激水平,通过损伤ASA增加AMPK和ULK1的磷酸化。ASA降低S6K1、S6和4E-BP1的磷酸化来抑制mTOR信号通路。TSC1/2:结节性硬化蛋白1/2;raptor:哺乳动物雷帕霉素靶蛋白的调控相关蛋白;ACC:乙酰辅酶A羧化酶;AMPK:腺苷一磷酸活化蛋白激酶;CRC:结肠直肠癌;eIF4E:真核翻译起始因子4E;4E-BP1:4E,结合蛋白1;HuR :人类抗原R;LC3:轻链3;MEF:小鼠胚胎成纤维细胞;mTOR:雷帕霉素的机械靶点;NDRG1:N-myc下游调节1;NSAID:非甾体类抗炎药;PBS:磷酸盐;PI3K:磷脂酰肌醇-3-激酶;siRNA:小干扰RNA;S6:S6核糖体蛋白;S6K1:S6核糖体蛋白激酶1核酸、蛋白质、脂类导致染色体不稳定、突变、细胞器功能丧失、膜损伤,促使癌症发生[39]。细胞内活性氧(reactive oxygen species,ROS)通过调节相关信号通路导致EMT,促进肿瘤细胞转移[40]。ROS介导NF-κB 、转录因子3 (activating transcription factor 3,ATF3) 的激活和DNA损伤在诱导肿瘤细胞凋亡中起到重要作用[16]。由巨噬细胞、肿瘤相关成纤维细胞、缺氧、衰老成纤维细胞、癌细胞组成的肿瘤微环境促进氧化应激的形成,导致肿瘤进展[41]。在肝炎导致肝癌的发生过程中,肝炎病毒基因表达,通过氧化应激产生DNA损伤、激活细胞激酶和转录因子,导致肝细胞癌的发生[39]。癌细胞有肿瘤抑制基因突变时会逃避ROS诱导的细胞衰老或死亡,出现不可控的增殖[40]。ASA可以诱导ROS的产生,促进氧化应激、细胞凋亡和进一步阻碍线粒体呼吸功能,从而产生细胞毒性反应[42]。结直肠癌发生过程中与ROS过量产生有密切关系,抗氧化剂,如γ-生育酚,生育三烯醇和ASA,可以减少氧化应激和ROS的过量产生[43]。另外,一氧化氮释放型ASA(NO-ASA)由酯键与NO供体基团连接,释放的NO引起氧化应激诱导癌细胞凋亡[44]。NO-ASA有望成为结肠癌和其他癌症的防治药物[45]。

图3 ASA激活AMPK抑制mTOR诱导结直肠癌细胞自噬[37]
1.8 其他 E-cadherin广泛存在于上皮细胞中维持细胞形态和细胞黏附,但在肿瘤细胞中表达降低,肿瘤侵袭力增强[46]。ASA可上调E-cadherin表达水平,抑制结肠癌细胞EMT的发生[46]。实验表明肝癌组织经ASA治疗后E-cadherin表达明显增加,肺转移节结数明显减少[46]。激活蛋白-1(Activated protein -1,AP-1)促进肿瘤形成,而谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)属于解毒酶,ASA通过抑制AP-1,增强GST-θ,有预防癌的形成的作用[47]。
2 对肿瘤细胞糖代谢的影响
ASA降低糖代谢,18F氟脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)在体内的生物学行为与葡萄糖类似[48]。研究显示ASA可降低结肠癌患者肿瘤细胞对18F-FDG的摄取率,具体机制尚不明确。缺氧可诱导人结肠癌细胞株HCT116停滞于G0/G1期,减少其早期凋亡,増加迁移和侵袭能力。随着缺氧时间的延长,HCT116中乙醛脱氢酶-1(Acetaldehyde dehydrogenase-1,ALDH-1)阳性细胞相对活力数有所增加。缺氧还可促进结肠癌细胞萄糖代谢相关载体葡萄糖转运蛋白-1(Glucose transporter protein-1,Glut-1)在蛋白和mRNA水平的表达。ASA可部分逆转上述缺氧诱导的HCT116生物学行为的改变,如ASA可抑制缺氧诱导的G0/G1期细胞周期停滞而促进早期凋亡,降低迁移和侵袭能力;减少缺氧诱导的ALDH-1阳性细胞数及Glut-1的表达。ASA作用于COX-2靶点可能与以上生物学行为的改变有关。
3 对机体免疫系统的影响
3.1 增效免疫治疗 皮肤癌,乳腺癌和大肠癌细胞可产生大量PGE2,能减弱免疫系统对病变细胞的正常应答,肿瘤因此快速增殖[49]。ASA抑制PGE2 的产生免疫系统被重新唤醒[49]。将免疫疗法与ASA或其他COX抑制剂联合使用比单独使用免疫疗法更能抑制小鼠体内大肠癌或黑色素瘤的生长[49]。
3.2 钙网蛋白 其在肿瘤细胞的表面表达比正常的细胞多[50]。钙网蛋白与固有免疫细胞,如巨噬细胞,树突状细胞等的表面受体CD91/l RP1结合,增强免疫系统对肿瘤细胞的免疫应答[50]。通过诱导剂使人肝癌细胞Hep G2高表达钙网蛋白,从而产生更高的免疫原性,使免疫系统更好地杀伤和清除肿瘤细胞[50]。
3.3 人白细胞-DR抗原(HLA-DR) 结肠癌形成中HLA-DR低表达有利于逃避免疫监视。Arvind等[51]用ASA、消炎痛及苏灵达诱导HT-29细胞表达HLA-DR α,从而调节肿瘤患者的免疫功能。
3.4 细胞因子平衡 免疫细胞及相关细胞因子在肿瘤发生中起重要作用。IL-10抑制细胞免疫,而IL-12可增强细胞免疫起到抗肿瘤作用。PGE2可以调节淋巴细胞以及巨噬细胞产生的IL-10和IL-12之间的平衡,增加IL-10以及减少IL-12产生,促进肿瘤发生。ASA可恢复此平衡,增强T细胞介导的免疫应答,起到预防肿瘤形成的作用[5]。
3.5 Fas/FasL 自杀相关因子(factor associated suicide,Fas)即CD95,是一种跨膜糖蛋白,与程序性细胞死亡 (programmed cell death,PCD) 密切相关。Fas在体内的组织细胞,如激活的T细胞、B细胞、单核细胞、中性粒细胞等中广泛表达。细胞表面的Fas与FasL配体结合,细胞内caspase8被活化,从而启动细胞凋亡机制。免疫细胞表达的Fas与肿瘤细胞表达的FasL结合后,通过Fas/FasL信号传导途径,免疫细胞凋亡,肿瘤细胞从而逃避免疫杀伤[52]。ASA降低结肠癌SW-480细胞Fasl蛋白表达后淋巴细胞凋亡率明显降低[53]。ASA通过诱导Fas表达、下调FasL表达抑制结肠癌细胞Caco-2细胞增殖,促进凋亡[54]。ASA能直接与细胞核中的p300相互作用,促进H3K9乙酰化,激活FasL表达,诱导结肠直肠肿瘤干细胞的凋亡[55]。
ASA在解热、镇痛、抗炎、心血管疾病等方面的应用已被人熟知,其在抗肿瘤方面的作用逐渐被发现,抗肿瘤机制研究也在逐步深入。抗肿瘤机制与其对COX的药理作用密切相关,同时非COX途径如NF-κB/IκB、Bax/Bcl-2、TRAIL、诱导自噬、氧化应激等也是ASA抗肿瘤的重要途径。近年来还发现,ASA通过降低糖代谢诱导结肠癌细胞凋亡,增强免疫系统功能促进杀伤肿瘤细胞。研究表明,糖尿病大鼠服用ASA后TNF-α的释放减少,胰岛素敏感性增强,证明ASA具有胰岛素增敏作用,可改善胰岛素抵抗,纠正脂质代谢紊乱,抑制炎性因子释放。但ASA影响内分泌系统后是否对肿瘤细胞产生作用仍需进一步研究[56]。ASA抗肿瘤机制、对机体及肿瘤细胞代谢的影响也需要进一步探究。总之,ASA有望早日在临床方面应用于肿瘤的预防和规范化辅助治疗。
