大高良姜地下根茎挥发油化学成分及体外药理活性研究
2020-12-03陆廷亚赵晓歌田民义
陆廷亚,陈 琪,赵晓歌,韦 凤,洪 怡,支 青,田民义,*
1贵州大学酿酒与食品工程学院 贵州省药食同源植物资源开发工程技术研究中心;2贵州大学生命科学学院,贵阳 550025
大高良姜Alpiniagalanga(L.) Willd.是姜科山姜属多年生草本植物,果实入药称为红豆蔻,收载于2015版《中国药典》。其味辛,性温,有散寒燥湿、醒脾消食之功效[1]。大高良姜地下根茎在印度、菲律宾及马来西亚等地区可用作香料和调味品,既可食用又可药用,用于治疗糖尿病、风湿病、哮喘、炎症及胃痛等疾病[2-5]。大高良姜地下根茎富含挥发油,且已经用于香水、化妆品和药品中[5-7]。现代药理研究表明,大高良姜地下根茎具有抗氧化、抗菌、抗肿瘤、抗溃疡及抗过敏等药理活性[8-13]。目前国内关于大高良姜的研究主要集中在其果实部位,对其地下根茎挥发油的化学成分及体外药理活性报道较少。所以,本实验主要通过分析大高良姜地下根茎挥发油的化学成分,并对其体外药理活性进行筛选,以期为国内大高良姜地下根茎的进一步开发利用提供理论基础。
1 仪器与材料
1.1 仪器与试剂
HP6890/5975C GC/MS联用仪(美国安捷伦公司);多功能酶标仪、细胞培养箱、超低温冰箱(Thermo公司);冷冻离心机(上海力伸科学仪器公司);FA1104 电子分析天平(上海郎平仪器仪表有限公司);HWS-150 恒温恒湿培养箱(北京科伟永兴仪器有限公司);SW-CJ-1FD 超净工作台(苏州净化设备有限公司);LDZX-30KBS 高压灭菌锅(上海中安医疗器械厂);RE-3000 旋转蒸发仪(上海亚荣生化仪器厂);UV-5200紫外可见分光光度计(上海元析仪器有限公司)。
RP-MI-1640培养基(GIBCO公司);二甲基亚砜(DMSO)(鼎国生物制剂有限公司);DPPH、ABTS、α-葡萄糖苷酶、L-酪氨酸酶、乙酰胆碱酯酶、丁酰胆碱酯酶(美国Sigma公司);营养肉汤、营养琼脂(上海博微生物科技有限公司);沙氏葡萄糖琼脂培养基、沙氏葡萄糖培养基(杭州百思生物技术有限公司);刃天青(大连美伦生物技术有限公司);抗生素药敏纸片(杭州微生物试剂有限公司);实验所用水均为蒸馏水,其余试剂均为分析纯。
1.2 实验材料
实验用大高良姜2018年12月采购于广西省玉林市,由贵州大学胡国雄教授鉴定为姜科山姜属大高良姜Alpiniagalanga(L.) Willd.,标本保存于贵州省药食同源植物资源开发工程技术研究中心。菌株:大肠杆菌(EscherichiacoliATCC 25922);白色念珠菌(CandidaalbicansBNCC 186335);金黄色葡萄球菌(StaphylococcusaureusATCC 6538P);铜绿假单胞杆菌(PseudomonasaeruginosaCMCC (B) 49027);枯草芽孢杆菌(BacillussubtilisCMCC (B) 63501);变形杆菌(ProteusvulgarisCMCC (B) 49027)。人肺癌细胞株A549、人白血病细胞株K562、人前列腺癌细胞株PC-3 和小鼠成纤维细胞株L929均购于中国昆明细胞库。
2 实验方法
2.1 挥发油的制备
取新鲜大高良姜地下根茎,洗净、切片、晒干、粉碎,称取药粉约300 g,置于5 L圆底烧瓶中,加入3 L蒸馏水,浸泡过夜,水蒸汽蒸馏5 h,收集馏出液,无水硫酸钠除水,得到淡黄色有香气的大高良姜根茎挥发油,提取率为0.43%,密封保存于4 ℃冰箱备用。
2.2 挥发油化学成分的GC-MS分析
GC参数设置:色谱柱选用HP-5MS(60 m×0.25 mm,0.25 μm)弹性石英毛细管柱,初始温度为70 ℃,保持2 min,然后以2 ℃/min升温至180 ℃,再以10 ℃/min升温至310 ℃,保持6 min,最终运行时间为76 min;进样体积为1 μL;汽化室温度为250 ℃;载气为氦气(纯度为99.999%);柱前压为18.47 psi,载气流量为1 mL/min,分流比为10∶1,溶剂延迟时间为6 min。
MS参数设置:离子源为EI源;离子源温度为230 ℃;四极杆温度为150 ℃;电子能量为70 eV;发射电流为34.6 μA;倍增器电压为1 847 V;接口温度为280 ℃;质量范围为29~450 amu。
2.3 挥发油的抗氧化活性测定
2.3.1 清除DPPH自由基能力测定
参照文献[14],称取19.7 mg DPPH(1,1-二苯基-2-三硝基苯肼)加无水乙醇配制成浓度为1 mmoL/L的溶液,避光保存备用。使用时将其稀释为0.08 mmoL/L的DPPH溶液。取大高良姜地下根茎挥发油加无水乙醇溶解并配制成一定浓度的供试品溶液。取2 mL供试品溶液与2 mL DPPH溶液置于具塞试管中,混匀后室温避光放置30 min,在酶标仪517 nm处测定吸光度AS;同时测定2 mL供试品溶液与2 mL无水乙醇的吸光度AR,2 mL无水乙醇与2 mL DPPH 溶液的吸光度A0。以Ascorbic acid和BHT作为阳性对照药,结果重复三次,取平均值。按公式计算清除率:DPPH自由基清除率= [1-(AS-AR)/A0] × 100%。
2.3.2 清除ABTS自由基能力测定
参照文献[14],将50 mL 0.7 mmol/L ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)溶液与 50 mL 2.4 mmol/L过硫酸钾(K2S2O8)溶液混合,室温避光放置12~18 h,制得ABTS储备液。使用前将其用无水乙醇稀释成工作液,使其在734 nm波长下的吸光度为0.70±0.02。取大高良姜地下根茎挥发油加无水乙醇溶解并配制成一定浓度的供试品溶液。取0.4 mL供试品溶液与4 mL ABTS溶液置于具塞试管中,混匀后室温避光放置10 min,在酶标仪734 nm处测定吸光度AS;同时测定0.4 mL供试品溶液与4 mL无水乙醇的吸光度AR,0.4 mL无水乙醇与4 mL ABTS溶液的吸光度A0。以抗坏血酸和BHT作为阳性对照药,结果重复三次,取平均值。按公式计算清除率:ABTS自由基清除率= [1-(AS-AR)/A0] × 100%。
2.4 挥发油的抗菌活性测定
2.4.1 菌悬液的制备
将金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、大肠杆菌、变形杆菌分别接种于营养琼脂平板上,白色念珠菌接种于沙氏琼脂平板上,于37 ℃恒温恒湿培养箱中培养18~20 h 活化,备用。使用时,挑取平板上形态相同的菌落,放入已灭菌的液体培养基中,在恒温培养振荡器中震荡24 h,然后取一定量菌悬液逐倍稀释后涂布到平板上,培养后统计菌落数,按照稀释的倍数与接种量计算含菌量。使用时,将菌悬液稀释至所需浓度。
2.4.2 抑菌圈的测定
参照文献[15],采用滤纸片扩散法,滤纸片大小为6 mm。先将含20 μL挥发油样品和含20 μL(100 μg/mL)链霉素滤纸片轻轻放置于已均匀涂布100 μL(1×106CFU/mL)菌液的固体培养基上。在37 ℃恒温培养箱中培养24 h后观察菌的生长情况,测量抑菌圈的直径,结果重复三次,取平均值。
2.4.3 最小抑菌浓度(minimal inhibitory concentration,MIC)和最小杀菌浓度(minimal bactericidal concentration,MBC)的测定
参照文献[15],在96孔培养板中,首先每孔加入100 μL的半倍稀释的样品和对照品溶液,然后每孔加入100 μL菌液(1×106CFU/mL)。在37 ℃恒温培养箱中培养24 h后,每孔加入20 μL(0.1 mg/mL)刃天青显色剂,继续放入恒温培养箱中培养2 h后,观察结果,记录数据。以微孔中颜色变化指示菌株抑制情况,以蓝色孔的最小样品浓度为MIC。从蓝色孔浓度样品取出100 μL,均匀涂布在固体培养基上,在37 ℃恒温培养箱中培养24 h后,未出现菌落的最小样品浓度即为MBC值,结果重复三次,取平均值。试验所有操作均在无菌条件下进行。
2.5 挥发油的抗肿瘤活性测定
参照文献[15],选用对数期的贴壁细胞,胰酶消化后,用含10%胎牛血清的RPMI 1640培养基配制细胞悬液,80 μL接种于96孔板,密度为5×104个/mL,培养24 h。将待测样品和阳性对照用DMSO溶解后,用培养基稀释成5个浓度梯度。每孔加入20 μL样品溶液,阴性对照组为等体积的培养基,每组设5个平行孔,培养72 h后,加10 μL MTT(5 mg/mL),37 ℃ 5% CO2培养4 h。取出96孔板,吸掉培养基上清液。加入DMSO 150 μL,振荡10 min,使DMSO完全溶解MTT反应的产物。用酶标仪读取490 nm波长下的OD值,结果重复三次,取平均值。抑制率的计算公式如下:细胞株抑制率= [1-(样品组OD值-调零孔OD值)/(对照组OD值-调零孔OD值)] × 100%。
2.6 挥发油的酶抑制活性测定
2.6.1 酪氨酸酶抑制活性测定
参照文献[15],以L-酪氨酸为底物测定酪氨酸酶的活性,以熊果苷(arbutin)为阳性对照,在96孔板上进行活性检测。反应体系为:先加入70 μL样品溶液,再加入100 μL酪氨酸酶(100 U/mL),37 ℃恒温孵育5 min,然后加入80 μL底物(5.5 mmol/L),37 ℃恒温孵育30 min,在492 nm波长下测定吸光度值(A值)。样品组A1、样品空白组A2、阴性组A3、空白组A4、结果重复三次,取平均值。抑制率的计算公式如下:酪氨酸酶抑制率= [1-(A1-A2)/(A3-A4)] × 100%。
2.6.2α-葡萄糖苷酶抑制活性测定
参照文献[15],以4-硝基酚-α-D-吡喃葡萄糖苷为底物测定α-葡萄糖苷酶的活性,以阿卡波糖(acarbose)为阳性对照,在96孔板上进行活性检测。反应体系为:60 μL缓冲液(pH=6.8)中加入30 μL一定浓度的样品溶液,加入10 μLα-葡萄糖苷酶(0.8 U/mL),37 ℃恒温孵育15 min,然后加入10 μL底物(1 mmol/L),37 ℃恒温孵育15 min,再加入80 μL碳酸钠溶液(0.2 mol/L)终止反应,在405 nm波长下测定吸光度值(A值)。样品组A1、样品空白组A2、阴性组A3、空白组A4,结果重复三次,取平均值。抑制率的计算公式如下:α-葡萄糖苷酶抑制率= [1-(A1-A2)/(A3-A4)] × 100%。
2.6.3 乙酰胆碱酯酶和丁酰胆碱酯酶抑制活性测定
参照文献[15],以碘代乙酰胆碱为底物测定乙酰胆碱酯酶的活性,以硫代丁酰胆碱为底物测定丁酰胆碱酯酶的活性,以加兰它敏(galanthamine)为阳性对照,在96孔板上进行活性检测。反应体系为:先加入50 μL一定浓度的样品溶液,再加入10 μL 乙酰胆碱酯酶或丁酰胆碱酯酶(0.5 U/mL),4 ℃恒温孵育10 min,然后加入20 μL底物(2 mmol/L)和20 μL显色剂二硫代双硝基苯甲酸(2 mmol/L),37 ℃恒温孵育30 min,再加入20 μL独扁豆碱溶液(0.018 mmol/L)终止反应,在405 nm波长下测定吸光度值(A值)。样品组A1、样品空白组A2、阴性组A3、空白组A4,结果重复三次,取平均值。抑制率的计算公式如下:乙(丁)酰胆碱酯酶抑制率= [1-(A1-A2)/(A3-A4)] × 100%。
2.7 统计学分析

3 结果与分析
3.1 大高良姜地下根茎挥发油的化学成分分析
大高良姜地下根茎挥发油的总离子流图见图1,对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist 2017和Wiley 275标准质谱图,确定了116种挥发性化学成分,占挥发油总量的94.12 %,用峰面积归一化进行定量分析,计算出各个化学成分的相对质量分数,结果见如表1。

图1 大高良姜地下根茎挥发油GC-MS总离子流图Fig.1 Total ion chromatogram of the essential oil from the rhizome of A.galanga

表1 大高良姜地下根茎挥发油化学成分及相对含量Table 1 Chemical compositions and relative contents of the essential oil from the rhizome of A.galanga
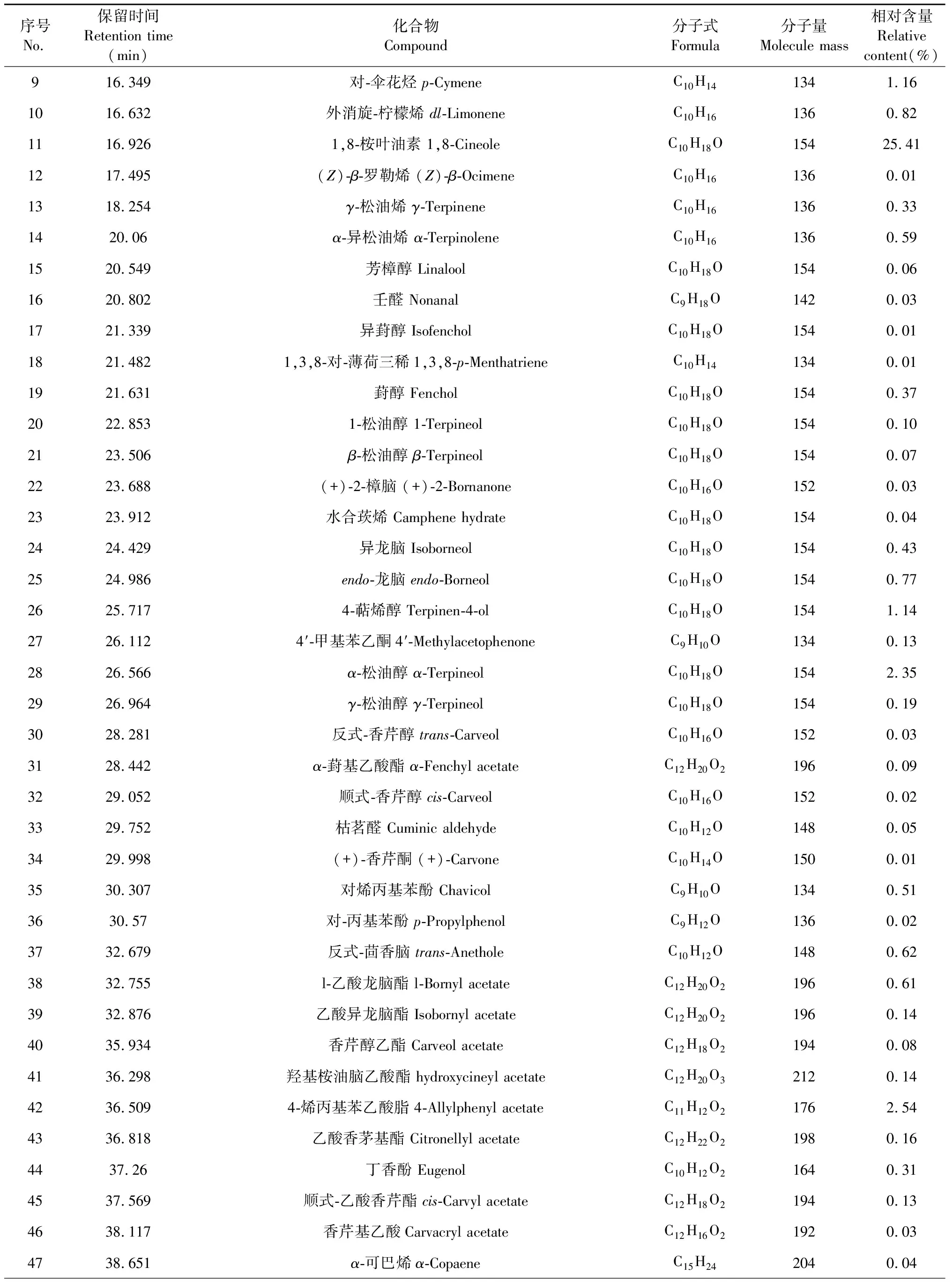
续表1(Continued Tab.1)
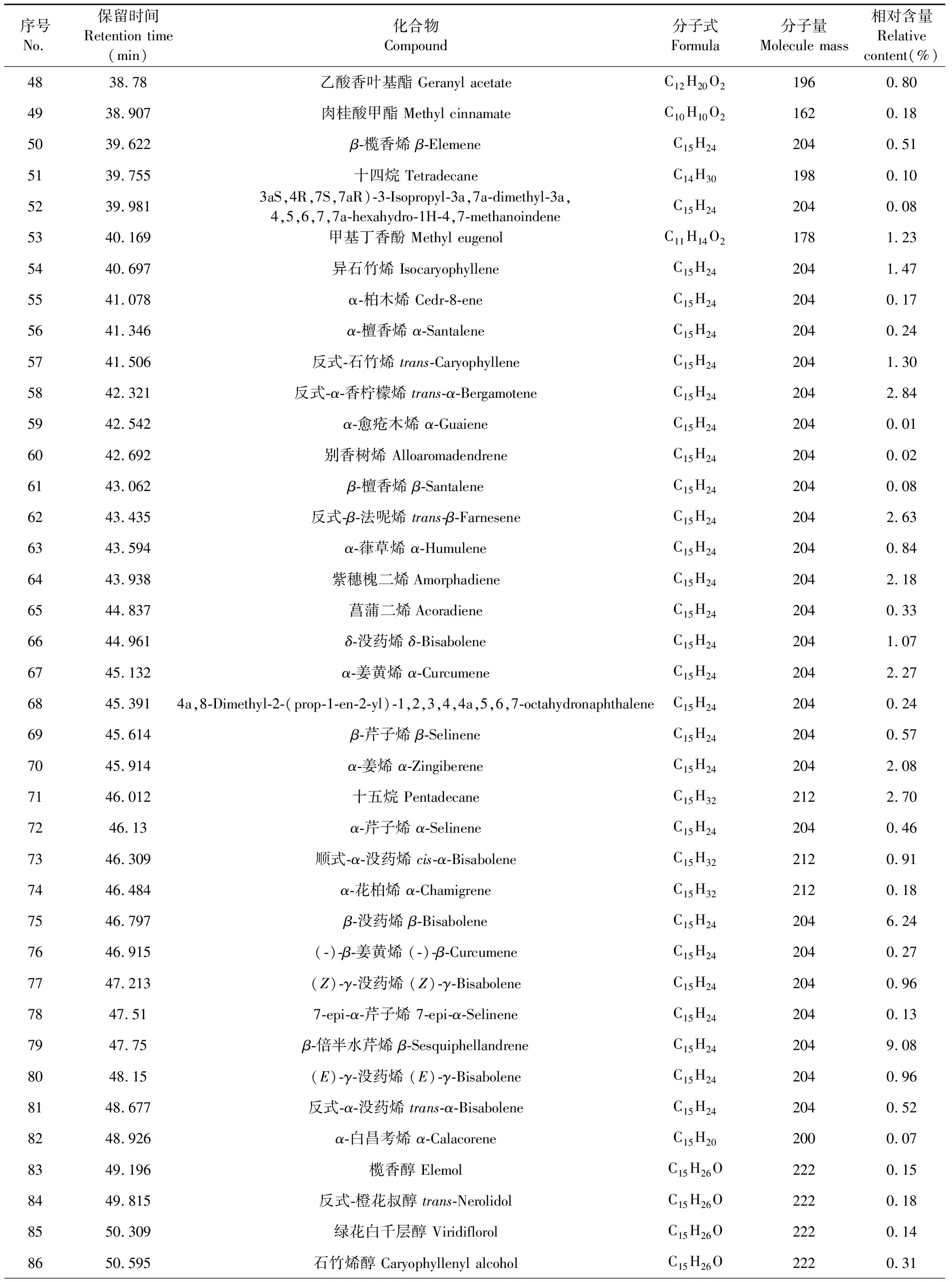
续表1(Continued Tab.1)
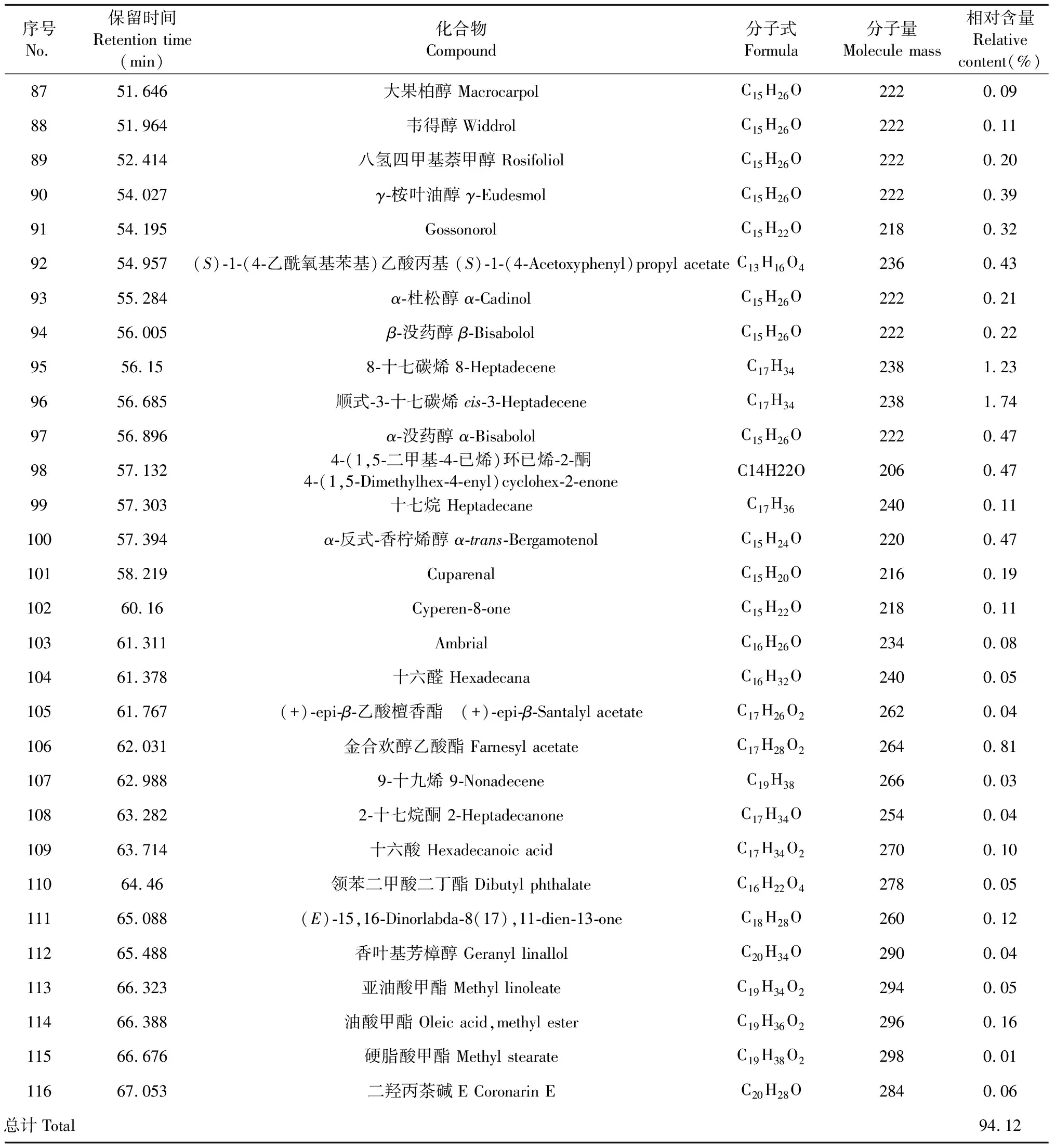
续表1(Continued Tab.1)
3.2 大高良姜地下根茎挥发油的抗氧化活性
由表2可知,大高良姜地下根茎挥发油对DPPH自由基显示出较差的抗氧化活性,其IC50值为6 886.01±88.64 μg/mL,抗坏血酸当量为0.09±0.02 mg AEs/g oil。对ABTS自由基有一定的抗氧化活性,其IC50值为222.8±7.04 μg/mL,抗坏血酸当量为4.83±0.31 mg AEs/g oil。
3.3 大高良姜地下根茎挥发油的抗菌活性
由表3、4可知,大高良姜地下根茎挥发油对金黄色葡萄球菌、枯草芽孢杆菌和变形杆菌表现出较好的抗菌活性,其抑菌圈大小在9.81~14.95 mm之间,MIC值在312.50~625.00 μg/mL之间,MBC值在625.00~1 250.00 μg/mL之间。挥发油对大肠杆菌、铜绿假单胞菌和白色念珠菌的活性较差。
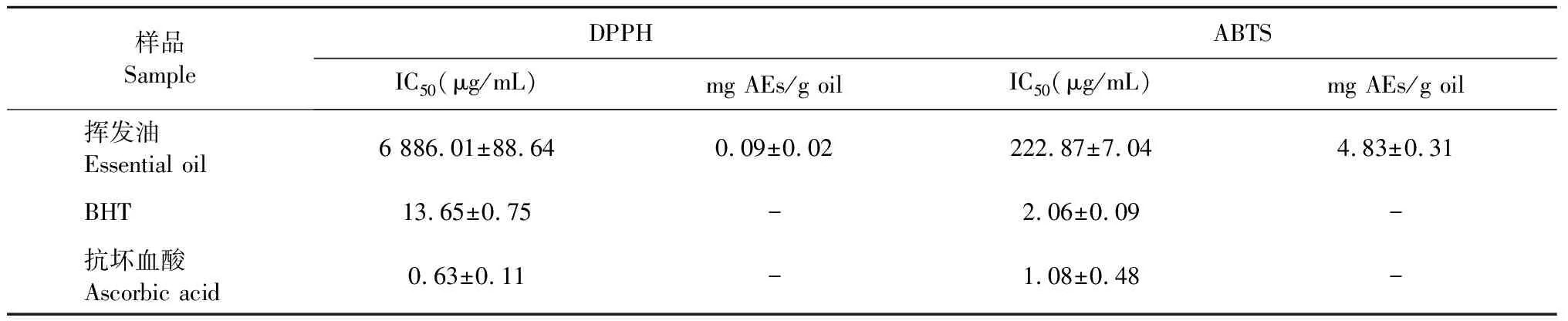
表2 大高良姜地下根茎挥发油的抗氧化活性Table 2 Antioxidant activity of the essential oil from the rhizomes of A.galanga

表3 大高良姜地下根茎挥发油的抑菌圈直径Table 3 Diameter of the inhibition zones of the essential oil from the rhizomes of A.galanga

表4 大高良姜地下根茎挥发油的最小抑菌浓度和最小杀菌浓度Table 4 MIC and MBC values of the essential oil from the rhizomes of A.galanga
3.4 大高良姜地下根茎挥发油的抗肿瘤活性
由表5可知,大高良姜地下根茎挥发油具有较强的抗肿瘤活性,其对A549、K562和PC-3肿瘤细胞的IC50值(IC50值分别为:26.57±0.76、58.01±0.94和35.56±0.57 μg/mL)与正常细胞(IC50=76.25±1.04 μg/mL)相比具有显著性差异(P<0.05),选择性指数(正常细胞IC50值与肿瘤细胞的IC50值的比值)分别为2.87、1.31和2.14。

表5 大高良姜地下根茎挥发油的抗肿瘤活性Table 5 Anticancer activity of the essential oil from the rhizomes of A.galanga
3.5 大高良姜地下根茎挥发油的酶抑制活性
酪氨酸酶是催化黑素生成的关键酶,因此,酪氨酸酶抑制剂具有皮肤美白效果;α-葡萄糖苷酶抑制剂通过延缓碳水化合物在小肠的吸收,从而降低餐后血糖和胰岛素水平,用于治疗2型糖尿病;胆碱酯酶抑制剂通过抑制乙酰胆碱的分解,增强胆碱能神经传递,已成为阿尔茨海默病最有效的治疗策略[15]。由表6可知,大高良姜地下根茎挥发油对酪氨酸酶、α-葡萄糖苷酶、乙酰胆碱酯酶和丁酰胆碱酯酶表现出一定的酶抑制活性,其IC50分别为2 479.15±73.58、933.71±0.46、380.47±0.55和9 157.26±26.29 μg/mL,阳性当量值分别为71.88±2.33 mg AREs/g oil、0.25±0.002 mmoL ACEs/g oil、0.77±0.02 mg GALAEs/g oil和0.52±0.01 mg GALAEs/g oil。

表6 大高良姜地下根茎挥发油的酶抑制活性Table 6 Enzyme inhibitory activity of the essential oil from the rhizomes of A.galanga
4 讨论
从大高良姜地下根茎挥发油中共分析鉴定出116种化合物,占挥发油总量的94.12%,主要成分有1,8-桉叶油素(25.41%)、β-没药烯(6.24%)和β-倍半水芹烯(9.08%)。文献回顾表明[3-5,7],印度产大高良姜地下根茎挥发油富含1,8-桉叶油素(28.4~63.4%),马来西亚产大高良姜地下根茎挥发油富含1,8-桉叶油素(40.5%)、β-没药烯(8.4%),对比说明产地对其化学成分的含量有一定影响。挥发油对ABTS自由基有一定的清除活性,对DPPH自由基显示出较差的清除活性。挥发油对金黄色葡萄球菌、枯草芽孢杆菌和变形杆菌表现出较好的抗菌活性。挥发油具有较强的抗肿瘤活性,与正常细胞相比具有显著性差异(P<0.05),选择性指数分别为2.87、1.31和2.14。挥发油对酪氨酸酶、α-葡萄糖苷酶、乙酰胆碱酯酶和丁酰胆碱酯酶均表现出一定的酶抑制活性。1,8-桉叶油素已被证明具有抗氧化、抗菌、抗肿瘤、抗炎、镇痛活性和乙酰胆碱酯酶抑制作用[16-18]。β-没药烯具有抗菌和抗肿瘤活性[19,20]。故挥发油的抗氧化、抗菌、抗肿瘤和酶抑制活性可能是这些主要的化学成分,或主要成分和少量成分的协同作用。研究结果可为大高良姜地下根茎挥发油的进一步开发利用提供一定的数据参考。
