虫草素对Aβ联合D-半乳糖诱导阿尔茨海默病动物模型的保护作用及机制
2020-12-03王金秀霍鑫华周志锋文伊倩姚丽华
王金秀,宋 皓,霍鑫华,周志锋,郭 盛,文伊倩,肖 鹏,姚丽华,3*
1江西科技师范大学生命科学学院,南昌 330013;2华南师范大学生命科学学院,广州510631;3江西固本生物科技有限公司,南昌 330096
阿尔茨海默病以突触丢失、渐进性神经元死亡及认知功能和胆碱能神经系统衰退为主要神经病理特征[1],是一种在老年人中最为常见的神经系统退行性疾病。其主要临床表现为记忆障碍、行为障碍和情绪障碍。AD患病人数随着社会人口老龄化程度不断加剧而逐年增多。据预测,到2050年,患痴呆症的人数将达到1.52亿,是目前患病人数的三倍多[2]。目前,此病的药物治疗仍处于初级阶段,并不能延缓疾病的发展,给社会和家庭带来了沉重的负担。该病的防治已成为国内外医学界研究的热点。
在众多病因学说中,β-淀粉样蛋白(Aβ)聚积形成可溶性Aβ二聚体后,进而导致认知功能进行性退化,是目前公认的主要发病机制之一[3-5]。Aβ寡聚体在脑内的过度沉积会产生兴奋性神经毒性,引发突触功能障碍[5]和神经元凋亡,使脑组织发生不可逆转的损伤,将进一步加重AD病理发展[3]。有研究表明,Aβ25-35保留了Aβ的大部分物理和生物特性,被认为是Aβ发挥神经毒性作用的主要活性片段,海马区域注射Aβ25-35可诱发神经元损伤,明显降低动物的空间学习和记忆能力[6]。D-半乳糖会引起代谢紊乱,提高体内自由基水平,加速免疫器官老化,所引起亚急性衰老与正常老化相似[7]。另外,已有研究证明,皮下注射D-半乳糖诱导的衰老模型,其病理特征为进行性记忆障碍、APP及Aβ表达增高、中枢胆碱能神经系统退行性变、过度氧化应激等[8,9]。因此,为更真实可靠地模拟阿尔茨海默病的症状,本实验采用一种比较理想且模拟程度较高的AD造模方法,即海马区注射Aβ25-35诱发记忆障碍联合腹腔注射D-半乳糖加速动物衰老的方法建立复合型AD动物模型[10,11]。
虫草素(cordycepin)分子结构为3′-脱氧腺苷,是从蛹虫草中分离的腺苷类似物,具有抗肿瘤,抗衰老,抗白血病等药理作用。已有研究证实,虫草素通过降低兴奋性神经递质在突触前的释放来抑制兴奋性突触传递[12],选择性地抑制VGSC活性,降低Ca2+通道的开放程度[13],改善神经元膜去极化和神经元过度活跃[14],起到对中枢神经系统的生理及病理过程的调控作用。初步研究表明虫草素类似物可以通过抗氧化作用改善D-半乳糖诱导的衰老模型的反应迟钝和认知障碍[15]。另外,虫草素可以有效抑制神经元过度兴奋,延缓缺氧诱导的神经元损伤[16],降低Aβ25-35诱导的神经元兴奋性毒性[13],减少缺血/再灌注导致的脑部损伤,改善缺血诱导的海马CA1区锥体神经元损伤及认知障碍[17]。目前已有研究将虫草素用于治疗老年痴呆,但我们对虫草素改善AD学习记忆障碍的神经药理学机制仍知之甚少。本研究将采用电刺激Y型迷宫实验、生化检测并结合HE组织染色观察方法来探讨虫草素对神经元保护及改善AD大鼠学习记忆的作用,为虫草素在神经系统的开发和应用提供实验依据。
1 材料
1.1 仪器
脑立体定位仪(正华生物仪器设备公司);Multiscan MK3型全自动酶标仪(Thermo Lab Systems,USA);恒温水浴锅(上海一恒科学仪器有限公司);5804R型离心机(Eppendorf,Germany);电子天平(Mettler Toledo(上海))。
1.2 药品与试剂
BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);乙酰胆碱酯酶(AChE)测试盒 (购自Solarbio,北京,中国);D-半乳糖(Sigma,USA)溶于超纯水中储存于冰箱4 ℃;β-淀粉样蛋白(Aβ25-35)(Sigma,USA)用超纯水稀释为4 mM母液,37 ℃老化7天,置于-20 ℃条件下备用;虫草素由华南师范大学提供[14],标准品用超纯水溶解,置于冰箱-20 ℃储存备用。
1.3 实验动物及其环境
成年雄性Sprague Dawley(SD)大鼠(7~10周龄,体重200~250 g),购自湖南斯莱克景达实验动物有限公司。动物许可证号:SCXK(湘)2013-0004。置于温度22±3 ℃、湿度55%±5%、周期为每12 h明暗交替一次的清洁级环境中饲养,每天8∶00~20∶00允许动物自由取水、取食。
2 方法
2.1 分组、给药、造模
在实验前给予所有成年雄性SD大鼠一周的时间来适应新的环境。挑选健康大鼠(将反应迟钝、行动缓慢或对电刺激过度敏感的大鼠筛出淘汰)随机分为正常对照组(10只)、模型组(11只)、虫草素给药组(11只)。模型组和虫草素给药组每天注射一次D-半乳糖(120 mg/kg),空白对照组每天注射等量的无菌生理盐水(0.9%),连续注射40天。在连续注射25天后,给药组开始灌胃虫草素(虫草素灌胃浓度10 mg/kg参考团队之前的研究[17]),对照组和模型组灌胃等量的无菌生理盐水(0.9%),每天一次,连续灌胃15天。
连续注射D-半乳糖40天后,第41天注射4 μM/L的Aβ25-35[10,11]。用10%水合氯醛(0.3 g/kg)麻醉SD大鼠,去除头顶毛发,手术及其周围部位用碘伏消毒后,将其固定在脑立体定位仪上,保持颅骨水平。划开大鼠头部皮肤,剥离颅骨表面结缔组织,暴露前囟。以前卤点(Bregma)为0点,用颅骨钻沿0点向后3 mm,中线向右2 mm钻孔。当颅骨出现裂缝时,用微量注射器的针头小心挑破。微调微量注射器(5 μL规格)位置与钻孔位置相同,将连接微玻管的注射针缓慢下移3.5 mm。Aβ25-35溶液(模型组、给药组)或生理盐水溶液(对照组)于10 min内注射完毕,留针8~10 min以确保药物完全分散。在上述试验24 h后,每只大鼠被编码一个数字,在一个黑暗的房间里进行Y迷宫测试。为保证实验结果更加客观,注射、灌胃、立体脑定位和行为学测试分别由不同的人进行。
2.2 Y型迷宫测试
Y型迷宫测试广泛应用于功能减退、趋向性、空间工作记忆等研究领域。在本实验中,用其评估虫草素对大鼠空间学习记忆能力的影响[14,15]。Y型迷宫由三个相等的径向臂组成(长度:30cm;角度:120),每个臂装有一盏15 W的灯照明,底部由电栅臂铺设,可以通电刺激(40 V交流电,亮灯5 s后开始)。实验时,亮灯的臂没有电流刺激为安全区,另两支臂黑暗且有电击为电击区,安全区和电击区每隔25~35 s随机转变。在实验前,大鼠被允许自由探索Y型迷宫的三支手臂3~5 min。随后,训练其在10 s内选择进入安全区,进入电击区则被记录为识别错误,在10 s内未进入下一个区域同样记录错误。两次测试之间用75%的乙醇擦洗Y型迷宫内部,以消除异味。每只大鼠每天进行20次测试,持续9~13天。正确反应率[17]和动物反应时间(潜伏期)[18]作为动物学习记忆能力的评估指标。90%的正确率为学习达标[17]。在训练阶段,亮灯5 s后至进入新臂的时间被用来评估大鼠空间短时记忆。大鼠在5 s内(未施加电刺激)进入下一个区域,则记录其反应时间为0 s。
2.3 生化检验
Y型迷宫行为学测试实验全部完成后,每组大鼠(n=5~7)用10%水合氯醛深度麻醉后进行解剖实验。在碎冰上快速剥离海马组织并称重,在低温裂解缓冲液(pH 7.4)中制备匀浆,冷冻离心(4 ℃,12 000 rpm,10 min),吸取上清液,按AChE试剂盒说明书上的方法,在412 nm处测定二硫对硝基苯甲酸(DTNB)与碘化乙酰硫代胆碱酶解生成的TNB生成量,用其评估AChE活性。根据BCA蛋白试剂盒说明书上的方法,以BSA为标准,Bradford法测定蛋白浓度。结合以上两种方法即可计算AChE活性(U/mg prot)。
2.4 HE染色
Y型迷宫行为学测试实验全部完成后,将每组剩余大鼠深度麻醉,开胸暴露心脏,用8号针头经左心室刺入主动脉,先快速灌注200 mL磷酸盐缓冲溶液(PBS,pH 7.4,4 ℃),再灌注200 mL 4%多聚甲醛溶液(溶解于PBS,4 ℃)固定,直至肢体抽搐变硬。断头取脑,将脑浸泡在4%多聚甲醛溶液中固定保存(4 ℃),用石蜡包埋海马,制成5 μm厚度切片,后经苏木精-伊红(HE)染色,光镜下观察拍照。从每个大脑中选择4~5片进行分析。每个切片同一个平面范围内脑组织神经元受损情况重复分析两次[13]。
2.5 统计分析
所有实验数据分析都通过SPSS17.0统计软件进行,统计计算数据均以均值± SD表示。采用双因素方差分析法进行统计分析,P<0.05有统计学意义。
3 结果
3.1 虫草素对AD模型大鼠学习记忆能力的影响
如图1所示,3组大鼠在前两天测试中正确反应率并无很大差异,在训练后第3天,正常对照组和虫草素给药组大鼠正确率明显提高,甚至有些大鼠达到学会标准。在训练后第4天到第10天,模型组正确反应率增长缓慢,明显低于正常对照组与虫草素给药组。训练3天后,模型组大鼠每天的正确反应率均明显低于对照组(P<0.01)。在训练后第4天,虫草素给药组的正确反应率与模型组相比并无统计学差异(P=0.144)。然而,有趣的是,在训练后第5天到第10天,虫草素给药组大鼠正确反应率(86.36%±2.33%、85.91%±2.24%、92.73%±1.89%、94.09%±1.05%、95.00%±1.89%、97.27%±1.54%)明显高于模型组(72.92%±2.84%、71.25%±4.17%、74.58%±3.11%、69.17%±3.39%、78.75%±4.73%、82.08%±4.04%),差异有统计学意义(P<0.01)。除在训练后第4天和第6天外,其余训练时间内虫草素给药组的正确反应率与正常对照组比较并没有显著的统计学差异(P> 0.05)。
对各组动物训练达标天数与次数进行进一步的统计与分析发现,模型组达到学会标准所需的训练天数(11.67±0.68)和总测试次数(233.3±13.7)明显高于正常对照组(4.44±0.40、88.9±8.0)(P<0.01)(图2)。有趣的是,我们发现虫草素给药组大鼠达到学会标准所需的训练天数和总训练次数(5.73±0.43、114.5±8.5)明显低于模型组大鼠(P<0.01)(图2)。同时,我们也发现,在训练3天后,与模型组相比,正常对照组动物反应时间(潜伏期)明显较低(P<0.01)(图3)。另外,给药组在训练5天后,其反应时间(潜伏期)较模型组也明显降低(P<0.01)(图3)。从动物行为学训练结果,我们发现AD模型组大鼠的正确反应率明显低于正常对照组,达到学会标准所需训练天数和训练总次数及反应时间均明显高于正常对照组及给药组,表明在本实验中,我们采用Aβ25-35联合D-半乳糖诱导的AD动物模型是成功的。同时,我们的行为学结果也强烈提示,口服虫草素可以预防Aβ25-35联合D-半乳糖诱导的AD模型大鼠学习记忆能力损伤。
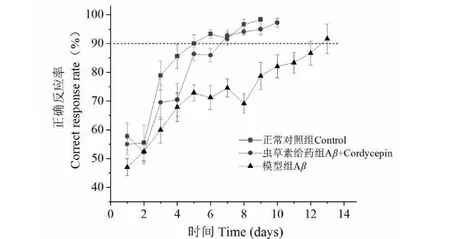
图1 大鼠的正确反应率 Fig.1 Correct response rate of rats
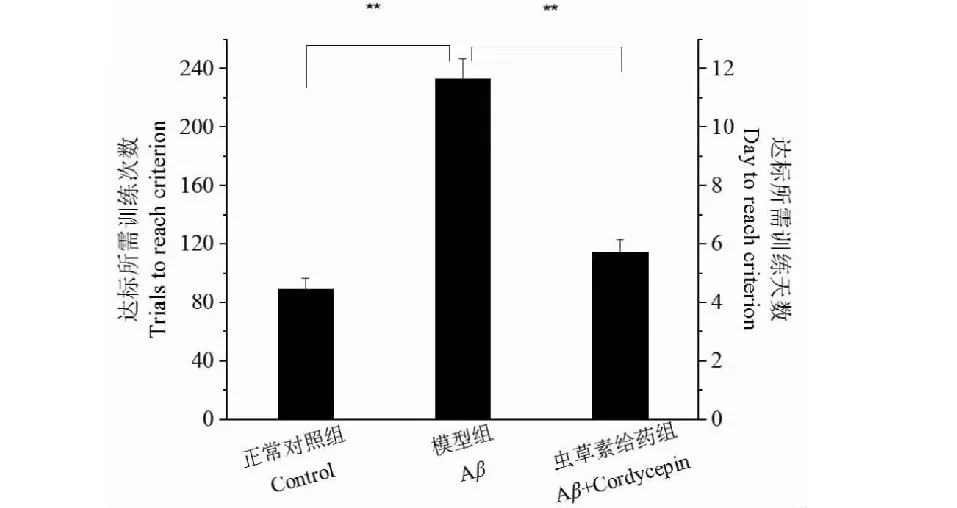
图2 大鼠达标所需的训练次数Fig.2 Trails of reaching standard of rats 注:与模型组比较,**P<0.01。Note:Compared with model group,**P<0.01.

图3 虫草素对大鼠短时记忆的影响Fig.3 Effects of cordycepin on short-term memory in rats
3.2 虫草素抑制AD模型大鼠海马区乙酰胆碱酯酶的过度激活
如图4所示,AD模型组大鼠海马区AChE活性(52.49±5.20)显著高于正常对照组(20.48±1.44)(P<0.001)。而与模型组相比,虫草素给药组大鼠海马区AChE活性显著降低(25.70±1.99),差异有统计学意义(P<0.001)。生化检测结果表明虫草素可以有效地抑制Aβ25-35联合D-半乳糖诱导的大鼠海马区AChE活性的升高。提示,虫草素改善AD模型大鼠学习记忆能力可能与其抑制了模型大鼠海马区乙酰胆碱酯酶的过度激活有关。
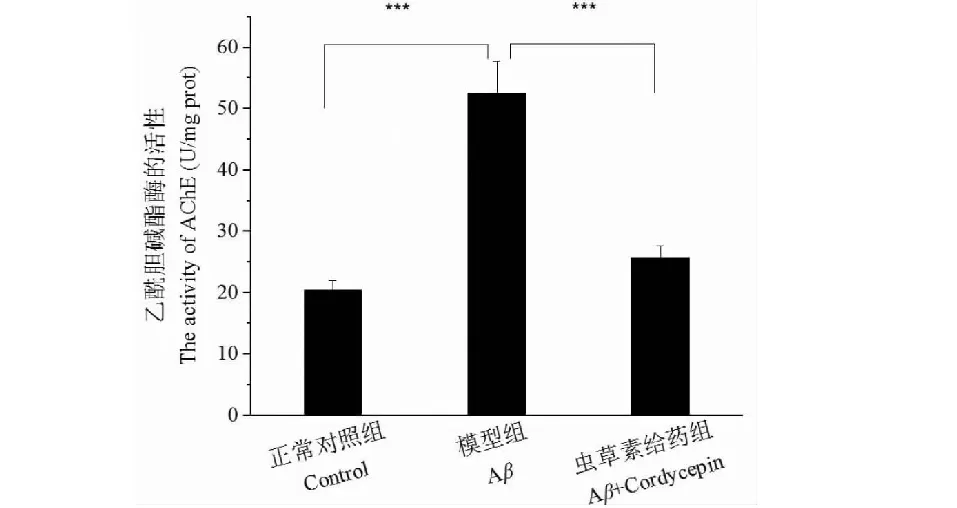
图4 虫草素对海马区乙酰胆碱酯酶活性的影响Fig.4 Effect of cordycepin on the activity of AChE in hippocampus注:与模型组比较,***P<0.001。Note:Compared with model group, ***P<0.001.
3.3 虫草素对海马神经元损伤的保护作用
最后,我们对各组动物海马区进行了组织形态学观察,发现与对照组相比,AD模型大鼠海马CA1区细胞带排列紊乱、稀疏,出现神经元丢失、可见核固缩或溶解、细胞空泡、胞体不规则等形态学改变(图5A)。统计学数据分析显示,与正常对照组相比,模型组大鼠CA1区椎体神经元密度显著降低,差异有统计学意义(P<0.001),CA3区锥体细胞数量虽然也有所降低,但无统计学意义。与模型组相比,虫草素给药组大鼠神经元数量显著增多,细胞形态也较正常。与对照组大鼠相比,虫草素组大鼠海马CA1区和CA3区神经元数量与形态并没有显著性差异(图5B)。结果表明,虫草素可以明显对抗Aβ25-35联合D-半乳糖诱导的AD模型大鼠CA1区神经元的损伤。提示,虫草素对脑组织结构损伤所致的认知功能障碍有预防作用。
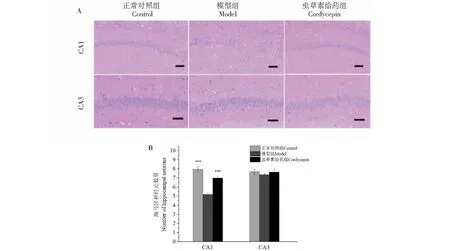
图5 虫草素对AD模型大鼠海马区神经元数密度的影响Fig.5 Effects of cordycepin on the neurons density in hippocampus of AD rats注:A图表示虫草素对AD大鼠海马锥体神经元的影响,Bar=200 μm;B图表示虫草素对AD大鼠海马神经元丢失的影响。Note:A shows effects of cordycepin on hippocampal pyramidal neurons in AD rats,Bar=50 μm.;B shows effects of cordycepin on hippocampal neuronal loss in AD rats.
4 讨论
可溶性Aβ寡聚物在脑内的过度沉积可引起神经毒性,引发胆碱能神经系统[27,28]及突触功能障碍[5],使脑组织发生不可逆转的损伤,被认为是导致AD病人神经元损伤的主要病因。AD病人脑内Aβ的沉积片段主要为Aβ1-42序列,有文献表明,Aβ25-35片段保留了Aβ的大部分物理和生物特性,与内源性Aβ1-40和Aβ1-42片段神经毒性相似[6]。重要的是,Aβ25-35较完整的Aβ肽链聚集迅速,不需要超过7天的老化时间才会聚集为有毒物质,且纳摩尔浓度的Aβ25-35即可诱发神经退行性病变[6]。D-半乳糖衰老模型已是国内外研究公认的衰老模型。D-半乳糖是一种氧化性物质,在体内被还原代谢为不可代谢产物半乳糖醇,大量堆积在细胞内,会使细胞代谢紊乱,出现退行性变化,造成学习记忆能力障碍。D-半乳糖致衰老的主要机制是其可以提高体内自由基水平,产生过氧化损伤,降低机体抗氧化能力,与正常老化相似[7]。另外,D-半乳糖可以使免疫器官老化,免疫系统结构与功能下降。因此,本实验采用海马区注射Aβ25-35诱发记忆障碍联合腹腔注射D-半乳糖加速动物衰老的方法建立复合型AD动物模型,该模型具有AD病人的痴呆症状及接近AD病人体内衰老病理环境,是一种比较理想且模拟程度较高的AD造模方法[10,11,20,21]。
在本实验中,我们发现注射D-半乳糖后,大鼠背部毛色逐渐发黄,无光泽,不活跃。但在虫草素给药组,我们却发现,在注射D-半乳糖第26天开始至给予虫草素灌胃数天后上述大鼠衰老现象明显得到改善,而模型组大鼠随着造模时间的深入,其衰老现象则变得更加严重,脱毛且毛色暗沉,大便不成形,行动迟缓。在Y型迷宫测试中,我们观察到模型大鼠行动缓慢,反应迟钝,许多在给予电击后才缓慢走向下一个区域,且在靠近三角区域及三角区域犹豫停留时间较长。有些模型大鼠在走近三角区时开始扭头观望其余两臂,而对照组和虫草素给药组大鼠并无这种现象,我们由此推测模型组大鼠其视力也有所下降。众所周知,衰老与痴呆有着密不可分的关系,在本研究中,我们采用Aβ25-35联合D-半乳糖诱导的AD模型很好的模拟了这一病理现象。有趣的是,在虫草素治疗组及空白对照组中,我们发现动物明显较活跃,有些在灯亮时直接跳跃至下一个区域,正确率及反应时间均明显优于模型组(图1)。表明虫草素可明显延缓Aβ25-35联合D-半乳糖诱导的AD模型大鼠的衰老进程,并成功地预防了AD模型大鼠学习记忆障碍。
乙酰胆碱(ACh)是中枢胆碱能通路中维持高级神经活动的一种重要神经介质,在记忆活动中起着重要作用[22]。乙酰胆碱酯酶(AChE)是一种能够水解神经递质乙酰胆碱的生物酶,AChE的过度激活会破坏海马区ACh含量的稳态,影响正常的突触传递。AD患者中枢神经系统内存在多种神经递质异常。已有研究表明,存在淀粉样蛋白斑块的海马体AChE 活性较高[19],AChE的过度激活导致大脑乙酰胆碱的缺乏是AD患者记忆障碍的一个主要原因[19,23,24]。目前,通过抑制中枢神经系统乙酰胆碱水解来增强胆碱能功能,改善认知功能仍是公认治疗AD的一种有效治疗方法[23,24]。本研究证明,虫草素可明显抑制乙酰胆碱酯酶过度活化的现象(图2),提示虫草素可通过抑制海马区域AChE过度活化,维持海马区ACh的水解与合成处于动态平衡,来改善胆碱能障碍,从而起到关键的神经元保护作用(图3),并最终改善AD模型大鼠的学习记忆能力,这一在体实验结果与我们之前在原代培养的海马细胞离体实验上的结果是一致的,再一次证明了虫草素改善中枢神经系统的损伤作用与抑制乙酰胆碱酯酶过度活化密切相关。此外,正如前面所述,腹腔注射D-半乳糖加速动物衰老的病理机制主要与其提高体内自由基水平,产生过氧化损伤,降低机体抗氧化能力相关。而已有的大量研究(包括我们实验室之前的研究)已经表明,虫草素可以有效清除自由基,降低缺血缺氧对脑组织的氧化损伤,并最终对神经元起到保护作用。结合本实验结果,我们有理由推测虫草素对Aβ25-35联合D-半乳糖诱导的AD模型动物的损伤保护作用也有可能与其抗氧化作用机制相关,当然,这一作用机制还有待于进一步的实验证明。
综上所述,我们发现虫草素可明显抑制Aβ25-35联合D-半乳糖诱导老年痴呆动物模型认知障碍、行为障碍及衰老病理现象的发生。潜在的保护机制可能与其抑制AChE 过渡激活,增强胆碱能神经系统功能,减少海马区神经元各种毒性损伤等有关。提示虫草素在临床治疗阿尔茨海默症等相关认知障碍的退行性疾病中具有良好的药用开发前景。
