浓缩生长因子对缺血再灌注诱导的小鼠骨样细胞凋亡的作用研究
2020-11-26李石岩马志红李燕波郝旭峰何志良王承阳
李石岩, 马志红, 李燕波, 曹 雷, 郝旭峰, 何志良, 张 晗, 王承阳
(河北省承德市中心医院, 河北 承德 067000)
与许多其他器官不同的是,由于外伤或其他原因导致的人体骨骼受损会自发愈合。关于骨修复,其利用骨本身内源性再生的潜能,通过增加骨体积,继而恢复原始骨结构的过程。总的来说,骨修复的过程快速且高效。但在一些病理状态下,骨修复过程可能会受到阻碍。具体讲,大约有10%的骨折患者并发骨延迟愈合或骨不连,同时可能出现骨缺损[1]。另外,在某些骨修复的过程,比如存在骨缺损的植骨、颅面的重建,有一部分患者重建失败,可能原因包括但不拘泥于血液供应较差、骨膜受损严重、老年或并发骨质疏松诱导的骨祖细胞数量降低、手术固定欠佳和损伤部位发生感染,其中骨细胞凋亡发挥重要作用。骨损伤后的骨细胞凋亡由两种途径介导不同的过程:血管生成或从已有血管和血管生成中获得的新毛细血管,它们通过重建骨内血管和血液供应促进骨修复,有助于髓腔的修复,改善骨愈合过程中的生物力学性能[2]。富含血小板的血浆首先被认为是人类牙科和口腔颌面外科领域骨和组织修复的有效药物,其次是整形外科领域皮肤移植伤口愈合的改善证据。浓缩生长因子(Concentrated growth factor,CGF)是新一代血小板浓缩物,许多临床研究表明,CGF可以作为一种骨移植材料,研究还表明,CGF可以增加骨形成和细胞分化,以及促进细胞增殖和神经营养因子分泌[3,4]。然而,CGF对骨细胞凋亡的影响尚不清楚。本研究选择复制体外小鼠骨样细胞(MLO-Y4细胞)缺血再灌注(ischemic/reperfusion,I/R)模型,进一步观察CGF对缺血再灌注诱导的MLO-Y4细胞凋亡的作用。
1 资料与方法
1.1一般资料:试剂:蛋白定量BCA试剂盒购自北京普利莱基因技术有限公司;RIPA裂解液购自武汉博士德生物工程有限公司;PMSF购自中国碧云天生物技术研究所;caspase-3活性检测试剂盒购自美国的BioVision公司;青霉素/链霉素购自美国的Sigma公司;胎牛血清、DMEM高糖培养基和PBS购自美国的Coring公司;平台离心机购自购自意大利的Medifuge公司;平台倒置显微镜购自日本的Nikon公司;细胞总RNA提取试剂盒、一步法实时定量荧光聚合酶链反应(quantitative real time polymerase chain reaction,qRT-PCR)试剂盒购自日本的TaKaRa公司。
1.2MLO-Y4细胞的培养:MLO-Y4细胞购自ATCC(美国),MLO-Y4细胞培养于含5%小牛血清、5%胎牛血清(fetal bovine serum, FBS)、2mM L-谷氨酰胺、72mg/L的青霉素、100mg/mL的链霉素的a-MEM培养基中,并置于37℃、5%CO2的培养箱。每3d传代一次。在6孔板中以2×106细胞/皿的密度接种MLO-Y4细胞,培养24h。MLO-Y4细胞I/R模型制备:正常培养MLO-Y4细胞72h后,给予“缺血缓冲液”刺激,建立缺血模型[5],缺血缓冲液包含下述物质(mmoL/L):118 NaCl、24NaHCO3、1.0 NaH2PO4、2.5 CaCl2-2H2O、1.2 MgCl2、20 乳酸钠、16 KCl 和 10 脱氧葡萄糖。实验组分别加入含1%、5%、10%CGFe的完全培养基,37℃、5%CO2孵育10min,然后用1xPBS清洗细胞,实验组分别加入含有1%、5%、10%CGFe的缺血缓冲液,处理后的细胞放置温度为37℃,CO2浓度为5%细胞培养箱中孵育,处理2h,将缺血缓冲液换为含有1%、5%、10%CGFe无血清培养基,再灌注时间为24h。对照组细胞,无血清培养基处理2h,完全培养基处理24h。
1.3浓缩生长因子对内皮细胞凋亡的作用
1.3.1浓缩生长因子提取液(concentrate growth factor extracts,CGFe)的制备:本实验已得到承德市中心医院伦理委员会的批准,志愿者对过程均知情并同意。筛选现场,确定志愿者不吸烟,进行血常规检查显示血小板计数位于正常范围,筛选出的健康男性志愿者年龄35~45岁,共4名,获得每位志愿者的CGFe,混匀。不同浓度的CGFe均含有10%FBS。
1.3.2caspase-3活性的检测:检测caspase-3的活性所用的方法为荧光法。将细胞用1×lysis buffer裂解,4℃,14000rpm/min,离心10min,分别取出上清液,将上清液及试剂盒荧光底物同时加入96孔板,在最佳波长为405 nm测定数值,作为基础值,将96孔板放置37℃孵箱,避光孵育1.5 h,上机测定数值。应用BCA法测定细胞的蛋白浓度,进行数据处理,即2次读取的吸光度值的差值除以对应细胞的蛋白浓度即为caspase-3活性。
1.3.3Real-time PCR分析
1.3.3.1mRNA提取、反转及分析:每个孔中加入1mL Trizol,13500rpm,离心5min,分别加入氯仿、异丙醇、75%乙醇、13500rpm10min4℃,干燥10min,加入DEPC水溶解。将溶于DEPC水中的mRNA吸取1-2μL于Nano-drop上,测定mRNA浓度及纯度(260/280)。根据定量结果,计算反转mRNA的量,一般反转2μg mRNA/管。
反转流程如下:①mRNA(2μg)+random primer 1μL+DEPC ddH2O=10μL 混匀后,72℃ 10 min,冰浴10min。②上述体系分别加入各个需要反转mRNA的RNase-free的EP管中,置于72℃,10min,再置于冰上,10min。③cDNA合成:上述各管中加入以下试剂:4μL 5×反转录buffer+2μL 2.5mM dNTP+1μL 逆转录酶+0.5μL 逆转录酶抑制剂+1.5μL DEPC水=10μL,使每管的总体系为20μL。④将上述20ul体系混匀,离心后放入PCR仪中,42℃ 1h,95 ℃ 5min,0℃ forever。⑤将制备好的cDNA,保存在-20℃。
1.3.3.2Realtime PCR分析如下:①准备引物:将引物稀释为工作液(10μM);实验中所用到的引物包括:见表1。②打开Realtime-PCR仪,设置反应条件:反应温度为:95℃ 5min,95℃ 15s,60℃ 45s(45 个循环);熔解曲线:55℃,95℃(每个循环增加0.5℃,81个循环)。③每个反应体系按以下混匀:1μL cDNA+1μL 靶基因/内参的上游引物+1μL 靶基因/内参的下游引物+10μL SYBR Green PCR master mix(2×)+ 7μL ddH2O。④将八联排放入PCR仪中,填写板子的布局。⑤点击“run”之后确认方法正确,再次点击“run”,弹出“保存”对话框,保存文件。⑥结束之后,导出数据,分析。⑦结果分析:靶基因相对mRNA 水平=2(CT内参-CT靶基因)。

表1 实验中所用到的引物

2 结 果
2.1CGFe对H/R状态下MLO-Y4细胞的caspase-3活性的影响:与对照(Control,Con)组相比较,缺血再灌注(hypoxia/Reperfusion,H/R)组caspase-3活性明显升高了119%(2.19%±0.1% vs.1.00%±0.0%, P<0.05)。与H/R组相比,H/R+1%CGFe组caspase-3活性明显从2.19%±0.1%降低至1.70%±0.1% (P<0.05);与H/R+1%CGFe组相比,H/R+5%CGFe组caspase-3活性明显从1.70%±0.1%降低至1.47%±0.0% (P<0.05);与H/R+5%CGFe组相比,H/R+10%CGFe组caspase-3活性明显从1.47%±0.0%降低至1.18%±0.0%(P<0.05)(图1)。
2.2CGFe对H/R状态下MLO-Y4细胞的Bax mRNA的影响:与Con组相比较,H/R组Bax的mRNA水平明显升高(2.72±0.08 vs.1.00±0.03, P<0.05)。与H/R组相比,H/R+1%CGFe组Bax的mRNA水平明显从2.72±0.08降低至2.28±0.07 (P<0.05);与H/R+1%CGFe组相比,H/R+5%CGFe组Bax的mRNA水平明显从2.28±0.07降低至1.89±0.05(P<0.05);与H/R+5%CGFe组相比,H/R+10%CGFe组Bax的mRNA水平明显从1.89±0.05降低至1.32±0.07(P<0.05)(P<0.05)(图2)。

图2 缺血再灌注MLO-Y4细胞的Bax 的mRNA水平检测
2.3CGFe对H/R状态下MLO-Y4细胞的Bcl-2 mRNA的影响:与Con组相比较,H/R组Bcl-2的mRNA水平明显降低(0.53±0.00 vs.1.00±0.02, P<0.05)。与H/R组相比,H/R+1%CGFe组Bcl-2的mRNA水平明显从0.53±0.00升高至0.67±0.01 (P<0.05);与H/R+1%CGFe组相比,H/R+5%CGFe组Bcl-2的mRNA水平明显从0.67±0.01升高至0.77±0.01(P<0.05);与H/R+5%CGFe组相比,H/R+10%CGFe组Bcl-2的mRNA水平明显从0.77±0.01升高至0.85±0.01(P<0.05)(P<0.05)(图3)。
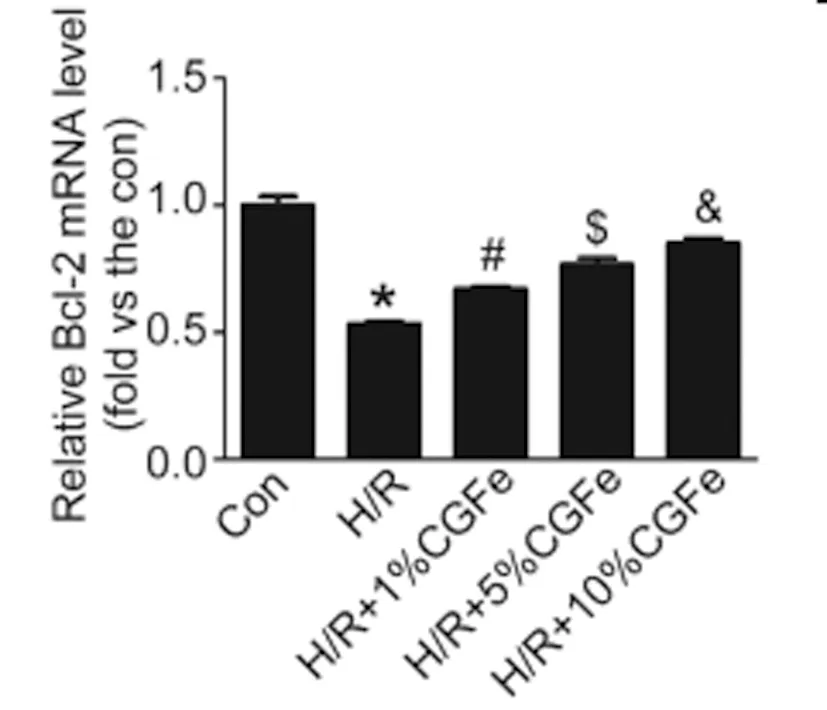
图3 缺血再灌注MLO-Y4细胞的Bcl-2的 mRNA水平检测
2.4CGFe对H/R状态下MLO-Y4细胞的p53的mRNA的影响:与Con组相比较,H/R组p53的mRNA水平明显升高(2.01±0.06 vs.1.00%±0.03, P<0.05)。与H/R组相比,H/R+1%CGFe组p53的mRNA水平明显从2.01±0.06降低至1.55±0.04(P<0.05);与H/R+1%CGFe组相比,H/R+5%CGFe组p53的mRNA水平明显从1.55±0.04降低至1.26±0.03(P<0.05);与H/R+5%CGFe组相比,H/R+10%CGFe组p53的mRNA水平明显从1.26±0.03降低至1.09±0.02(P<0.05)(P<0.05)(图4)。

图4 缺血再灌注MLO-Y4细胞的p53的mRNA水平检测
3 讨 论
骨损伤导致血液供应受损,影响骨修复及愈合。如何最大程度降低缺血缺氧导致的骨修复及骨愈合障碍是亟须解决的问题,其中骨细胞凋亡发挥重要作用。在本研究中,我们首次研究证实CGFe可抑制缺氧再灌注状态下骨细胞的凋亡。
与富含血小板的纤维蛋白的生产类似,CGF的生产过程是完全自然的,无需添加任何生化制剂。因此,CGF避免了免疫反应、毒性、交叉污染和伦理问题。此外,CGF由多种生长因子和细胞因子组成,如转化生长因子、胰岛素样生长因子、血小板衍生生长因子和血管内皮生长因子[6],细胞增殖和成骨分化受多种生长因子调控,包括骨形态发生蛋白、转化生长因子、血小板生长因子、胰岛素样生长因子等。研究表明,CGF可以增加骨形成,但是CGF对骨损伤修复研究尚不明确,众所周知,骨细胞凋亡与骨损伤修复障碍的发展有关[7],本研究结果显示,10%CGFe的抑制作用明显比5%CGFe和1%CGFe更强,即在10%浓度以内时CGFe抑制凋亡作用与浓度呈正相关,伴随caepaes-3活性下降。本研究证明了体外条件下CGF可抑制缺氧再灌注诱导的骨细胞的凋亡,人颅颌面部损伤发生的机率较身体其他部位高,尤其是下颌骨处于颅颌面部前下端,更易受损。因此,对下颌骨撞击伤的研究长久以来都是创伤领域的重点。CGF在骨损伤修复中重要作用为下颌骨创伤修复提供了基础依据,具有重要的研究意义。
