同步加量调强放疗联合替莫唑胺对非小细胞肺癌脑转移的治疗效果与MGMT和Tiam1表达的关系
2020-11-26柴丽霞杨世荣马莉莎韩国雄
柴丽霞, 王 嵘, 杨世荣, 马莉莎, 华 毛, 韩国雄, 荀 森
(青海省第五人民医院肿瘤放疗二病区, 青海 西宁 810007)
约10%~30%的非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者可发生脑部转移,成为了NSCLC患者的首要死因[1]。全脑放疗是当前脑转移肿瘤的常规治疗手段,替莫唑胺为能通过血脑屏障及增加放疗敏感性的新型咪唑四嗪类抗肿瘤药物[2],而同步加量调强放疗联合替莫唑胺用于非小细胞肺癌脑转移患者的治疗有助于降低不良反应,提高近期疗效和改善患者生命质量。有研究发现,作为DNA修复酶的O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)和与肿瘤转移关系密切的T淋巴瘤侵袭转移诱导因子1(T lymphoma invasion and metastasis-inducing protein 1,Tiam1)在NSCLS脑转移患者中的表达明显增加[3],而目前关于同步加量调强放疗联合替莫唑胺对NSCLS脑转移患者的治疗效果与MGMT和Tiam1表达之间关系的报道甚少,故本研究旨在分析同步加量调强放疗联合替莫唑胺对NSCLS脑转移患者的治疗效果与MGMT和Tiam1表达的关系,以期从分子层面对NSCLC脑转移的治疗提供新的研究方向。
1 资料与方法
1.1一般资料:选取2018年10月至2019年10月于我院就诊的60例NSCLC脑转移患者作为研究对象,其中男性34例,女性26例,年龄39~76岁,平均年龄(58.93±9.47)岁。纳入标准:①均经病理切片确诊为NSCLC,并通过头颅增强电子计算机断层扫描(CT)或核磁共振成像(MRI)证实存在颅内有可测量NSCLC转移病灶;②卡氏评分(Karnofsky score,KPS)≥70分;③预计生存时间大于3个月;④无明显放疗及替莫唑胺使用禁忌症;⑤配合研究者。排除标准:①伴心脏、肝肾功能严重障碍者;②伴其他恶性肿瘤、血液系统或免疫系统疾病者;③对替莫唑胺过敏者;④不配合本次研究或中途退出者。本研究经患者知情同意并签署知情同意书,且获得医院伦理委员会批准。
1.2方 法
1.2.1MGMT和Tiam1的检测:MGMT和Tiam1检测使用免疫组化法,兔抗人Tiaml多克隆抗体(浓缩型)、小鼠抗人MGMT单克隆抗体、DAB显色剂、鼠抗人单克隆抗体PR工作液和免疫组化P-V试剂盒等均采购于北京中杉金桥生物技术有限公司。具体步骤:①将病理科保存的患者肺脏石蜡组织均作4μm连续切片;②将切片脱蜡并水化,PBS液冲洗3次(每次3min);③乙二胺四乙酸(EDTA)抗原修复液高压条件下进行Tiam1抗原修复3min;④所有切片均于室温条件下使用Hydrogen Peroxide Block液孵育10min,PBS液冲洗3次(每次3min);⑤于切片上滴加相应一抗工作液,4℃冰箱湿盒过夜,PBS液冲洗3次(每次3min);⑥加入生物素标记的二抗,室温孵育30min,PBS液冲洗3次(每次3min);⑦加入新鲜配制的DAB显色液,于显微镜下观察显色3~10min。切片阳性对照为相应的已知MGMT(+)或Tiam1(+)肺癌组织,阴性对照为一抗使用PBS代替的空白对照。结果判读:MGMT阳性结果为细胞核出现淡黄色~棕黄色颗粒,Tiam1阳性结果为细胞浆出现黄色颗粒。于高倍镜(×400)下选取5个目标细胞表达密集视野进行计数,每视野计数100个细胞,统计阳性细胞所占百分比。阳性为阳性细胞百分比≧10%,阴性为阳性细胞百分比<10%。
1.2.2治疗方法:本研究NSCLC脑转移瘤的治疗采用同步加量调强放疗并同时口服替莫唑胺,具体如下:所有患者在行放疗时,均使用头部热塑膜面罩进行固定,采用螺旋CT进行扫描,扫描层厚为3mm,参考脑部增强MRI图像在定位增强CT上勾画肿瘤靶区(gross tumor volume,GTV),计划肿瘤靶区(planned tumor volume,PGTV)剂量为60Gy/3Gy/20F,全脑剂量(PTV-Brain)为40Gy/2Gy/20F,各重要器官组织限量按照美国肿瘤放射治疗协作组(American cancer radiotherapy cooperation group,RTOG)急性放射损伤分级标准头颈部肿瘤剂量限定标准设定。患者于放疗的第1天开始口服替莫唑胺(采购于江苏天士力帝益药业有限公司,国药准字号:H20040637,剂量为75mg·m2·d-1,放疗日口服,放疗结束后继续予以连续6个周期、剂量为150mg·m2·d-1的替莫唑胺口服辅助放疗,每次连续服用5d,28d为1周期。在患者的整个放疗期间,根据患者的症状及病情,适当予以地塞米松及甘露醇脱水等对症治疗。
1.2.3疗效评价标准:每例患者以治疗前的脑部MRI和CT影像学表现为基线,在联合治疗结束1月后复查脑部MRI或CT来评价近期疗效,此后每2月再行评价。随访时间为48月以内或至患者死亡。采用实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)1.1版本[4]行疗效判断:①完全缓解(complete response,CR):所有病灶全部消失且达4周以上;②部分缓解(partial response,PR):靶病灶的最长径之和较基线状态缩小≧30%;③疾病进展(progressive disease,PD):靶病的最长径之和较基线状态增加≧20%,并且其绝对值增加≧5mm或者新的病灶出现;④疾病稳定(stable disease,SD):靶病灶最长径之和较基线状态缩小但没有达PR标准或靶病灶最长径之和较基线状态缩小有增加但没有达PD标准;⑤总有效率(relief rate,RR)=完全缓解率(CR)+部分缓解率(PR);疾病控制率(disease control rate,DCR)=完全缓解率(CR)+部分缓解率(PR)+疾病稳定率(SD)。
1.3统计学分析:采用SPSS19.0进行数据处理。计数资料的表示用例数(n)或百分比(%),比较用χ2检验。用Kaplan-Meier法进行生存分析,组间比较为Log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1NSCLC组织MGMT和Tiam1免疫组化镜检图,见图1。

图1 NSCLC组织MGMT和Tiam1免疫组化镜检图
2.2MGMT和Tiam1的不同表达与患者疗效间的关系:60例患者中,MGMT(+)及Tiam1(+)21例,MGMT(+)及Tiam1(-)16例,MGMT(-)及Tiam1(+)17例,MGMT(-)及Tiam1(-)6例。MGMT和Tiam1的不同表达与患者疗效间的关系见表1。
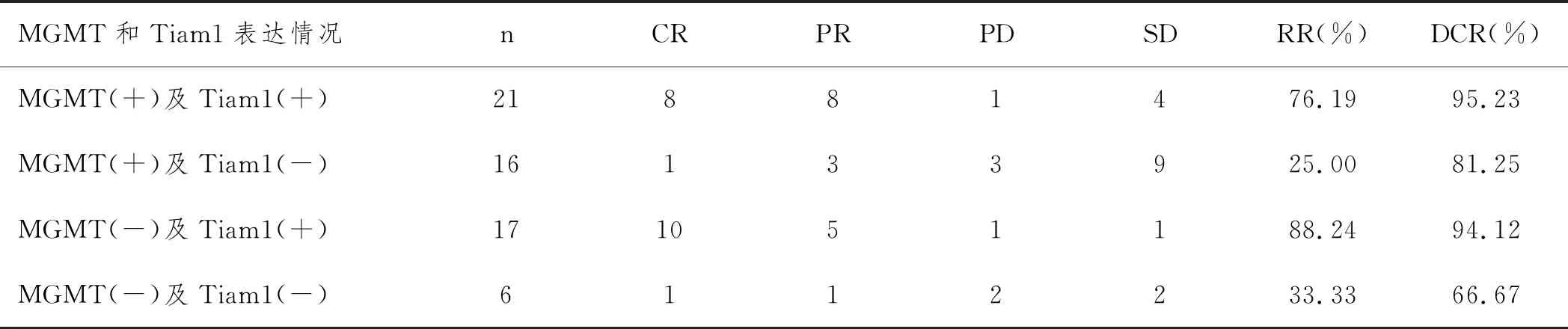
表1 MGMT和Tiam1的不同表达与患者疗效间的关系
2.3生存分析:60例患者的随访时间为1~45.35个月,随访中位时间为16.75月,中位生存时间为13个月[95%CI(2.92,19.53)],1年、2年和3年生存率分别为75.01%、53.86%和25.31%,见图2。其中21例MGMT(+)及Tiam1(+)患者中位生存时间为13个月[95%CI(9.83,16.15)],1年2年和3年生存率分别为64.32%、45.15%和20.33%。16例MGMT(+)及Tiam1(-)患者中位生存时间为6个月[95%CI(3.53,8.34)],1年、2年和3年生存率分别为33.69%,20.01%和0.00%。17例MGMT(-)及Tiam1(+)患者中位生存时间为15个月[95%CI(10.87,17.69)],1年、2年和3年生存率分别为92.05%、74.12%和40.09%。6例MGMT(-)及Tiam1(-)患者中位生存时间为10个月[95%CI(8.93,15.01)],1年、2年和3年生存率分别为55.63%,47.35%和18.96%。

图2 60例NSCLC脑转移患者总体生存曲线
3 讨 论
当前,针对NSCLC的分子靶向治疗,已经在一定程度上明显改善了患者的预后,然而仍存在预后结局不太满意的情况,其原因主要在于NSCLC患者晚期脑转移的发生。据文献报道,影响晚期NSCLC脑转移患者治疗效果的主要因素包括年龄、确诊时间、颅内疾病的部位及范围等[5],因此,NSCLC的尽早有效治疗能在一定程度上降低影响因素带来的不良后果。约10%~20%NSCLC患者在初次诊断时发现有脑转移,NSCLC合并脑转移患者的总生存率很低,约2/3脑转移患者表现为多发性病灶,其余1/3脑转移患者表现为单发病灶,NSCLC患者脑转移的主要部位是大脑(80%)、小脑(15%)和脑干(5%),这使得NSCLC脑转移瘤的治疗具有难度和需要尽可能的制定个体化方案。
靶向治疗和免疫治疗已成为新的且更为量身定制的治疗方法,可重复评估的肿瘤生物学标准已成为驱动临床决策的关键性因素。肿瘤组织活检是诊断肿瘤的金标准,活检组织生物学标志物的探讨成为了研究和揭示肿瘤分子靶向治疗的热点。放射治疗在脑转移瘤治疗中的作用越来越明确,NSCLC脑转移的治疗已从局部治疗发展到全脑放射治疗,以及有效化疗药物与全脑放疗的联合治疗能更有效地提高临床治疗效果与患者生存率[6]。同步加量调强放疗可以将多个、不同体积的病灶整合至一个计划中,提高了肿瘤病灶照射剂量,缩短了治疗时间,保证了正常组织器官耐受剂量,使得放疗计划优化程度得到最大化,放射反应得到减少,放射并发症得到有效控制,颅内肿瘤局部控制率得到有效提高,患者受益度得到有效保证[7]。替莫唑胺作为容易穿透血脑屏障的第二代口服烷化剂,能够有效减轻脑转移瘤引起的临床症状并延长患者的中位生存时间[1]。有文献报道NSCLC脑转移患者肺癌组织活检或血清检测发现大部分患者存在MGMT和Tiam1表达升高的情况[8],而当前关于同步加量调强放疗联合替莫唑胺对NSCLC脑转移瘤治疗效果与MGMT和Tiam1表达之间是否存在相关性尚不可知。
本文研究发现60例NSCLC脑转移患者1年、2年和3年生存率分别为75.01%、53.86%和25.31%,高于既往研究报道[9],表明同步加量调强放疗联合替莫唑胺对NSCLC脑转移瘤治疗效果显著。我们还首次报道了同步加量调强放疗联合替莫唑胺对NSCLC脑转移瘤治疗效果与MGMT和Tiam1之间的相关性,结果发现:MGMT(+)及Tiam1(+)患者的治疗RR为76.19%,DCR为95.23%,MGMT(+)及Tiam1(-)患者的治疗RR为25.00%,DCR为81.25%,MGMT(-)及Tiam1(+)患者的治疗RR为88.24%,DCR为94.12%,MGMT(-)及Tiam1(-)患者的治疗RR为33.33%,DCR为66.67%,表明MGMT(+)及Tiam1(-)患者的RR和DCR比率远低于其他组合患者,且生存分析发现其1年、2年和3年生存率也较其他组合患者低,进一步说明MGMT和Tiam1可作为NSCLC脑转移患者诊断和治疗评估以及靶向治疗研究的指标。这一情况的发生可能与作为DNA修复蛋白的MGMT功能甲基化以及Tiam1活性增加从而对抑癌基因负向调控作用有关,具体机制有待于进一步的研究探讨。
综上所述,MGMT和Tiam1在肺癌组织的不同表达与同步加量调强放疗联合替莫唑胺对NSCLS脑转移患者的治疗效果相关,具有临床应用价值。
