白蛋白结合型紫杉醇在晚期非小细胞肺癌治疗中的临床效果分析
2020-11-17徐小军
王 磊 徐小军 樊 辰
江苏省泰州市第四人民医院肿瘤内科,江苏泰州 225300
我国是肺癌大国,据统计,每年新发78.7 万例患者,死亡63.1 万例,其中85% 为非小细胞肺癌(NSCLC)[1]。有数据显示,57% 的肺癌患者在初诊时已发生了远处转移[2]。晚期NSCLC 患者众多,其全身治疗方法有化学治疗、靶向治疗、抗血管生成治疗、免疫治疗[3]。化学治疗历史悠久,一线治疗进展后二线药物治疗效果有限,三线无标准治疗方案,采用新的化疗药物单独或联合其他药物的治疗在不断的尝试中。白蛋白结合型紫杉醇(Nab-P)是新型的紫杉类化学药物,利用纳米技术能够提高肿瘤组织中紫杉醇的浓度,从而提高疗效,又避免了普通紫杉醇采用聚氧乙烯蓖麻油作溶剂带来的副作用[4]。2004 年Nab-P 在美国上市,2012 年FDA 批准其应用于晚期NSCLC 的治疗[5],2018 年国产Nab-P 上市,进入国家医保目录,患者负担费用下降90.7%,临床得以更大规模的使用。本研究对晚期NSCLC 患者二线及以上采用Nab-P 单药或联合抗血管生成药物进行治疗,观察疗效和不良反应,现报道如下。
1 资料与方法
1.1 一般资料
选择2018 年11 月~2019 年5 月泰州市第四人民医院肿瘤内科收治的51 例ⅢB/ Ⅳ期NSCLC患者。纳入标准:经组织学或细胞学证实的晚期NSCLC;有可测量病灶;PS 评分0 ~2 分。排除标准:中枢神经系统转移;重要脏器功能不全;合并其他未治愈恶性肿瘤。符合条件的患者男38 例,女13 例;年龄46 ~74 岁,中位年龄66 岁,<65 岁24例,≥65岁27例;鳞癌12例,腺癌39例;ⅢB期11例,Ⅳ期40 例;EGFR 突变20 例,无突变28 例,未检测3 例;单药32 例,联合贝伐单抗5 例,联合恩度8 例,联合安罗替尼6 例;二线化疗8 例,三线化疗30 例,四线化疗8 例,五线化疗5 例;ECOG 评分0 ~1分42 例,2 分9 例。
1.2 治疗方案
所有患者采用白蛋白结合型紫杉醇(江苏恒瑞,H20183378)130mg/m2静滴d1、8。5 例联合贝伐珠单抗[Roche Pharma (Schweiz) Ltd,S20170035]7.5mg/kg 静滴d1;8 例联合重组人血管内皮抑制素(山东先声,S20050088)30mg 静脉持续泵入给药,d-3 ~4;6例联合安罗替尼(正大天晴,H20180004)12mg 口服,d1 ~14。每3 周为1 个治疗周期。治疗直至病情进展或患者不能耐受化疗或拒绝化疗。
1.3 疗效判定标准
所有患者治疗前行影像学基线检查。每2 个周期后影像学检查评价疗效。按照RECIST1.1[6]标准确定疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。 客观缓解率(ORR)= CR+PR,疾病控制率(DCR)=CR+PR+SD。无进展生存期(PFS)是开始化疗至病情PD 或死亡的时间。不良反应按照CTCAE4.0 标准评价[7]。
1.4 统计学方法
应用SPSS25.0 统计学软件进行分析,计数资料以[n(%)] 表示,采用χ2检验或Fisher精确法,生存分析采用Kaplan-Meier法,log-rank做组间比较。P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效
51 例患者共化疗252 周期,中位化疗周期数为4 个周期,其中无CR 患者,PR 13 例,SD 25 例,PD 13 例,ORR 25.5%,DCR 74.5%。 按照病理类型亚组分析,腺癌PR 9 例,SD 18 例,PD 12 例,ORR 23.1%,DCR 69.2%。鳞癌PR 4 例,SD 7 例,PD 1 例,ORR 33.3%,DCR 91.7%。按不同治疗方法亚组分析,单药组PR 7 例,SD 16 例,PD 9 例,ORR 21.9%,DCR 71.9%。联合组PR 6 例,SD 9 例,PD 4 例,ORR 31.6%,DCR 78.9%。联合贝伐单抗中,PR 2 例,SD 2 例,PD 1 例,联合重组人血管内皮抑制素中,PR 2 例,SD 4 例,PD 2 例,联合安罗替尼中,PR 2 例,SD 3 例,PD 1 例。按照治疗线数亚组分析,二线的ORR 和DCR 分别是37.5% 和87.5%,三线及以上的ORR 和DCR 分别是23.2% 和72.1%。鳞癌、联合组、二线的ORR、DCR 较好,但差异无统计学意义(P>0.05)。
从治疗开始随访至2020 年1 月,患者的中位PFS 为3.9 个月。 采用Kaplan-meier法进行单因素分析,显示性别、年龄、病理、线数、ECOG 评分对PFS 无明显影响(P>0.05),治疗方法对PFS 有明显影响,单药组和联合组的PFS 分别是3.5 和4.8个月,差异有统计学意义(P<0.05)。见图1~2,表1。
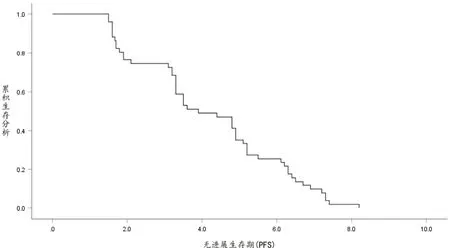
图1 患者的无进展生存期(PFS)

图2 单药组和联合组的无进展生存期(PFS)
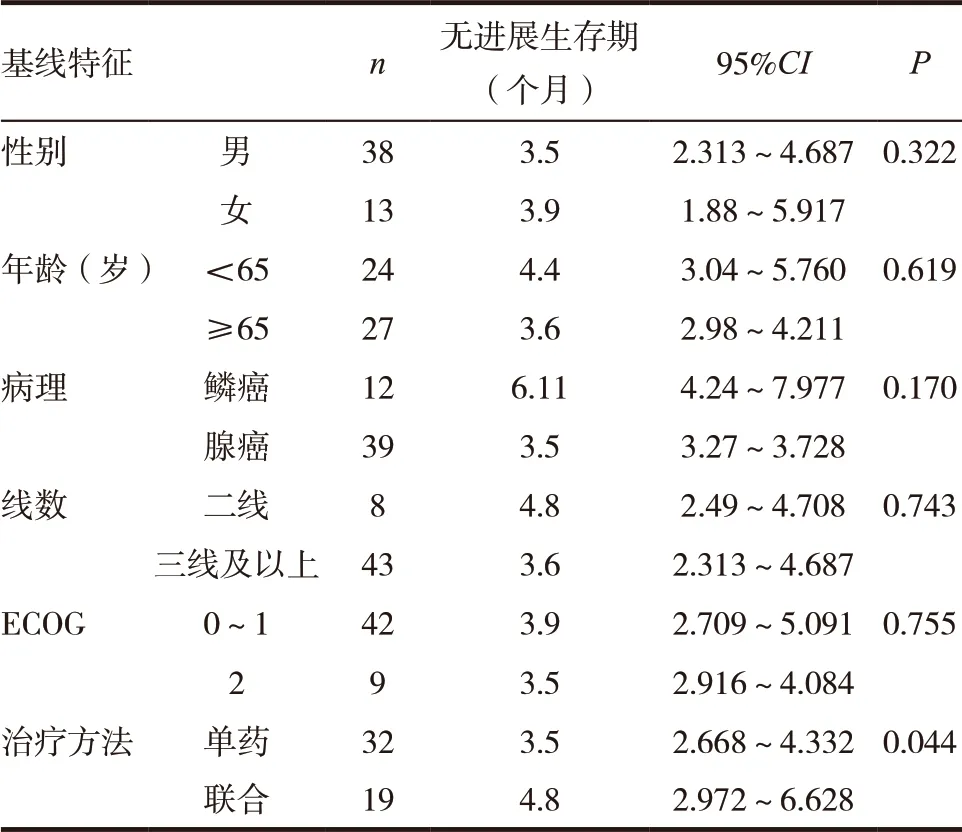
表1 患者临床特征与中位无进展生存期(PFS)的单因素分析
2.2 不良反应
患者主要发生的不良反应有中性粒细胞减少(51.0%),贫血(21.6%),恶心、呕吐(54.9%),乏力(60.8%),周围神经毒性(25.5%),肌肉关节疼痛(15.7%),大多为1 ~2 级,3 级不良反应发生率低,无4 级不良反应发生。见表2。

表2 患者的不良反应[n(%)]
3 讨论
NSCLC 的治疗近年来进展迅速,驱动基因阳性的晚期NSCLC 患者推荐一线靶向药物治疗,驱动基因阴性的晚期NSCLC 患者推荐一线双药联合化疗[8]。靶向治疗失败的患者二线可选择全身化疗,一线化疗失败的患者二线可采用单药全身化疗[9]。目前一线化疗失败的患者大多数采用多西他赛或者培美曲塞二线治疗。研究显示,多西他赛二线治疗NSCLC 的ORR 为7.1%,TTP 为2.7 个月[10]。培美曲塞二线治疗NSCLC 的ORR 为9.1%,PFS 为2.9个月[11]。三线治疗建议临床试验。传统二线药物治疗的疗效不够理想,临床上观察到一些体质状态较好的患者三线及以上采用全身化疗仍有一定的疗效和疾病控制率。随着国产Nab-P 的研制成功且进入了医保,药品的价格大幅度下降,经济条件一般的患者也能承受,临床使用的可能性大增。抗血管生成药物(贝伐单抗、重组人血管内皮抑制素、安罗替尼)属于特殊药品,有一定经济实力的患者也能够承受联合应用。免疫抑制剂因为价格和可及性的问题,临床使用的概率不高。因此,Nab-P 能够成为二线及以上单药或联合治疗的广泛应用方案之一。
Socinski 等[12]发现,Nab-P 联合卡铂一线治疗晚期NSCLC,周剂量疗效优于3 周治疗方案,ORR为 48%,PFS 为6 个月,且不良反应低于3 周治疗方案。邢镨元等[13]采用Nab-P 单药治疗二线以上23 例晚期NSCLC,ORR 为26.1%,DCR 为69.6%,PFS 为5.33个月。一项中国人群回顾性分析表明对于晚期非鳞NSCLC,含贝伐单抗的一线联合化疗ORR 和DCR 有改善趋势,PFS 显著长于不含贝伐单抗组(9.7 vs. 7.0 个月,P<0.05)[14]。一项Ⅲ期临床研究显示,重组人血管抑制素联合长春瑞滨和顺铂一线治疗晚期NSCLC,能提高ORR(35.4% vs. 19.5%,P<0.05)和DCR(73.3% vs. 64.0%,P<0.05),延长TTP(6.3 vs. 3.6 个月,P<0.001)[15]。安罗替尼对比安慰剂三线治疗NSCLC 能够显著延长PFS(5.4 vs. 1.4 个月,P<0.001)[16]。
本研究对于Nab-P 采用第1、8 天静脉输注,每3 周1 个周期,二线及以上采用单药或联合贝伐单抗、重组人血管抑制素、安罗替尼,取得较好的疗效,ORR 是25.5%,DCR 是74.5%,PFS 是3.9 个月。采用Nab-P 的治疗疗效优于传统的二线化疗药物多西他赛和培美曲塞。
亚组分析显示,不同的治疗方法对PFS 有显著影响,而性别、年龄、病理、线数、ECOG 评分对PFS无明显影响。联合组的ORR 和DCR 分别是31.6%和78.9%,优于单药组的ORR (21.9%)和DCR (71.9%),但差异无统计学意义(P>0.05)。联合组的无进展生存期(PFS)4.8 个月优于单药组的3.5个月,差异有统计学意义(P<0.05)。ULTIMATE研究采用贝伐单抗联合紫杉醇二、三线治疗非鳞NSCLC 的ORR 为22.5%,PFS 为5.4 个月[17]。廖万清等[18]采用多西他赛联合重组人血管抑制素二线治疗晚期NSCLC 的ORR 是43.33%,DCR 为90%,PFS 为4.96 个月。本研究的结果与之相似。
含Nab-P 的化疗方案出现的不良反应主要为中性粒细胞减少(51.0%),贫血(21.6%),恶心、呕吐(54.9%),乏力(60.8%),周围神经毒性(25.5%),肌肉关节疼痛(15.7%),大多为1 ~2 级,患者能够耐受。亚组分析联合组出现了高血压(31.6%,P <0.05),手足皮肤反应(26.4%,P <0.05),对症治疗症状改善。
本研究为小样本,观察到Nab-P 的疗效,无论单药或联合,都有良好的疗效,且不良反应能够耐受。亚组分析显示联合抗血管生成药物的疗效更佳,但是重组人血管抑制素、贝伐单抗或是安罗替尼联合Nab-P 的疗效可能存在差异,因为本研究样本量不足,今后还需要开展足够样本量的进一步队列研究。
