慢性心力衰竭合并贫血患者Fe、TNF-α、IL-6、IL-1β与铁调素的水平及相关性研究
2020-11-17李瑞婷刘小方李国庆
李瑞婷 程 慧 刘小方 李国庆▲
1. 石河子大学医学院,新疆石河子 832000;2. 新疆维吾尔自治区人民医院心内科,新疆乌鲁木齐 830000
慢性心力衰竭(chronic heart failure,CHF)是各种心脏疾病发生发展过程中的严重和终末阶段,其中贫血是引起该病患者二次住院率与死亡率高的一个独立危险因素[1]。相关研究表明,心力衰竭患者中40% ~70% 合并贫血[2]。CHF 合并贫血的病理变化过程相当复杂。铁调素(hepcidin)作为参与铁代谢的核心调节因子,可能与CHF 的发生、发展有一定关系[3]。据报道,成人CHF 的患病率在发达国家中为1% ~2%,而在70 岁以上的受试者中这一比率可上升至>10%[4]。贫血作为CHF 的重要并发症之一,与CHF 的发生、发展密切相关,可作为CHF 不良预后的一个独立危险因素[5]。与CHF 病理生理学过程有关的主要炎症因子有IL-1、IL-6、TNF-α、Fas 配基、核因子-kb(NK-kb)、单核细胞趋化蛋白-1、黏附分子(ICAM-1、VCAM-1)等。本研究拟通过检测CHF 合并贫血患者血清铁调素、血清Fe、IL-6、IL-1β 及TNF-α 的含量,初步揭示CHF 合并贫血患者血清铁调素、血清Fe、IL-6、IL-1β 及TNF-α 的水平变化规律,并探讨在CHF 合并贫血患者中这些指标变化的病理生理学意义。
1 资料与方法
1.1 一般资料
选取2019 年3 月1 日~12 月31 日在新疆维吾尔自治区人民医院心血管内科因心力衰竭症状住院且符合心力衰竭诊断标准[6]的患者130 例。根据贫血标准[7]定为女性Hb<110g/L,男性Hb<120g/L, 将其分为CHF 合并贫血患者65 例和CHF 不合并贫血患者65 例。排除标准:近期由于使用激素或其他疾病引起的贫血、病程<180d、有严重肝肾功能不全、恶性肿瘤、先天性心脏病、感染性心内膜炎、系统性红斑狼疮、血液系统疾病等患者。其中非贫血组男48 例,女17 例;年龄33 ~87 岁,平均(65.3±12.3)岁。贫血组男40 例,女25 例;年龄42 ~88 岁,平均(66.4±11.6)岁。两组患者年龄、性别等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 检测方法
采集符合标准的患者入院后次日早餐前静脉血液3 ~5mL,运用血液分析仪检测血红蛋白含量;使用酶联免疫吸附测定法对两组患者血清中铁调素、IL-6、IL-1β 及TNF-α 的含量进行检测;运用亚铁嗪比色法检测两组患者血清中Fe 的含量。
1.3 观察指标
对两组患者的血清中Fe、IL-6、IL-1β、TNF-α、铁调素水平进行比较;对CHF 合并贫血患者血清Fe、IL-6、IL-1β、TNF-α 与血清铁调素水平进行相关性分析。
1.4 统计学方法
使用SPSS21.0 统计学软件进行分析,计量资料均用()表示,采用t检验,各变量间相关性运用直线相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组性别、年龄、吸烟史、饮酒史、高血压、糖尿病、左室射血分数(LVEF)比较,差异均无统计学意义(P>0.05),见表1。
2.2 两组患者铁调素、Fe、IL-6、IL-1β及TNF-α水平比较
CHF 合并贫血组患者铁调素、IL-6、IL-1β、TNF-α 较非贫血组患者较明显升高,Fe 水平较非贫血组明显降低,差异有统计学意义(P<0.05),见表2。
2.3 CHF合并贫血患者血清铁调素水平与Fe、IL-6、IL-1β及TNF-α水平之间的线性相关分析
CHF 合并贫血患者铁调素与IL-6 水平呈正相关,并且随着IL-6 浓度升高,铁调素水平也呈上升趋势。CHF 合并贫血患者铁调素与Fe 水平呈负相关,并且随血清Fe 浓度升高,血清中铁调素水平呈逐渐下降趋势。CHF 合并贫血患者的血清铁调素水平与IL-1β 水平呈正相关,并且随IL-1β 浓度升高,铁调素水平呈上升趋势,CHF 合并贫血患者的血清铁调素水平与TNF-α 水平呈正相关,并且随TNF-α 浓度升高,铁调素水平呈上升趋势,见表3,图1 ~4。
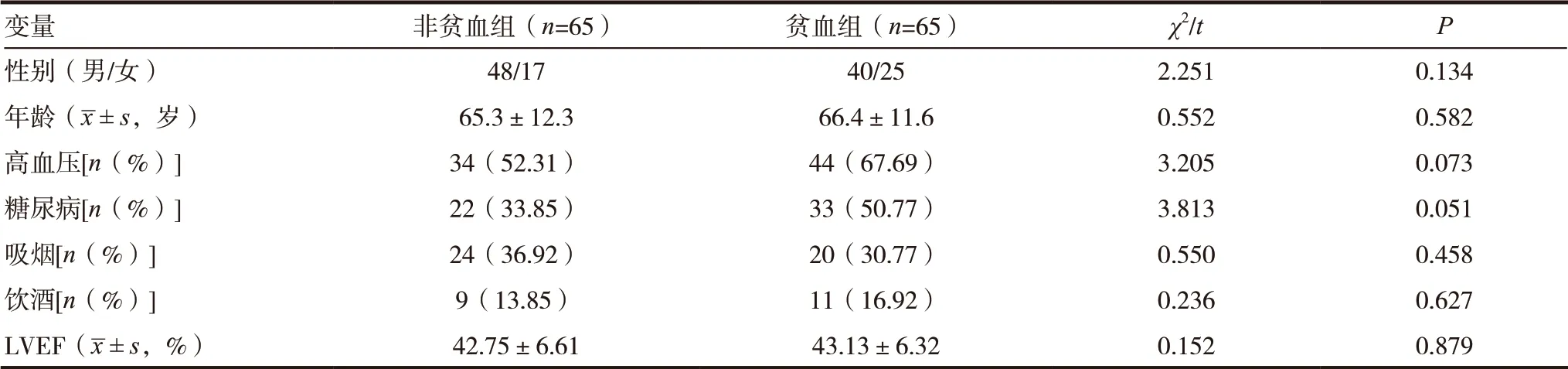
表1 两组一般资料比较
表2 两组患者铁调素、IL-6、IL-1β、TNF-α水平比较(± s)
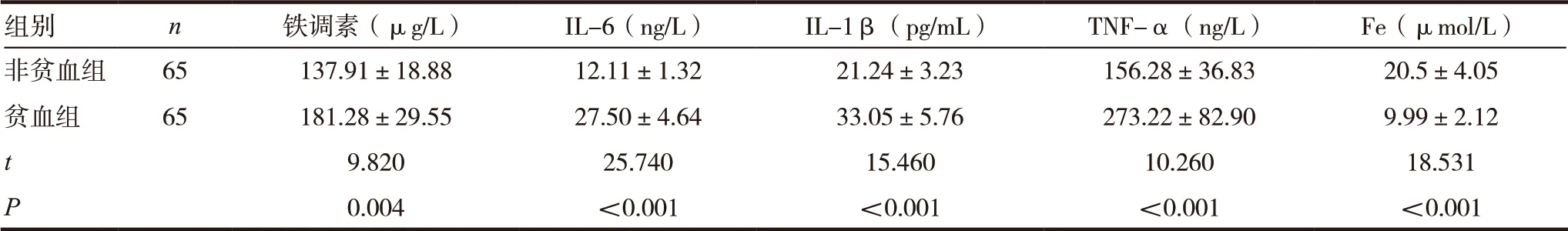
表2 两组患者铁调素、IL-6、IL-1β、TNF-α水平比较(± s)
组别 n 铁调素(µg/L) IL-6(ng/L) IL-1β(pg/mL) TNF-α(ng/L) Fe(µmol/L)非贫血组 65 137.91±18.88 12.11±1.32 21.24±3.23 156.28±36.83 20.5±4.05贫血组 65 181.28±29.55 27.50±4.64 33.05±5.76 273.22±82.90 9.99±2.12 t 9.820 25.740 15.460 10.260 18.531 P 0.004 <0.001 <0.001 <0.001 <0.001
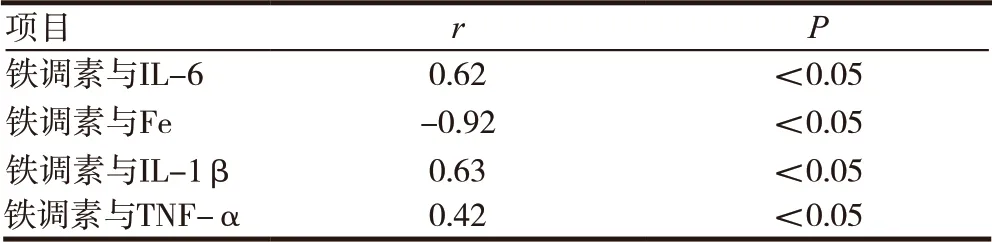
表3 CHF合并贫血患者铁调素水平与血清Fe、IL-6、IL-1β、TNF-α水平之间的线性相关性
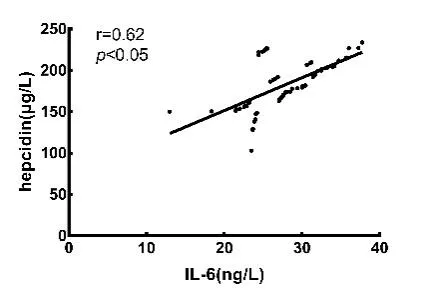
图1 贫血组血清铁调素与IL-6 的相关性分析
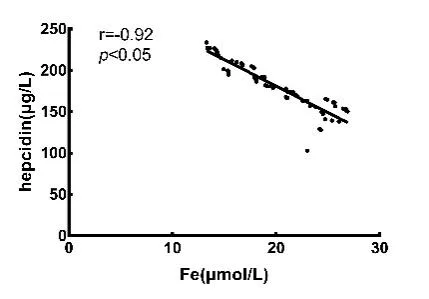
图2 贫血组血清铁调素与Fe 的相关性分析
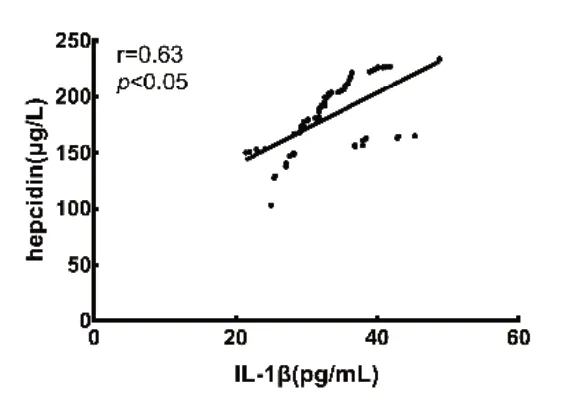
图3 贫血组血清铁调素与IL-1β 的相关性分析
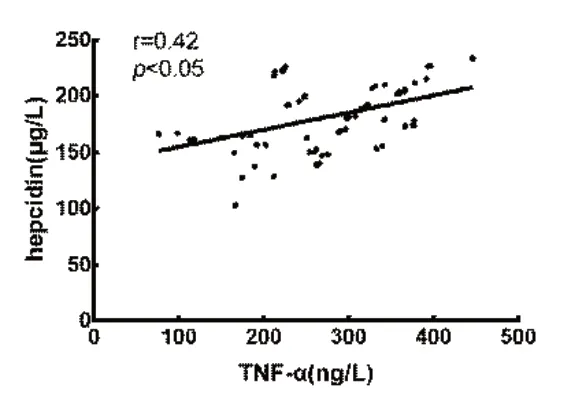
图4 贫血组血清铁调素与TNF-α 的相关性分析
2.4 CHF合并非贫血患者血清铁调素水平与IL-6、IL-1β水平之间的线性相关性分析
CHF 合并非贫血患者的铁调素与IL-6 水平无相关性,CHF 合并非贫血患者的血清铁调素水平与IL-1β 水平也无相关性。

表4 CHF合并非贫血患者铁调素水平与IL-6、IL-1β水平之间的线性相关性
3 讨论
随着人们的生活节奏逐渐加快及人口老龄化的速度逐渐加快,CHF 入院治疗人数逐年增多,为患者及其家属与医疗资源带来巨大的负担。目前研究结果表明,40% ~70% 的心力衰竭患者合并贫血[2],并且血清中血红蛋白水平与住院风险和死亡率呈负相关。通过研究发现,CHF 合并贫血患者的死亡率约为46.8%,而CHF 不合并贫血的患者死亡率仅为29.5%。目前,对心力衰竭合并贫血的治疗缺乏明确的靶点,也没有具体的治疗方法[8]。铁调素是近期新发现的多肽类激素,其可以调节铁代谢,并且富含半胱氨酸,通过肝脏特异性表达并分泌,其属于高度保守防御性蛋白[9]。铁调素对铁代谢的负性调节主要通过作用于膜铁转运蛋白1。在人体缺铁时,通过下调铁调素合成从而增加铁的摄入;当铁过多时,通过增加铁调素合成从而限制铁的摄入。铁调节异常时可导致CHF 患者缺铁及合并缺铁性贫血[3]。作为铁代谢的核心调节因子,CHF 合并贫血的过程中铁调素起着至关重要的调节作用。有研究结果表示,血清中铁调素水平与心力衰竭患者的不良预后呈显著相关关系[10]。
在CHF 患者中,常伴铁缺乏和贫血,并与较低的生活质量和较高的死亡率相关。用促红细胞生成素治疗贫血没有任何改善。因此,近年来的重点已经转移到纠正缺铁的问题上[11]。有研究表明,在CHF 合并贫血患者中约有17% 存在铁缺乏[12]。在CHF 患者中,即便不合并贫血,铁缺乏也会加重潜在的疾病,并与健康相关的生活质量受损及死亡风险增加有关[13]。铁缺乏已被证明可使CHF 患者的住院风险增加2 倍[14]。2016 年欧洲心脏病学会急性和慢性心力衰竭诊断和治疗指南建议对所有新诊断的心力衰竭患者进行铁缺乏症检测[15]。铁缺乏的原因可能是多方面的,包括慢性炎症、铁摄入减少、胃肠道铁吸收减少和失血增加[16-17]。此外,铁缺乏还与铁调素引起的铁代谢失调有关,这主要是由于心力衰竭时炎症因子增加引起铁代谢紊乱,进而最终导致功能性铁缺乏[18]。所以铁代谢在CHF 合并贫血中有着重要的意义。
铁调素的表达调控受多种因素影响。目前发现调控铁调素表达的有BMP-Smad 信号通路[19]及STAT 信号通路[20]。本研究结果显示,CHF 合并贫血组患者的血清中铁调素的水平与IL-6 的水平呈正相关,并且随着IL-6 的浓度的升高,血清中铁调素的水平逐渐上升。有研究表明在炎症状态下,人体主要通过产生IL-6 等在内的多种因子来刺激STAT 通路,增加铁调素表达,影响人体铁吸收。另外,红细胞的生成减少、氧缺乏等因素同样也能影响人体铁调素的充分表达[21]。在CHF 病理变化的过程中,以IL-6 为主要代表的炎症因子的增加,可使铁调素的释放及合成增多,从而引起膜铁转运蛋白1 减少,最终使血浆中可利用铁减少,从而影响红细胞生成;另外,巨噬细胞中的膜铁转运蛋白1可与肝脏中铁调素相结合,促进其内化和降解,阻止肝脏释放铁元素入血液[22]。
本研究另一结果提示CHF 合并贫血患者的血清铁调素与IL-1β 的血清浓度呈正相关。最近,另一种促炎因子IL-1β 被发现通过不同于IL-6介导的铁调素转录机制刺激铁调素的表达。除了IL-6 诱导外,IL-1β 也刺激转录因子C/EBP δ(CCAAT-enhancer-binding protein,C/EBP)的表达,通过铁调素启动子上的C/EBP 结合位点导致铁调素的转录激活[23]。因此,铁调素转录表达是通过多种元件对促炎因子的反应来刺激的。在多种疾病中,IL-1β 的产生增加和铁代谢失调之间的关系已经被提出,这可能与铁调素的过量产生有关。
另外,心力衰竭时血清中TNF-α 的水平升高,干扰肾脏合成EPO,抑制骨髓造血功能[24];TNF-α还可通过抑制红细胞的增殖信号通路,从而减少红细胞生成引起贫血,并可诱导细胞因子如IL-2、IL-6的表达,进而影响铁的代谢。此外本研究CHF 合并贫血患者的血清TNF-α水平与IL-6水平呈正相关,并且随着IL-6 浓度升高,血清的TNF-α 水平呈上升趋势,这一结果与上述结论相符。
本研究通过检测两组患者血清中铁调素、IL-6、IL-1β、TNF-α 等相关指标发现,慢性心力衰竭合并贫血患者的血清铁水平较非贫血组偏低,而血清中铁调素及血IL-6、IL-1β、TNF-α 的浓度水平与非贫血组相比较明显偏高。对以上血清指标进行相关直线分析后表示,贫血组患者铁调素与铁的水平呈负相关,血清铁调素与血清IL-6、IL-1β 水平呈正相关。综上所述,CHF 合并贫血与铁代谢呈密切相关,然而铁调素作为铁代谢中心的调节因子,其于炎症因子等因素的影响下会表达量增加,进而导致血清中铁浓度的下降,最终引起心力衰竭患者贫血的发生。但是具体的机制还需要更进一步的研究。
最新文献指出,TNF-α 与射血分数正常的CHF 患者的病情程度相关,血清中IL-6 和TNF-α水平呈正相关关系[25],IL-6 是否也可能对射血分数正常的CHF 患者的病情程度相关有待进一步推论,同样,血清中铁调素和IL-6 水平呈正相关,是否铁调素也可能对射血分数正常的慢性心力衰竭患者的病情程度相关也有待进一步推论。
