定点突变提高食品新型L-天冬酰胺酶的活力及热稳定性
2020-11-11徐书琴胡静怡张恒维赵浩东席毓淋饶志明
徐书琴,胡静怡,张恒维,赵浩东,刘 鹏,席毓淋,李 谞,张 显*,饶志明
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
L-天冬酰胺酶能够通过水解脱氨基反应,将L-天冬酰胺催化形成L-天冬氨酸和氨[1]。目前E.coli、Erwinia chrysanthemi及Erwinia carotovora等微生物来源的L-天冬酰胺酶已经被广泛应用于治疗多种疾病,如急性淋巴白血病和淋巴肉瘤等[2]。但是,该酶的半衰期短、酶活性低、具有副催化反应等缺陷导致在临床应用时会出现一些较严重不适应性。
此外,有研究表明,L-天冬酰胺酶除了在医药方面有非常广泛的应用,其在食品行业也有较好的应用前景。在食品加工处理过程中会产生一种致癌物质丙烯酰胺,而在食品加工处理前加入适量的L-天冬酰胺酶可以有效降低食品中丙烯酰胺的含量。Pedreschi研究显示,在食品预处理过程中加入L-天冬酰胺酶可以使丙烯酰胺的含量下降约92.28%[3]。由于酶促反应的条件一般较温和,在食物加工预处理阶段加入L-天冬酰胺酶,不仅能达到减少丙烯酰胺含量的目的,还不会对食品风味产生较大的影响[4]。并且经过前期的研究证实,在该反应过程中不会生成对人身体有害的物质,因此利用酶法预处理需高温加工的食品原料,是一种可从源头上减少食物中丙烯酰胺生成的有效方法。
近年来,L-天冬酰胺酶在食品产业的应用研究及开发已经受到越来越多的关注,也面临着一些新的挑战。由于食品加工预处理环境条件的复杂性,这就要求酶在较广的pH和温度范围保持高的催化活力。目前,耐高温、耐酸碱、高比酶活的L-天冬酰胺酶在食品工业方面具有更高的潜在应用价值。
为了获得具有满足工业生产及应用需求的蛋白质分子,蛋白质工程手段已被广泛应用于对酶蛋白功能和结构进行改良的研究中[5]。2013年Vidya等研究发现对Escherichia sp.中L-天冬酰胺酶进行点突变后,蛋白质表面环上电荷得到优化,且有效增加了酶的热稳定性[6]。龙水清等对Bacillus subtilis B11-06的L-天冬酰胺酶(BsAII)进行定点突变,筛选得到的L-天冬酰胺酶突变体具有更高的比酶活以及热稳定性[7-8]。
作者基于课题组前期将Pyrococcus yayanosii CH1来源的L-天冬酰胺酶在Bacillus subtilis168中成功克隆表达的基础上,进一步采用分子模拟、定点突变等手段对其进行改造以期提高其比酶活和热稳定性,进一步提高其工业应用价值。
1 材料与方法
1.1 实验材料
E.coli和B.subtilis穿梭质粒pMA5、克隆宿主E.coli JM109、表达宿主B.subtilis 168由作者所在实验室保存。限制性核酸内切酶、PrimeSTAR®HS DNA聚合酶和T4DNA连接酶:购自TaKaRa生物公司(大连,中国);小型质粒快速分离试剂盒、DNA提取试剂盒和Mini DNA快速纯化试剂盒等:购自Sangon Biotech Co.,Ltd(上海,中国);HisTrapTM HP柱:购自GE Healthcare,Inc(英国)。其余试剂为国产分析纯。
1.2 实验方法
1.2.1 L-天冬酰胺酶基因定点突变和重组质粒的构建以实验室已构建的重组质粒pMA5-asn为模板,每一个拟突变株设计2条含有突变位点及重叠部分的引物(见表1)[9],利用这些突变引物通过PCR的方法,使基因在重叠延伸的过程中携带上目的突变点。将获得的PCR产物用BamH I和Mlu I限制性核酸内切酶进行双酶切,并利用琼脂糖凝胶电泳回收该双酶切产物,与同样进行了双酶切及琼脂糖凝胶电泳回收的线性化穿梭质粒pMA5,利用T4 DNA连接酶于16℃连接12 h,并将所得连接产物用热激法转入大肠杆菌E.coli JM109感受态细胞,挑选阳性转化子,提取质粒酶切验证后,再进行测序,检测是否正确引入突变点,并将突变正确的质粒转化入枯草芽孢杆菌Bacilus subtilis 168感受态细胞中。

表1 基因克隆及定点突变引物Table 1 Primers used for site-directed mutagenesis and
1.2.2 L-天冬酰胺酶的表达和纯化将重组枯草芽孢杆菌接种至含有终质量浓度为20μg/mL的卡那霉素的LB培养基中(成分(g/L):NaCl 10,蛋白胨10,酵母浸出物5),于37℃、200 r/min培养12 h,作为种子液。取1 mL该种子液接种在100 mL的新鲜LB培养基上,并在相同条件下培养24 h,得到扩培后的重组枯草芽孢杆菌细胞。将获得的细胞于4℃、10 000 r/min离心10 min,取其上清液作为胞外粗酶液,用于胞外L-天冬酰胺酶酶活测定。取其细胞用裂解缓冲液(50 mmol Tris-HCl缓冲液,pH 8.0)重复洗涤细胞2~3次后,然后在细胞裂解缓冲液中加入6 mg/mL溶菌酶,放置2 h,再于20 MHz,45%功率下,超声处理细胞30 min。将所得细胞裂解物在12 000 r/min下离心25 min,收集上清液作为胞内粗酶液,于-20℃保藏。
胞内粗酶液的分离纯化采取Ni2+亲和层析和AKTA纯化系统(GE Healthcare,瑞典)。以0.5 mL/min的流速将粗酶液加载到利用结合缓冲液(0.02 mol Tris-HCl缓冲液,0.5 mol NaCl,pH 7.4)平衡后的1 mL HisTrap TMHP柱上。采用0~0.5 mol的咪唑线性梯度,1 mL/min的流速洗脱L-天冬酰胺酶。然后将纯化后的酶用PB缓冲液(0.05 mol,pH 7.0)或Tris-HCl缓冲液(0.05 mol,pH 7.0)透析,除去酶液中残存的咪唑。并将最终纯化后的酶进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.3 L-天冬酰胺酶酶活的测定L-天冬酰胺酶活力采用Long和Zuo等人的奈斯勒试剂法,通过测定酶促反应所生成氨的量来计算酶促反应速率[10-11]。酶活力单位定义:在一定条件下,每分钟内产生1μmol氨气所需的酶量为1个酶活单位,采用Bradford法测定蛋白质浓度[12]。在95℃下对底物(1 mL的25 mmolL-天冬酰胺和50 mmol、pH 8.0 Tris-HCl混合物)进行预热后,加入100μL酶溶液,反应进行10 min后加入100μL 15 g/dL的三氯乙酸(TCA)终止反应。反应后的混合物体系以20 000 r/min离心10 min,取200μL澄清上清液加入4.8 mL去离子水中,并加入200μL奈斯勒试剂反应,在450 nm的分光光度计下检测系统中释放的氨的量。对照组在酶促反应前加入100μL的15 g/dL三氯乙酸提前终止反应,以除去由于高温下L-天冬酰胺自水解带来的误差。
1.2.4 L-天冬酰胺酶最适温度、最适pH及温度稳定性测定最适温度测定:在pH 8.0条件下,40~100℃的温度范围内进行酶反应,测定不同温度下的L-天冬酰胺酶酶活,并依此确定其最适温度。
最适pH测定:保持温度为95℃,在不同pH值条件下进行酶反应测定其对应的L-天冬酰胺酶酶活。根据所需的pH值范围采用的不同pH缓冲液分 别 为:0.05 mol乙 酸 盐 缓 冲 液,pH 4.0~6.0;0.05 mol磷酸盐缓冲液,pH 6.0~7.0;0.05 mol Tris-HCl缓冲液,pH 7.0~9.0;0.05 mol甘氨酸-NaOH缓冲液,pH 9.0~10.0。
温度稳定性检测:将含L-天冬酰胺酶的Tris-HCl缓冲液(50 mmol,pH 7.0),置于85℃水浴锅中15~120 min,再在冰上重新折叠15 min,并在95℃、pH 8.0的条件下测定体系中残余的L-天冬酰胺酶酶活性。
1.2.5 L-天冬酰胺酶三维结构模拟及分析使用Prot Param来预测L-天冬酰胺酶的相对分子质量、理论pI和不稳定指数。通过使用SWISS-MODEL同源建模获得L-天冬酰胺酶的结构模型,并使用VERIFY_3D服务器对模型质量进行检测[13-14]。利用PYMOL软件分析氨基酸残基之间的相互作用[15]。
2 结果与分析
2.1 L-天冬酰胺酶分子建模突变点选择
Pyrococcus yayanosii CH1 L-天冬酰胺酶是由987个碱基编码而成的具有328个氨基酸的蛋白质酶。经ProtParam预测得到L-天冬酰胺酶相对分子质量大小约为3.61×104,理论pI值约为5.16,不稳定指数约为29.80,可认为该酶有较好的稳定性[16]。为了对获得的实验结果进行更深层次的分析,将L-天冬酰胺酶PyAsnase的氨基酸序列上传到SWISSMODEL服务器,选择了与其序列相似度达到65%的同源二聚体蛋白为模板,得到了L-天冬酰胺酶的三维结构模型。并利用VERIFY▁3D服务器对获得模型的质量进行数据分析,结果显示92.02%的残基的平均3D-1D的评分大于0.2,已达到了质量检测的标准(≥80%的残基的3D-1D评分大于0.2)[9],可以用于更进一步的研究分析。
为了提高Pyrococcusya yanosii CH1来源的L-天冬酰胺酶的比酶活和热稳定性,挑选3条酶活较高且为嗜热来源的L-天冬酰胺酶,将这些酶的氨基酸序列进行对比(见图1),从而确定与酶活性有关的氨基酸位点以及在高度保守序列附近可能会提高P.yayanosii CH1来源L-天冬酰胺酶的比酶活或热稳定性的突变位点。其中,结合近年来学者们对L-天冬酰胺酶的活性位点的研究,作者认为高度保守的11T、21Y、52S、83T、84D、154K位点为该L-天冬酰胺酶与酶活性有关的位点。在高度保守序列附近,我们发现P.yayanosii CH1来源的L-天冬酰胺酶的氨基酸序列中E22、M92、R111位点与其他3个嗜热来源L-天冬酰胺酶的氨基酸序列差别较大,且其余3个嗜热来源的氨基酸序列在这些位点具有较好的保守性,因此选择这3个位点作为突变位点。突变位点在酶空间结构上的位置如图2所示。
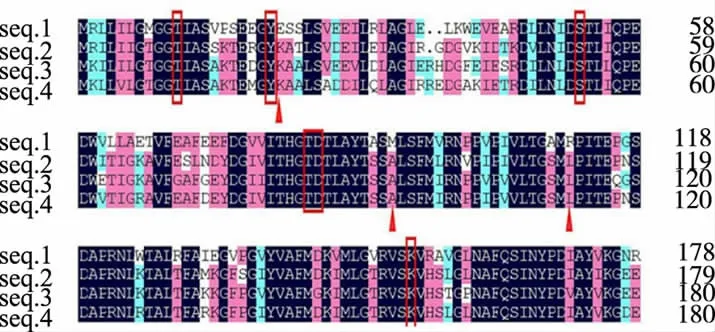
图1 不同来源L-天冬酰胺酶氨基酸序列对比结果Fig.1 Sequences alignment of L-asparaginases from different bacteria

图2 来自Pyrococcus yayanosii CH1的L-天冬酰胺酶三级结构及突变位点示意图Fig.2 Tertiary structure of the P.yayanosii CH1 Lasparaginase and schematic diagram of the mutation sites
2.2 L-天冬酰胺酶突变后酶学性质的研究
按照上述实验方法测定酶的最适温度及最适pH,所得结果如表2所示。可以看出,突变前后酶的最适温度与最适pH基本保持不变,最适温度约为95℃,最适pH值约为8.0。在最适温度(95℃)及最适pH(8.0)条件下分别测定突变体酶与原始酶的酶活,结果显示,E22K突变体酶的酶活约为2 037.13 U/mg,较原始酶酶活(约1 483.81 U/mg)相比提高了约37.3%。R111L突变体酶的酶活约为1 945.11 U/mg,相比于原始酶提高了31.3%。M92A突变体酶的酶活约为1 421.78 U/mg,是原始酶的95%。即可以认为,E22、R111位点的突变可以进一步提高酶的比酶活。M92号位点的突变虽然导致酶活降低,但是波动幅度较小。

表2 突变体酶的酶学性质Table 2 The enzymatic properties of the wild-type and its variants
为了进一步了解酶的热稳定性变化,将含突变体酶与原始酶的缓冲液在85℃水浴锅中放置15~120 min,再在冰上重新折叠15 min,并在95℃、pH 8.0的条件下测定体系中残余的L-天冬酰胺酶酶活性。其中,原始酶、E22K和R111L突变体酶在85℃下,放置105 min仍有较高的酶活,热稳定性基本保持不变。M92A突变体酶在85℃下放置135 min仍有较高的酶活,相比于原始酶延长了30 min。因此,将M92号位点突变成A92在提高酶的热稳定性方面有较好的效果。
2.3 突变体酶三维结构分析
为了分析突变体酶E22K、M92A、R111L的酶活或者热稳定性提高的原因,根据建立的L-天冬酰胺酶蛋白质结构模型,从氨基酸残基间的相互作用力和空间的结构变化的角度来对实验结果进行分析,其变化情况见图3。
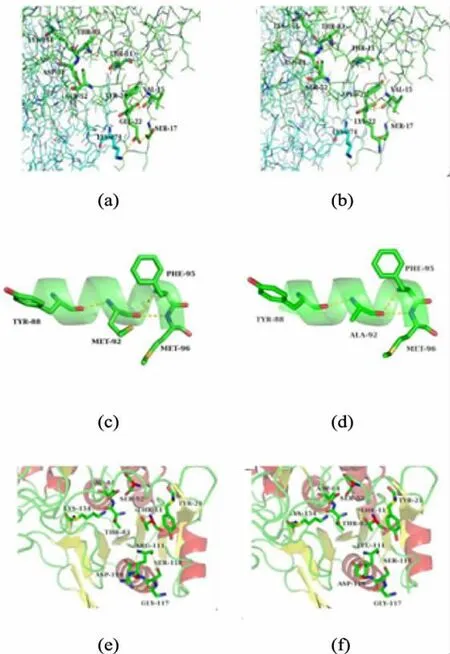
图3 突变前后氨基酸残基的蛋白质三维结构对比Fig.3 Tertiary structures of the wild-type and mutant enzymes
一般认为,活性区域附近的高柔性及更利于底物、产物进入活性口袋的酶结构会使酶出现较高的比酶活和较低的活化能[17-18]。而从图3可以看出,突变残基E22K与R111L分别位于不同的柔性环上。突变前E22与S17、K274残基形成氢键,而突变后,K22与这2个氨基酸残基不能再形成氢键,这种与周围氨基酸残基氢键相互作用的减弱,可能会增加酶活性中心的柔韧度,更有利于对底物的捕捉以及产物的释放,进而提高酶的比活力。同样,突变后的L111不能再与G117形成氢键,增加了酶活性中心的柔韧度,而且突变后的L111的残基比突变前R111的残基小,产生的空间位阻相对较小,进一步促进了底物和产物的进出,从而提高了酶的比活力。
蛋白质的热稳定性一般与蛋白质内部疏水性、表面的亲水性、表面电荷分布以及分子内氨基酸残基的相互作用等有关。从氨基酸残基的蛋白质三维结构图可以看出第92位氨基酸位于α-螺旋中,且将M92换成A92后,酶的热稳定性得到了较大幅度的提高,这表明92号位点对P.yayanosii CH1来源的L-天冬酰胺酶维持三维结构的稳定性有重要的作用。
3 结语
在前期的研究中,学者们大多对枯草芽孢杆菌、大肠杆菌等来源的L-天冬酰胺酶进行蛋白质工程改造,获得的L-天冬酰胺酶突变体热稳定性虽然有所提高,但受到酶来源的限制,其稳定性仍有较高的提升空间。而本实验中利用热稳定性良好的嗜热P.yayanosii CH1来源的L-天冬酰胺酶,通过分子模拟、定点突变等技术对其进行分子改造,进一步提高了该酶的比活力和热稳定性,提高了其在工业、食品方面的应用潜力。证明了L-天冬酰胺酶催化活性中心的柔韧度对比酶活有一定影响,其中的E22K与R111L突变株所得酶的比酶活分别提高了37%和31%,并且证明了位于α-螺旋上的92号位氨基酸对L-天冬酰胺酶的热稳定性有较大影响,将M92突变成A92能使其在85℃下的半衰期延长30 min。本研究对其他来源的L-天冬酰胺酶的改造具有相应的参考价值。
