郫县豆瓣生香酵母的筛选及生长特性
2020-11-11范智义张其圣李洁芝邓维琴陈相杰
范智义,李 恒*,2,张其圣,2,陈 功,2,李洁芝,邓维琴,陈相杰
(1.四川省食品发酵工业研究设计院 泡菜与调味品研究所,四川 成都611130;2.四川东坡中国泡菜产业技术研究院,四川 眉山620000)
关键字:郫县豆瓣;生香酵母;菌株筛选;酵母生长特性
郫县豆瓣是我国西南地区一种特色发酵蚕豆酱,以其味辣香醇、红棕油亮、瓣粒酥脆、黏稠绒实、酱香浓郁[1]的特点为人所知,在烹饪与食品工业中广泛应用。郫县豆瓣的制作可大致分为甜瓣子发酵、辣椒醅发酵和混合后熟3个部分[1]。在郫县豆瓣的甜瓣子发酵和混合后熟中,制曲时所产生的酶、微生物的代谢以及各类化学反应共同作用,水解原料中大分子物质的同时生成各类呈色、呈味和呈香物质,对郫县豆瓣产品质量有着重要的影响。因此,改进豆瓣酱发酵工艺、提高发酵质量对高品质郫县豆瓣的生产具有重要意义。
酵母是传统发酵调味品酿造中常见的一类生香微生物,酵母代谢过程中可产生醇[2]、酯[3]、酚[4]以及呋喃化合物[5]等多种挥发性风味成分,有助于发酵调味品风味的形成。在传统发酵调味品生产领域,技术人员利用生香酵母强化发酵,可起到缩短发酵周期、提高质量稳定性、改善产品风味的效果。在现代酱油生产中,生香酵母的添加已成为标准酿制工艺的一部分[6]。
郫县豆瓣作为一种富有特色的传统调味品,其发酵过程中风味的形成也离不开酵母菌的代谢生香。目前,人们在郫县豆瓣中发现了多种酵母[7],对这些酵母的研究和应用逐渐受到了的关注。杨倩等[8]从郫县豆瓣中筛选出了一株可耐受26%氯化钠的鲁氏接合酵母,其能产生苯乙醇等多种发酵酱特征性风味物质;刘超兰等[9]在郫县豆瓣后熟阶段向物料中接种了乳酸菌(3×106CFU/g)和酵母菌(1×106CFU/g),明显增加了产品中的挥发性酯类和多种氨基酸的含量,缩短了陈酿时间;杨松彰等[10]将多种乳酸菌和耐盐酵母复配后用于郫县豆瓣强化发酵,发现郫县豆瓣挥发性风味物质含量明显提高。尽管如此,对郫县豆瓣中产香酵母的筛选仍缺乏整体系统的研究,郫县豆瓣的生产大多仍依赖于粗放的自然接种。作者从传统郫县豆瓣中筛选出一株具有生香能力的酵母菌株,并研究了该酵母菌株在不同食盐质量分数、pH和温度下的生长特性,以期为郫县豆瓣酵母菌菌种资源的挖掘与利用提供借鉴。
1 材料与方法
1.1 材料与试剂
郫县豆瓣分别于2017年和2018年的7~9月采集自成都市郫都区某企业,该企业郫县豆瓣采用传统工艺,依赖自然接种进行发酵和后熟。样品在水泥条池后熟发酵约1个月后收集,装于无菌采样袋,-4℃储存备用。
4-甲基-2-戊醇(色谱纯):Sigma公司产品;甲醇(色谱纯):重庆川东化工公司产品;其余分析纯试剂:购于成都科隆化学制公司。2.5 L AnaeroGen培养袋、密封培养罐:Thermo Scientific公司产品;Ezup柱式酵母基因组DNA抽提试剂盒:上海生工公司产品;YM培养基、PDA培养基、麦芽浸粉、琼脂粉:青岛海博公司产品;酵母蛋白胨、酵母浸粉:安琪酵母公司产品。
1.2 仪器与设备
分光光度计:上海仪电公司产品;Eclipse E100光学显微镜:尼康仪器公司产品;GCMS-TQ8040气质联用仪:岛津公司产品;Agilent J&W DB-WAX高分离度气相色谱柱(30 m×0.320 mm×0.25μm):安捷伦公司产品;固相微萃取手柄(带有50/30μm DVB/CAR/PDMS固相微萃取纤维):Supelco公司产品。
1.3 郫县豆瓣中酵母菌的分离与鉴定
称取样品25 g,无菌水10倍稀释,采用以下方法分离样品中的酵母菌:方法一,取1 mL样品稀释液于培养皿,倾注含质量分数16%氯化钠的YM琼脂培养基,混匀后凝固,30℃厌氧培养;方法二,取1 mL样品稀释液于培养皿,倾注PDA固体培养基,混匀后凝固,30℃好氧培养。
挑取培养皿上单菌落,相应液体培养基扩培后提取菌体基因组DNA,送至成都擎科生物科技公司扩增18S rDNA后测序。测序结果与公开数据库进行BLAST同源性比对,确定酵母种属。
1.4 酵母产醇能力分析
酵母菌产醇能力测定参考Zoecklein等[11]的方法,并做简化。各酵母菌株以1×106个/mL接种于含质量分数16%氯化钠的YM培养基中,30℃密封静置培养6 d。取适当稀释培养液1 mL与2 mL质量浓度为2 g/dL的重铬酸钾溶液、1 mL浓硫酸混匀,60℃密封反应30 min,610 nm测定吸光度。代入乙醇梯度稀释液,制备标准曲线,计算培养液醇的相对含量,以相当于乙醇的体积分数(%)表示。
1.5 酵母产香能力分析
依照1.4节所述制备酵母培养液,摇匀取2 mL于15 mL固相微萃取瓶,滴加2μL 0.5μg/mL的4-甲基-2-戊醇溶液作为内标物,混匀后60℃预热2 min,固相微萃取纤维60℃恒温吸附50 min。
萃取完毕后,将固相微萃取纤维插入气质联用仪进样孔,气相色谱分析以氦气为载气,柱流量0.93 mL/min,不分流,进样口温度250℃。柱箱初始温度50℃,程序开始后10℃/min升温至85℃,保持1.5 min;5℃/min升温至100℃,保持1 min;2.5℃/min升温至175℃,保持1.5 min;10℃/min升温至250℃,保持2 min。质谱离子源温度230℃,质荷比(m/z)扫描范围为35.0~350.0,电子轰击能量70 eV,检测器电压0.1 kV。挥发性成分的鉴定利用NIST05谱库检索结果与人工图谱解析共同确定。质量分数采用内标法进行定量分析。
1.6 培养基氯化钠质量分数、pH和培养温度对酵母生长的影响
分别配制氯化钠质量分数为0%、5%、10%、15%、20%、25%、30%的YM培养液,pH值为2、3、4、6、8、9、10的YM培养液(含质量分数5%氯化钠),接入1×104个/mL酵母菌,30℃静置培养。对培养温度的研究中,将接入1×104个/mL酵母菌的YM培养液(含质量分数为5%的氯化钠)置于4、10、20、30、37、40℃的条件下培养。
培养开始后,每隔一定时间取2 mL摇匀的培养液,620 nm测定吸光度。酵母生长进入稳定期后,摇匀培养液,使用血球计数板对酵母细胞进行计数。
1.7 数据分析
以上所有指标均进行3次独立试验,取平均值。采用Tukey法对组间数据差异的显著性进行检验(P<0.05),使用Origin 2018作图。
2 结果与分析
2.1 郫县豆瓣酱中酵母的分离与鉴定
经高盐兼性厌氧和无盐好氧2种分离方法,从郫县豆瓣中共获得28株酵母,10株(编号BP01~10)通过方法一获得,18株(编号BP11~28)通过方法二获得(表1)。所有酵母菌株中,17株为鲁氏接合酵母(Zygosaccharomyces rouxii),占所获菌株的大部分,3株酵母菌属于接合酵母属(Zygosaccharomyces),但未鉴定到种,其余8株分属奥默柯达酵母(Kodamaea ohmeri)、酿酒酵母(Saccharomyces cerevisiae)、 库 德 里 阿 兹 威 氏 毕 赤 酵 母(Pichia kudriavzevii)和 伯 顿 丝 孢 毕 赤 酵 母(Hyphopichia burtonii)。鲁氏接合酵母菌株多采用高盐兼性厌氧培养分离得到,其余种类的酵母则是通过无盐好氧方法分离得到的。

表1 郫县豆瓣中分离获得的酵母菌菌株编号、形态特征和种属Table 1 Identification numbers,morphological characters and species of strains isolated from Pixian bean paste

续表1
鲁氏接合酵母是郫县豆瓣、黄豆酱及其他种类蚕豆酱发酵、后熟中最主要的酵母菌之一[7,12-13]。高盐厌氧环境模拟了郫县豆瓣发酵时酱醅内部的状态,利用该方法分离得到的鲁氏接合酵母菌株在郫县豆瓣酱醅中可能也有较强活性,并在风味形成中发挥着作用。酿酒酵母是面包制作和酿酒中常见的酵母[14],而库德里阿兹威氏毕赤酵母、奥默柯达酵母和伯顿丝孢毕赤酵母在食品中较少被报道。利用无盐好氧方法分离得到酵母菌种类相对丰富,但高盐兼性厌氧分离方法却并未获得这些菌株,说明其在高渗、低氧的条件下生长受到了明显的抑制,可能不是发酵过程中主要的酵母菌。
2.2 酵母产醇能力分析
30℃培养5 d后,接种各酵母菌株的培养液中的醇相对含量如图1所示。鲁氏接合酵母及接合酵母属菌株培养液中的醇相对含量均在0.9%以上,而其他种属酵母的产醇能力较弱,培养液醇相对含量均低于0.6%,这有可能是由于其耐盐性差,在高盐培养液中生长受抑导致的。所有试验组中,接种菌株BP02、BP20、BP05、BP04、BP08、BP03、BP10和BP01的培养液醇相对含量均在1.06%以上,产醇能力较强,后续实验选取这些菌株做进一步研究。

图1 各酵母菌株培养液中的醇相对含量(以乙醇的体积分数计)Fig.1 Alcohol contents in culture broths of different yeast strains(expressed as ethanol volume fraction)
2.3 酵母菌产香能力分析
各酵母菌株于30℃培养5 d后,与空白组培养液相比,接种酵母菌株的培养液中挥发性风味物质质量分数显著增加(见图2),其主要挥发性物质包括醇、酯、酸、酮、酚、醛六大类。其中,醇类物质质量分数最高,各菌株培养液中的醇类物质质量分数均在17 ng/g以上,占挥发性物质的绝大部分,醇类物质以苯乙醇、乙醇和3-甲基丁醇为主(数据未展示);酯类物质为第二大挥发性风味物质,其在各组中质量分数在0.23~2.99 ng/g之间,以菌株BP02和BP20培养液中质量分数最高,均在2.8 ng/g以上;酸、酮、酚、醛在各菌株培养液中的质量分数极少,均不超过0.7 ng/g。所有酵母菌株培养液中,BP02的醇、酯质量分数最高,产香能力较优。

图2 培养5 d后各酵母菌株培养液中挥发性风味物质Fig.2 Contents of volatile compounds in culture broths of different yeast strains after 5 d incubation
根据各酵母菌株的产醇、产香能力,选取鲁氏接合酵母菌株BP02进行后续研究。BP02菌落呈现白色圆形,菌落表面干燥,易于挑起(见图3(a))。挑取菌落镜检,可观察到球形或椭球形细胞,并存在明显的出芽现象(见图3(b))。

图3 鲁氏接合酵母BP02的菌落和细胞形态Fig.3 Colonial and cellular morphology of Zygosaccharomyces rouxii BP02
2.4 氯化钠质量分数对鲁氏接合酵母BP02生长的影响
图4为鲁氏接合酵母BP02在不同氯化钠质量分数的YM培养基中的生长曲线及稳定期细胞计数。随着培养基氯化钠质量分数的增加,BP02菌株延滞期时间先减后增,对数期生长速率及稳定期培养液吸光度则呈现先增后减的特点。培养基氯化钠质量分数为5%时,BP02菌株的延滞期最短,对数期生长速率最大,稳定期培养液吸光度最高,生长最旺盛。氯化钠质量分数高于25%时,BP02菌株培养期间吸光度始终在0.1以下。氯化钠质量分数在0%~25%范围内,BP02菌株稳定期细胞密度均在1×107个/mL以上,其中氯化钠质量分数为5%的试验组稳定期细胞密度最大,达2.78×108个/mL,但在氯化钠质量分数为0%~25%的范围内各组稳定期细胞密度差异不显著。总体来看,BP02菌株具有较强的耐盐性,可耐受最高含有质量分数20%氯化钠的培养环境。
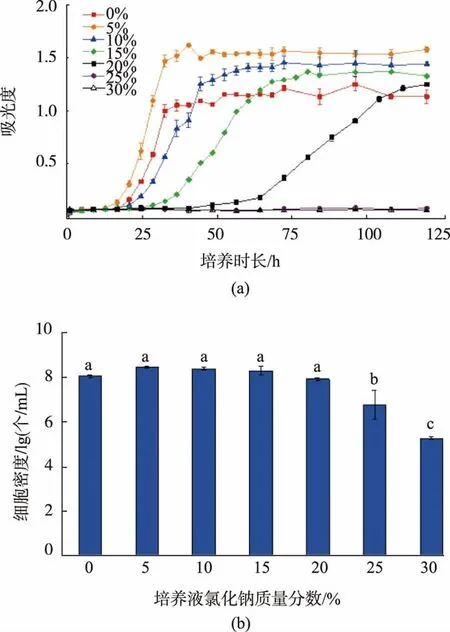
图4 鲁氏接合酵母BP02在含不同氯化钠培养条件下的生长曲线及稳定期细胞计数Fig.4 Growth curves and cell counts of Zygosaccharomyces rouxii BP02 cultured in sodium chloridewith different concentrations
鲁氏接合酵母是一种典型的耐盐酵母菌,Jansen等[15]的研究表明鲁氏接合酵母可在培养基氯化钠质量分数为0%~18%范围内均可旺盛生长。本研究中,培养液氯化钠质量分数在0%~20%时,鲁氏接合酵母BP02的生长速率虽有所不同,但稳定期细胞密度基本一致,培养液氯化钠质量分数为25%和30%时,虽然在培养过程中培养液吸光度未发生明显改变,但细胞计数结果显示,与初始接种密度1×104个/mL相比,25%和30%氯化钠组的细胞密度明显增加,说明在极高质量分数氯化钠的培养环境中,鲁氏接合酵母BP02仍可缓慢生长。根据本实验室之前的研究,郫县豆瓣甜瓣子发酵阶段的氯化钠质量分数一般在14%,后熟阶段豆瓣酱的氯化钠质量分数则在18%左右,因此,鲁氏接合酵母BP02可较好适应郫县豆瓣发酵过程中的高盐环境。
2.5 pH对鲁氏接合酵母BP02生长的影响
图5为鲁氏接合酵母BP02在不同pH YM培养基中的生长曲线及稳定期细胞计数。可以看出,菌株BP02可在pH值为3~8的范围内生长,在此范围内,菌株BP02的延滞期呈现先减后增的趋势;在pH值为4和6时,相对于其他试验组,BP02菌株的延滞期最短,生长最迅速,稳定期细胞密度均在1×108个/mL以上,二者生长曲线几乎完全重合,表现出相似的生长特性;pH值为3时,BP02菌株的延滞期增加,稳定期培养液吸光度和细胞密度也显著下降,而培养基pH值为8时,BP02菌株的延滞期明显延长,但稳定期培养液吸光度和细胞密度较pH值为4和6的试验组没有明显差异。

图5 不同pH下鲁氏接合酵母BP02的生长曲线及稳定期细胞计数Fig.5 Growth curves and cell count of Zygosaccharomyces rouxii BP02 cultured in different pH
鲁氏接合酵母可适应广泛的pH培养环境,据Restaino等[16]报道,鲁氏接合酵母在含有质量分数12%葡萄糖的培养基中可在pH值为1.5~10.5的环境下生长,其最适生长pH值为3.5~5.5;ONishi等[16]的研究则表明,无盐条件下鲁氏接合酵母可在pH值为3~7的条件下生长,而在含有质量分数18%氯化钠的培养环境中其生长pH值为4~5。pH对鲁氏接合酵母生长的影响可能与培养环境中的营养成分密切相关,但可以明确的是,在pH值为4~6的弱酸性环境中生长情况最好,这与Yong等[17]的研究结果相一致。郫县豆瓣甜瓣子发酵过程中,酱醅的pH值由初始的6.0~6.5下降到发酵后期的4.0~4.5,并在后熟中维持稳定,整个发酵、后熟过程的pH环境均有利于鲁氏接合酵母BP02的生长。
2.6 培养温度对鲁氏接合酵母BP02生长的影响
图6为鲁氏接合酵母BP02菌株在不同培养温度下的生长曲线及稳定期细胞计数。可以看出,随着培养温度的上升,BP02菌株的延滞期逐渐缩短,但在10~30℃,各试验组稳定期培养液吸光度和细胞密度无显著差异,培养温度为37℃时,鲁氏接合酵母BP02对数期生长速率最快,但稳定期培养液吸光度和细胞计数较10~30℃各组显著降低;培养温度为30℃时,BP02菌株的生长最为旺盛,但培养温度为4℃时,在整个培养过程中BP02菌株几乎不生长。
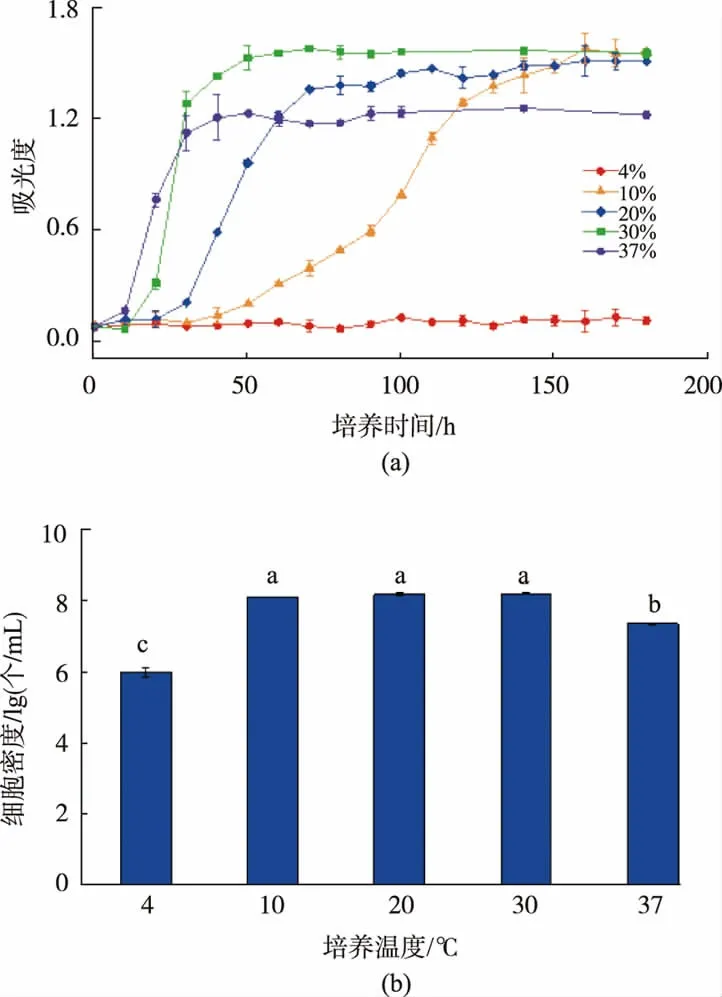

图6 不同温度下鲁氏接合酵母BP02的生长曲线及稳定期细胞计数Fig.6 Growth curves and cell counts of Zygosaccharomyces rouxii BP02 cultured in different temperatures
VAN uden等研究了温度对酵母生长的影响后认为,当温度高于一定值后,酵母菌的热死亡会成为影响比增长速率的因素之一,同时存活的细胞对葡萄糖的消耗也会增加,导致稳定期酵母得率的减少。由此可以推测,随着培养温度的升高,鲁氏接合酵母BP02的比增长速率提高,但当温度达到37℃时,由于比死亡速率的增加小于比增长速率的增加,相对于30℃酵母菌的对数期生长速率仍有所提高,但酵母对葡萄糖消耗的增加,用于增殖的营养相对减少,37℃环境下BP02稳定期细胞计数及吸光度较30℃培养条件均有所降低,与本研究一致。Yong等[17]报道称37℃鲁氏接合酵母的生长速率较室温(28℃)快,但稳定期细胞数量则低于室温培养的鲁氏接合酵母。实际生产中,短时间发酵(3个月内)的甜瓣子在发酵时会控制温度在30~35℃,而长时间(1年以上)发酵的甜瓣子及后熟过程一般在常温下进行。从鲁氏接合酵母BP02的生长特性来看,在强化发酵时及后熟时将温度控制在合理的范围,可促进其快速增殖,有利于产品风味的形成。
3 结语
本研究中通过无盐好氧和高盐兼性厌氧2种方法,从传统郫县豆瓣中分离得到了28株酵母菌,主要为鲁氏接合酵母(Zygosaccharomyces rouxii),也分离得到了奥默柯达酵母(Kodamaea ohmeri)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、酿酒酵母(Saccharomyces cerevisiae)和伯顿丝孢毕赤酵母(Hyphopichia burtonii)等。通过产醇试验可知,鲁氏接合酵母在高盐培养条件下产醇能力较强,而其他酵母的耐盐性较差,产醇能力弱。经过产醇与产香试验,从分离获得的酵母菌株中筛选出了风味生成能力较强的鲁氏接合酵母BP02。经研究,该菌株最高可耐受质量分数20%的氯化钠,在pH值为3~8、10~37℃均可生长。其在氯化钠质量分数为5%、pH值为4~6、30℃的培养环境中生长最旺盛。总体来看,鲁氏接合酵母是郫县豆瓣中最主要的酵母菌,并具有一定的生香能力。本研究中筛选出的产香鲁氏接合酵母BP02在高盐、弱酸和中温的培养条件下生长良好,该生长条件与郫县豆瓣发酵体系相一致,说明菌株BP02高度适应郫县豆瓣酱醅环境,可作为强化菌种用于提高郫县豆瓣的风味品质。
