酿酒糟醅中生香酵母的筛选及培养条件
2020-11-11赵志军王瑞卿刘延波王洪彬孙西玉潘春梅
赵志军,王瑞卿,刘延波,刘 宁,王洪彬,孙西玉,4,潘春梅*
(1.河南牧业经济学院 食品与生物工程学院(酒业学院),河南 郑州450046;2.河南牧业经济学院 河南省白酒风格工程技术研究中心,河南 郑州450046;3.赊店老酒股份有限公司,河南 社旗473300;4.河南张弓老酒酒业有限公司,河南 宁陵476733)
我国浓香型白酒采用泥窖续糟,固态发酵工艺,历来有“千年老窖,万年糟”的说法。糟醅的质量对浓香型白酒的酿造起着非常重要的作用[1]。糟醅是已发酵完毕等待蒸馏的物料[2],是酿酒微生物代谢发酵的主要场所。微生物在其中进行糖化、酒化、酸化和酯化等一系列生化反应过程[3],所以糟醅中的微生物品质影响着出酒率的高低和酒质的优劣[1]。
酵母作为糟醅发酵的主要功能菌之一,依据其功能可分为酿酒酵母和生香酵母[4-5]。酿酒酵母具有较强的产酒精能力,代谢产物主要是酒精。生香酵母对酸、醇有较强的酯化能力,产生的香气物质以酯类为主,还有醇类、酸类、醛类、酮类、胺类、芳香族类等[6-7]。这些香味物质是产生酒体芳香及促进酒体丰满的关键化合物[8]。现已报道的生香酵母包括异常汉逊酵母[9]、假丝酵母[10]、毕赤酵母[11]、异常威克汉姆酵母[12]等。作者旨在从赊店老酒的糟醅中分离得到优良的产酯酵母菌菌株,并采用响应面法对其培养条件进行优化,以期将其培养液投入窖池,为提高浓香型白酒基酒的质量奠定一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料来源酿酒糟醅:赊店老酒股份有限公司提供。
1.1.2 实验试剂蛋白胨、酵母浸粉、琼脂粉等常规试剂:均购自北京奥博星生物技术有限责任公司;青霉素:购自华北制药集团动物保健品有限责任公司。
1.1.3 筛选培养基PDA固体培养基:马铃薯浸粉3 g/L,葡萄糖20 g/L,琼脂粉15 g/L。
1.1.4 活化培养基YEPD液体培养基:酵母粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L。
1.1.5 发酵产酯培养基豆芽汁培养基:黄豆芽10 g,葡萄糖5 g,水100 mL。将新鲜黄豆芽洗干净,小火煮沸0.5 h,用纱布过滤,补足水分。
1.2 仪器与设备
SW-CJ-2F超净工作台:苏州净化设备有限公司产品;LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂制造;GH-500隔水式培养箱:北京科伟永兴仪器有限公司产品;ZQLY-300S摇床:上海知楚仪器有限公司产品;恒温水浴锅:常州方科仪器有限公司产品。
1.3 方法
1.3.1 生香酵母的初筛称取10 g混匀的糟醅于90 mL YEPD液体培养基中,摇床28℃、120 r/min,培养24 h。用移液枪吸取菌悬液1 mL至9 mL无菌水中,并依次梯度稀释至1×10-6倍,取稀释度1×10-4、1×10-5、1×10-6的菌悬液各0.1 mL均匀涂布于添加80 mg/L青霉素的PDA固体培养基表面,置于28℃恒温培养48 h,挑取长势良好的单菌落划线转接到PDA培养基上,28℃条件下培养72 h,长出的单菌落再次划线至完全纯化,斜面保存备用。
1.3.2 生香酵母的复筛对初筛保存的菌株进行活化复筛。每支保存的斜面试管菌种,挑取一环接种至YEPD液体培养基中,28℃培养24 h,制成种子液。将制备好的种子液以体积分数2%接种量接种于装有100 mL发酵产酯培养基的250 mL三角瓶中,恒温摇床28℃、120 r/min条件下培养5 d,测定总酯产量(质量浓度)。
1.3.3 总酯的测定总酯测定方法采用皂化中和滴定法[13]。
1.3.4 菌株鉴定
1)菌株形态学鉴定及生理生化试验 菌落形态观察:将被检菌用稀释平板法在PDA培养基上28℃培养48 h,观察菌落的颜色、大小、表面形态、边缘形态、质地等并做记录。
细胞形态鉴定:将平板上的菌落用接种针挑取一环制片,在显微镜下观察。
初步生理生化试验按照《酵母菌的特征与鉴定手册》[14]进行,主要包括糖发酵实验、硝酸盐利用实验、类淀粉物质生成实验、脲酶实验等。
2)菌株26S rDNA鉴定 使用酵母DNA基因组快速提取试剂盒提取酵母基因组DNA,酵母扩增引物为通用引物对NL1和NL4。反应体系为50μL(San Taq PCR Mix预混液25μL,引物各2μL,DNA模板2μL,ddH2O 19μL)。PCR扩增条件:94℃,5 min;94℃,40 s,53℃,45 s,72℃,45 s,35个 循环;最后72℃延伸10 min。取3μL PCR产物经1 g/dL琼脂糖凝胶电泳检测产量和特异性,将PCR产物送交上海生物生工有限公司进行测序,将测序所得特定序列,在NCBI上通过BLAST程序进行同源性比较与分析,用MEGA6.0软件构建系统发育树。
1.3.5 筛选酵母培养条件的研究
1)初始pH对筛选酵母产酯量(质量浓度)的影响 为了确定筛选酵母适宜培养的初始pH,用0.1 mol/L的盐酸调节豆芽汁培养基的pH值,分别至3、4、5、6、7,接种所筛选得到的酵母,在28℃、120 r/min条件下,培养5 d,进行小型发酵试验,测定发酵液中总酯质量浓度。
2)初始糖质量浓度对筛选酵母产酯量的影响调节豆芽汁培养基的初始糖质量浓度分别为2、4、6、8、10 g/dL。恒温摇床28℃、120 r/min条件下培养5 d,发酵结束后测发酵液总酯质量浓度。
3)发酵时间对筛选酵母产酯量的影响 用豆芽汁培养基培养筛选出的酵母菌株,在28℃、120 r/min条件下培养。选取发酵开始后的第2、3、4、5、6、7天分别取样测的发酵液总酯质量浓度。
1.3.6 响应面实验在单因素实验的基础上,选取相关性大的3个因素为自变量,以总酯的产量(质量浓度)为指标进行17组5个中心点的Box-Behnken响应面分析[15-17],每个因素均设3个平行。
1.3.7 数据处理运用Excel 2013和Design-Expert 8.0.6软件对实验结果进行分析处理。
2 结果与分析
2.1 生香酵母的筛选结果
通过在PDA琼脂平板上多次分离纯化后,共分离出22株疑似酵母菌的菌株(菌落编号S1—S22),将纯化的22株菌株进行筛选,其产酯结果见表1。由表1得到,在相同的培养条件下,酵母菌株S5发酵液总酯质量浓度为4.67 g/L,产酯能力强,是比较理想的产酯酵母。因此,选用S5菌株进行后续试验研究。
2.2 生香酵母鉴定结果
2.2.1 菌株形态和生理生化试验结果对菌株S5进行菌落形态观察,并划线于PDA培养基上培养,观察菌落形态特征,结果见图1。菌株S5在PDA琼脂培养基上菌落呈乳白色,边缘整齐,表面光滑,中央凸起,有水果香气。通过生理生化试验,该菌株能发酵葡萄糖,能利用硝酸盐,不能生成类淀粉物质,能水解尿素。
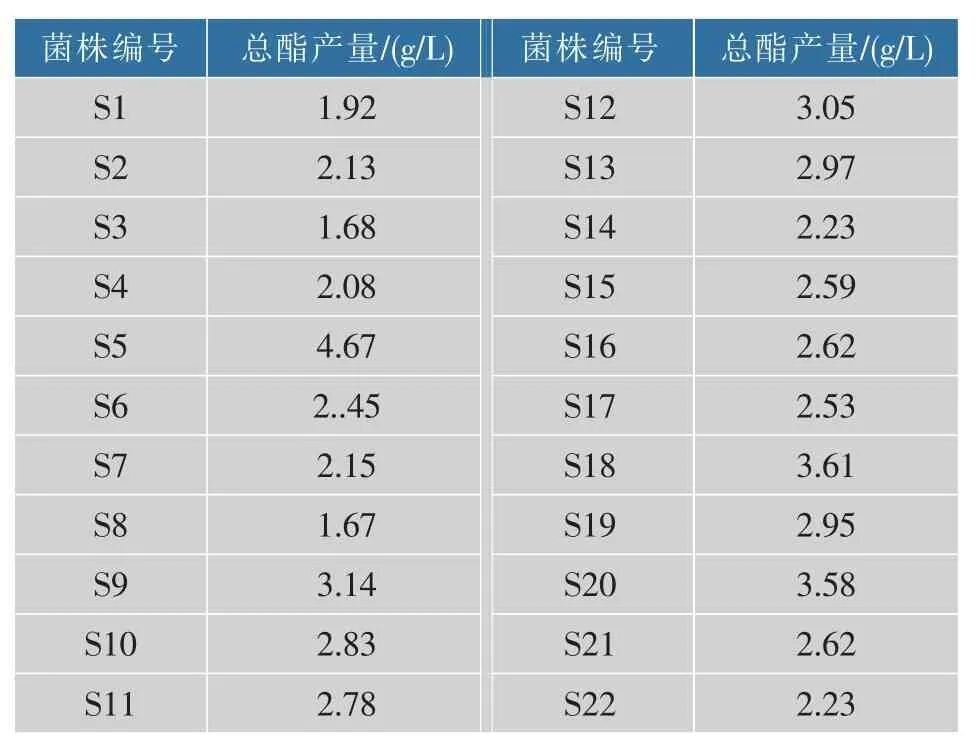
表1 不同菌株发酵液中总酯产量Table 1 Total ester contents in fermentation broth of different strains
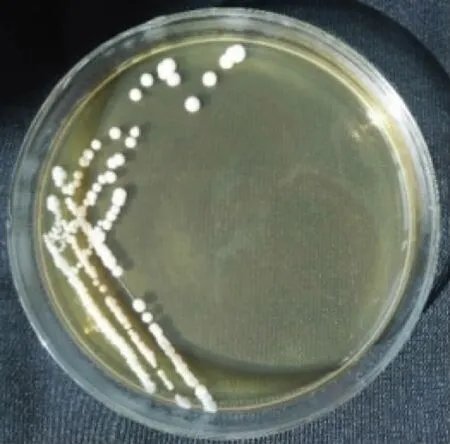
图1 菌株S5的菌落形态Fig.1 The colony morphology of strain S5
2.2.2 菌株的分子鉴定对菌株S5的26S rDNA的PCR扩增产物进行序列测序。将测序结果与NCBI数据库进行Blast比对分析,对比结果显示S5菌株与现已有的异常威克汉姆酵母的同源性达100%,利用MEGA6.0软件构建系统发育树,如图2所示。结合S5的形态,生理生化试验结果以及S5的系统发育树,可以确定S5为异常威克汉姆酵母(Wickerhamomyces anomalus)。
2.3 初始pH对筛选酵母产酯量影响的结果
根据1.3.5中设定的发酵培养基初始pH值进行小型发酵试验,结果见图3。随着初始pH的升高,发酵液中总酯质量浓度显著提高,pH为5时达到最大,然后随pH升高发酵液中总酯的质量浓度有所下降。说明该菌株在pH为5~6的培养基中有较好的产酯能力,尤其是在pH为5的时候达到最高,总酯质量浓度为4.15 g/L。

图2 系统发育树Fig.2 Phylogenetic tree
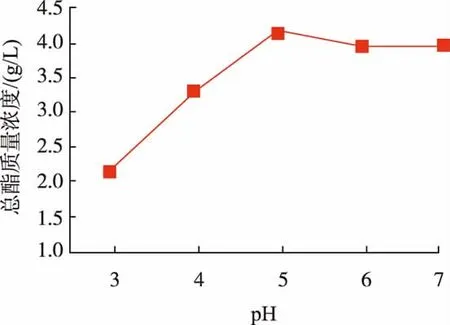
图3 发酵培养基初始pH对产酯量的影响Fig.3 Effect of initial pH of fermentation medium on the production of ester
2.4 初始糖质量浓度对筛选酵母产酯量影响的结果
根据1.3.5中设定的发酵液初始糖质量浓度,进行小型发酵试验,结果见图4。随着发酵液初始糖质量浓度的增加,发酵液总酯质量浓度是先上升后下降。葡萄糖添加量为6 g/dL时总酯质量浓度达4.13 g/L,表明菌株发酵产酯的最佳初始糖质量浓度为葡萄糖添加量为6 g/dL。当培养基的初始糖质量浓度过高,培养基渗透压会增大,影响生香酵母的产酯能力。
2.5 发酵时间对筛选酵母产酯量影响的结果
发酵时间对产酯量的影响见图5。由图5可知,发酵3 d时总酯质量浓度最高,达到4.55 g/L。但随着发酵时间的增长,发酵液的总酯质量浓度下降与廖永红等[18]在对3种产酯酵母总酯的生成特性研究时发现的结论一致,其可能原因是随发酵时间的延长,发酵液中难挥发性酯类也逐渐转变为易挥发性酯类或其他物质所致,因此S5生成总酯的适宜发酵时间为3 d。
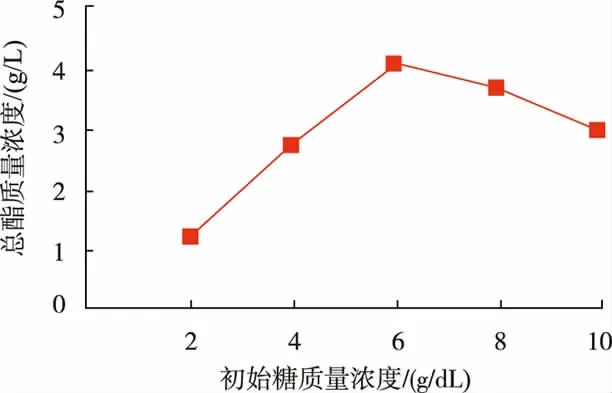
图4 初始糖度对产酯量的影响Fig.4 Effect of initial sugar content on ester yield
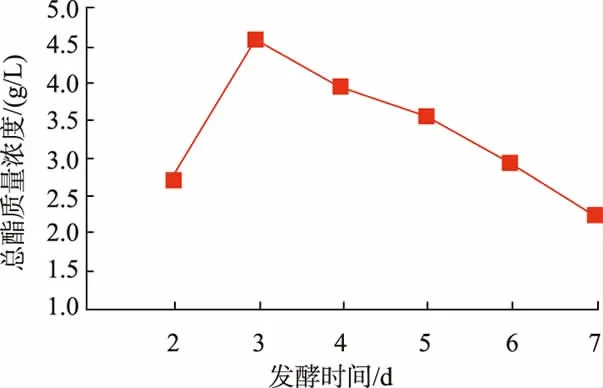
图5 不同发酵时间对总酯生成量的影响Fig.5 Effect of different fermentation time on total ester production
2.6 响应面的结果与分析
2.6.1 回归模型建立及方差分析在单因素的基
础上,选取培养基初始pH(A),发酵时间(B),培养基初始糖质量浓度(C)3个对产酯影响显著的因素为自变量,以总酯质量浓度为响应值,进行响应面试验。试验设计及试验结果见表2。
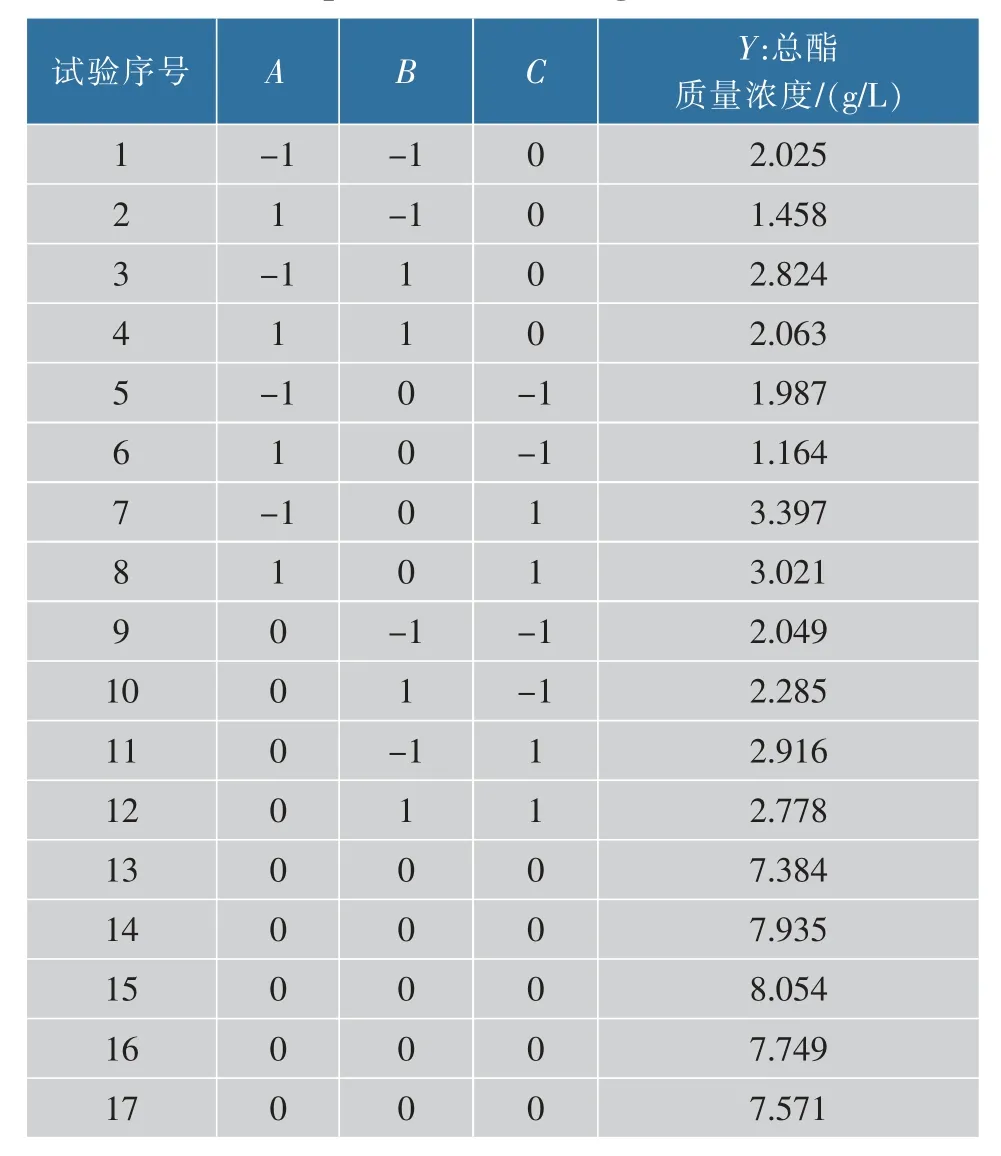
表2 响应面设计及其结果Table 2 Response surface design and the results
通过响应面分析软件(Design-Expert8.0.6)对表2中的数据进行分析,得到数学模型,并对数学模型进行方差分析,得到模型和回归系数的显著性,结果见表3。
对因素进行二次回归拟合分析,建立显著因素的拟合方程:
Y=7.74-0.32A+0.19B+0.58C-0.049AB+0.11AC-0.094BC-2.88A2-2.77B2-2.47C2
由表3可知,响应面模型极其显著,其模型的回归系数为99.11%,R2adj为97.97%。说明该模型模拟度较好可以用此模型来预测该菌株的产酯能力。失拟项不显著(P>0.01),说明本试验所得二次回归方程能够很好地对响应值进行预测。在此模型中A2、B2、C2的P值均小于0.01,说明该菌株发酵过程中发酵液的初始pH、培养时间和发酵液的初始糖质量浓度对产酯的影响是非常显著的。
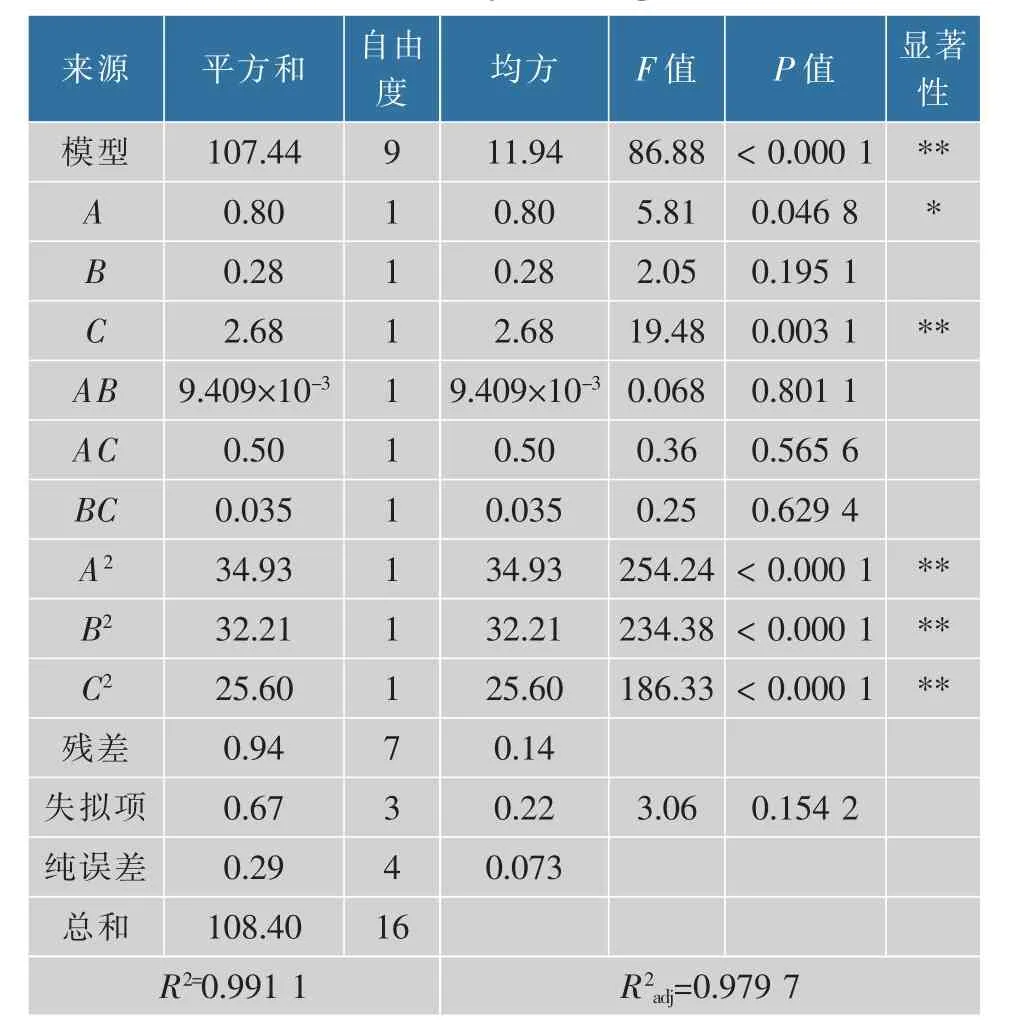
表3 回归模型方差分析Table 3 Variance analysis of regression model
2.6.2 响应曲面分析当各因素大小从四周逐渐趋向中心点时,曲面图呈凸起趋势,说明相关因素交互作用越强,即菌株发酵产酯能力趋向最大化,说明存在最大响应值[19]。由图6(a)可以发现,当初始糖质量浓度一定时,pH和发酵时间的值由小变大时,曲线出现先上升后下降的趋势。图6(b)、(c)也出现当某一因素一定时,其余2种因素的图像也呈先上升后下降的趋势,说明该模型因素之间的相互作用较强,存在最大响应值。运用软件Design-Expert 8.0.6对结果进行分析,得到在pH为4.95,发酵时间为3.03 d,初始糖质量浓度为6.23 g/dL时发酵液中总酯质量浓度达到最大,为7.78 g/L。考虑到实际情况,调整发酵时间为3 d,初始糖质量浓度为6 g/dL进行验证试验。结果显示,3次重复试验中总酯质量浓度均值为7.67 g/L,与理论值的误差较小,说明优化出的产酯条件可靠,具有实用价值。
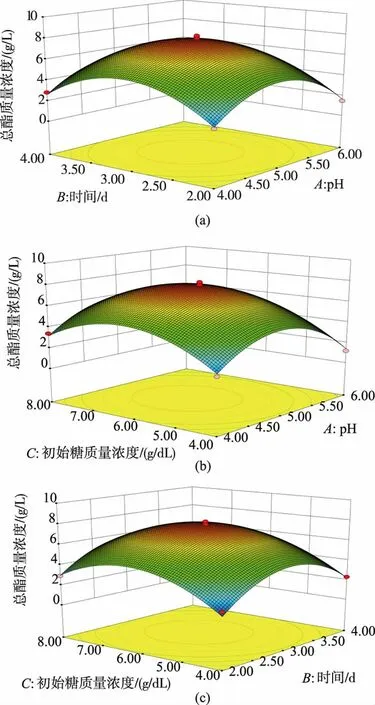

图6 响应面三维立体图Fig.6 Response surface(3D)diagram
3 结语
作者通过从糟醅中分离筛选得到一株产酯能力较好的菌株S5,在28℃、120 r/min的条件下培养5 d,产酯培养基中总酯质量浓度达4.67 g/L。经过形态学观察,生理生化及分子生物学鉴定,确定菌株为异常威克汉姆酵母(Wickerhamomyces anomalus)。在单因素实验的基础上,通过响应面法对菌株S5的培养条件进行优化,得到该菌株最适发酵产酯条件为pH 4.95,发酵时间3 d,初始糖质量浓度6 g/dL。在此条件下,该菌株发酵液总酯质量浓度为7.67 g/L,与预测值7.78 g/L的相对误差仅为1.4%,产酯量比未优化之前提高了64.2%。此前王鹏昊[20]报道从工业化小曲中分离出1株异常威克汉姆酵母(Wickerhamomyces anomalus),该酵母总酯产量达4.065 g/L。综合比较,本实验筛选出的异常威克汉姆酵母在优化后其发酵液总酯质量浓度达7.67 g/L,说明该菌株产酯量较高,在白酒发酵时该菌株能提高酒中酯类物质的质量浓度,提升浓香型白酒的品质。
该研究得到的产酯能力较好的酵母菌菌株是从实际生产用酿酒糟醅中分离获得,能够适应生产环境。应用响应面法优化提高了该菌株的产酯能力,更有利于在生产环节中的应用。虽然该研究是在实验室条件下完成并获得的实验数据,与实际生产会有一定的差异,但考虑到该菌株本身来自生产所用糟醅,能够适应各种发酵因素对其的影响。若将其扩大培养投入酿酒糟醅中,对提高原酒中酯类含量以及成品酒酒质必然会有一定的帮助。该研究中所筛选出的酵母菌株为进一步在实践中的应用奠定了基础。
