壳聚糖对天冬酰胺的吸附性能研究
2019-12-26邓起东唐婷范田玉红周友全
邓起东,唐婷范,田玉红,周友全
(广西科技大学生物与化学工程学院,广西柳州545006)
在制糖过程中,各种含氮物的成分及含量可作为判断原料及糖品质量的一项重要指标。一般说来,氨基酸是生物体的必需成分和人体的重要营养素。可在现用的制糖方法中,蔗汁中的氨基酸却是多种不良影响的“有害氮”的主要成分。据克拉克[1]分析,甘蔗汁主要的氨基酸成分中天冬酰胺约占0.7%,含量最高。刘慧霞等[2]对广西的两种主要甘蔗品种中的氨基酸成分进行分析,发现天冬氨酸等11种主要氨基酸的含量在10 mg/L~100 mg/L。蔗汁中的蛋白质、氨基酸、酰胺及其它含氮物质在制糖过程中可产生美拉德反应,与还原糖或羟基作用生成拟黑色素,尤其是氨基酸存在时会大大加速还原糖分解产生大量此类色素,是制糖过程中物料色泽变深和pH值下降的主要原因,可使糖汁脱色困难最终产品色值增加,并会使糖膏体积膨胀和废蜜升温甚至焦化,对蔗糖的品质影响极大。如果能减少蔗汁中氨基酸的含量,可降低美拉德反应的机率,从而可以降低糖品色值[3]。目前,壳聚糖作为吸附剂在制糖行业方面得到很好的应用[4-5],但关于壳聚糖对氨基酸的吸附性能的研究较少[6-7]。本文采用壳聚糖对天冬酰胺的吸附性能进行试验研究,填补蔗汁澄清工艺基础研究的空白,对蔗汁澄清工艺的新技术开发具有理论指导意义和实际应用价值。
1 材料与方法
1.1 材料与仪器
壳聚糖(脱乙酰度86.6%):上海市卡博工贸有限公司;L-天冬酰胺(纯度不低于99.0%,USP Grade):生工生物工程(上海)股份有限公司;茚三酮(分析纯):国药集团化学试剂有限公司;氢氧化钠(分析纯):广东台山粤侨试剂塑料有限公司;磷酸二氢钾(分析纯):西陇化工股份有限公司;无水乙醇(分析纯):成都市科龙化工试剂厂。
722S型可见分光光度计:上海精密科学仪器有限公司;DF-101S型恒温加热磁力搅拌器、SHZ-D(Ⅲ)型循环水式真空泵:巩义市予华仪器有限责任公司;SHZ-82A型数显恒温振荡器:常州国华电器有限公司;TDL-80-2B型低速离心机:上海安亭科学仪器厂;FA2004N型电子分析天平:上海菁海仪器有限公司;JJ500型电子天平:常熟市双杰测试仪器厂;101-1A型数显电热鼓风干燥箱:上海精宏设备有限公司。
1.2 方法
1.2.1 天冬酰胺的分析检测方法
准确配制0.5 mg/mL天冬酰胺标准溶液,分别吸取 0、0.2、0.3、0.4、0.5、0.6 mL 于 6 个 10 mL 的容量瓶中,加入蒸馏水稀释至刻度。再分别精确量取1.0 mL于6只棕色试管中,加磷酸盐缓冲液1.0 mL,显色剂2.0 mL,加入蒸馏水定容至刻度,摇匀,置于沸水浴中显色25 min,冷却5 min。以相应溶剂作空白,用可见分光光度计在λ=580 nm处测定其吸光度。根据朗伯-比尔定律,分别以测定的吸光度为Y坐标,天冬酰胺的浓度为X坐标,绘制出天冬酰胺溶液标准曲线。试验数据经线性回归方程得:Y=34.9X-0.171 6(R2=0.998 5)[8]。
1.2.2 壳聚糖的处理制备
用电子天平称取(10.00±0.05)g壳聚糖于500 mL烧杯中,加入200 mL蒸馏水使其混合均匀后,让其在室温下浸泡24 h,然后将其进行抽滤,即得到试验所用壳聚糖[9]。
1.2.3 壳聚糖对天冬酰胺的吸附动力学研究
准确称取 (0.050 0±0.000 5)、(0.100 0±0.000 5)、(0.150 0±0.000 5)g的天冬酰胺固体,分别用蒸馏水溶解并定容至1000mL的容量瓶中得到50、100、150mg/L的天冬酰胺溶液。然后,各量取100 mL天冬酰胺溶液置于一系列250 mL的具塞锥形瓶中。在加入0.15 g壳聚糖后开始计时,于30℃、振荡频率为120 r/min下分别 振 荡 10、20、30、50、70、90、100、120、150、180、200、250 min。振荡结束,取出15 mL溶液离心10 min,取上清液稀释至适当浓度。按1.2.1项下方法测定天冬酰胺被吸附后溶液的吸光度值,并计算其吸附量[10-11]。
计算吸附量的公式为[12]:

式(1)中:qe为天冬酰胺的饱和吸附量,mg/g;C0为天冬酰胺溶液吸附前的质量浓度,mg/L;C为天冬酰胺溶液吸附后的质量浓度,mg/L;V为天冬酰胺溶液的体积,L;m 为壳聚糖的质量,g。
1.2.4 壳聚糖对天冬酰胺的吸附等温线研究
分别配制 100、150、200、250、300、400、500、600、800、1 000、1 200、1 500 mg/L 浓度的天冬酰胺溶液,然后各量取100 mL天冬酰胺溶液置于一系列250 mL的具塞锥形瓶中。在加入0.15 g壳聚糖后开始计时,于30℃、振荡频率为120 r/min下分别振荡120 min。振荡结束,取出15 mL溶液离心10 min,取上清液稀释至适当浓度。按1.2.1项下方法测定天冬酰胺被吸附后溶液的吸光度值,并计算其吸附量[10-11]。
1.2.5 吸附模型
1.2.5.1 动力学吸附模型
分别采用粒内扩散模型、准一级动力学模型和准二级动力学模型对壳聚糖对天冬酰胺的吸附动力学曲线数据进行拟合。
粒内扩散方程为[13-15]:

式(2)中:qt为t时刻壳聚糖对天冬酰胺的吸附量,mg/g;kp为粒内扩散速率常数,mg/(g·min0.5);t为吸附时间,min。
准一级动力学方程为[14-16]:
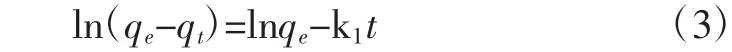
准二级动力学方程为[15-17]:

式(3)和式(4)中:qe为平衡时刻壳聚糖对天冬酰胺的吸附量,mg/g;qt为t时刻壳聚糖对天冬酰胺的吸附量,mg/g;k1为准一级动力学的吸附速率常数,min-1;k2为准二级动力学的吸附速率常数,g/(mg·min)。
1.2.5.2 等温吸附模型
为了研究天冬酰胺溶液的平衡质量浓度与吸附量之间的关系以及壳聚糖对天冬酰胺的最大吸附量,采用Langmuir等温吸附方程和Freundlich等温吸附方程来拟合吸附过程。
Langmuir模型也称之为单分子层吸附模型,只能适用于描述单分子层、均匀表面的吸附情况。Langmuir等温方程式为[18-19]:

式(5)中:Ce为平衡时刻溶液中天冬酰胺的浓度,mg/L;qe为平衡时刻壳聚糖对天冬酰胺的吸附量,mg/g;b 为饱和吸附量,mg/g;kL为 Langmuir常数,L/mg。
Freundlich模型是用于描述吸附质在能量分布不均一的吸附剂表面的吸附现象,不但能描述单分子层吸附,还能描述多分子层吸附。Freundlich等温方程式为[20-21]:

式(6)中:Ce为平衡时刻溶液中天冬酰胺的浓度,mg/L;qe为平衡时刻壳聚糖对天冬酰胺的吸附量,mg/g;kF,n 为 Freundlich 常数。
2 结果与分析
2.1 壳聚糖对天冬酰胺的吸附动力学研究
为了探讨吸附时间对壳聚糖吸附天冬酰胺的影响。按照试验方法1.2.3,在温度30℃,天冬酰胺的浓度分别为50、100、150 mg/L的条件下,对水溶液中壳聚糖对天冬酰胺吸附作用进行动力学研究。根据试验数据作图,得到其动力学曲线见图1。
由图1可知,在吸附初始阶段,壳聚糖在水溶液中对天冬酰胺的吸附量随时间的增加而增加,吸附速度较快;当时间达到120 min时,吸附达到平衡状态,吸附速度趋渐平缓,此后随着时间的增加,壳聚糖对天冬酰胺的吸附量基本不再变化。由此可知,壳聚糖在水溶液中对天冬酰胺的吸附平衡时间为120 min。
按照试验方法1.2.5.1,采用粒内扩散模型、准一级动力学模型和准二级动力学模型分别对水溶液中壳聚糖对天冬酰胺的吸附动力学曲线数据进行拟合,拟合结果见图2~图4和表1。
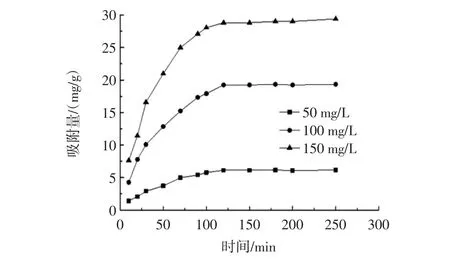
图1 壳聚糖对天冬酰胺的吸附动力学曲线Fig.1 Adsorption kinetic curves of asparagine by chitosan

图2 壳聚糖对天冬酰胺吸附动力学的粒内扩散方程拟合结果Fig.2 Intraparticle diffusion equation of asparagine by chitosan
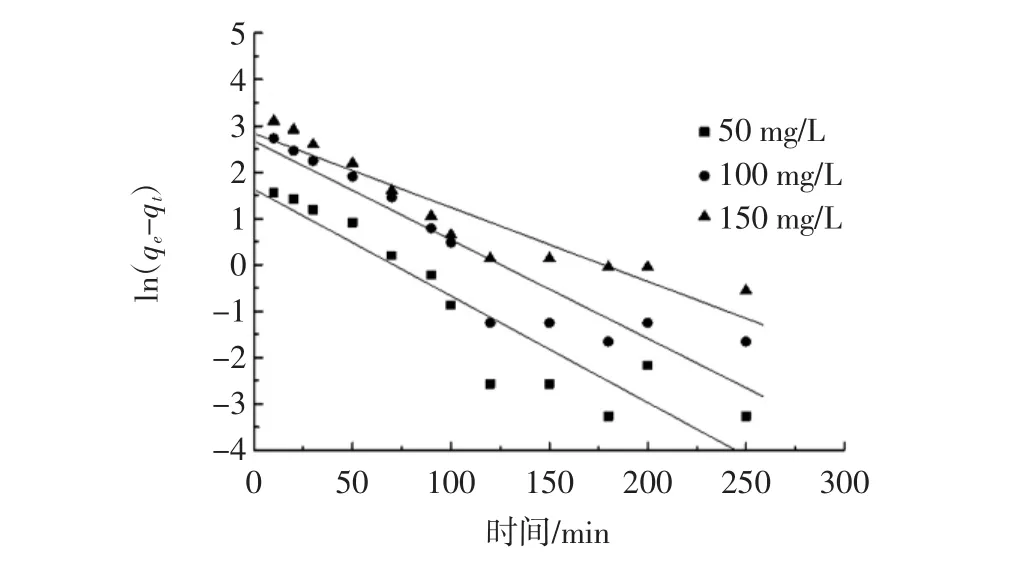
图3 壳聚糖吸附天冬酰胺的准一级动力学方程拟合结果Fig.3 Pseudo-first-order reaction equation of asparagine by chitosan

图4 壳聚糖吸附天冬酰胺的准二级动力学方程拟合结果Fig.4 Pseudo-second-order reaction equation of asparagine by chitosan

表1 壳聚糖吸附天冬酰胺的动力学模型拟合参数Table 1 Adsorption kinetics constant of asparagine by chitosan
由图2~图4和表1中的拟合参数可知,在50、100、150 mg/L 3个试验浓度条件下,通过试验吸附数据进行粒内扩散模型(R2值在 0.815 0~0.854 0)、准一级动力学模型(R2值在0.870 7~0.877 4)的拟合结果,发现其线性相关性一般;采用准二级动力学模型拟合结果的R2值在0.985 7~0.993 2,线性相关性较好,由此可以说明采用准二级动力学模型能更好地描述壳聚糖对天冬酰胺的吸附过程。
在试验条件下,当天冬酰胺的初始浓度分别为50、100、150 mg/L时,其动力学方程分别为:t/qt=0.133 4t+5.541 9、t/qt=0.043 5t+1.550 9、t/qt=0.029 6t+0.856 6。由准二级动力学方程计算出壳聚糖对天冬酰胺的吸附速率常数分别为0.003 211、0.001 220、0.001 023 g/(mg·min),理论吸附量分别为 7.496 3、22.988 5、33.783 8 mg/g,与试验值 6.108 9、19.235 9、28.825 2 mg/g相近。
2.2 壳聚糖对天冬酰胺的吸附等温线研究
为了探讨不同天冬酰胺浓度对壳聚糖吸附天冬酰胺的影响。按照试验方法1.2.4,在温度30℃,吸附时间120 min,天冬酰胺初始浓度为100 mg/L~1 500 mg/L的条件下,对水溶液中壳聚糖对天冬酰胺吸附作用进行等温线研究。根据实验数据,得到其吸附等温线见图5。
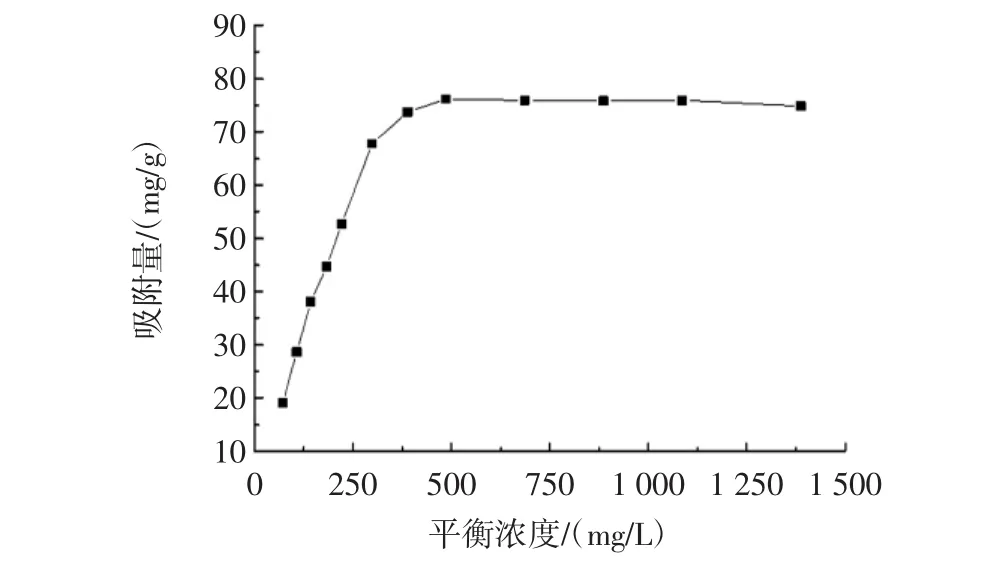
图5 壳聚糖对天冬酰胺的吸附等温线Fig.5 Adsorption isotherm of asparagine by chitosan
由图5可知,当天冬酰胺浓度较低时,壳聚糖对天冬酰胺的吸附量随着平衡浓度的升高而迅速增大,呈现一定的线性关系,吸附量增加较大较明显;当天冬酰胺的平衡浓度大于300 mg/L时,吸附量的增加量逐渐变小;当天冬酰胺的平衡浓度达到600 mg/L时,壳聚糖对天冬酰胺的吸附量达到饱和,基本维持在76.179 6 mg/g左右。此后,继续增加天冬酰胺溶液的浓度,吸附量基本不再变化。
按照试验方法1.2.5.2,分别用Langmuir等温方程和Freundlich等温方程对水溶液中壳聚糖对天冬酰胺的吸附等温线数据进行拟合,拟合结果见图6~图7和表2。

图6 壳聚糖吸附天冬酰胺的Langmuir等温方程线性拟合结果Fig.6 Linear fit of Langmuir isotherm equation of asparagine by chitosan

图7 壳聚糖吸附天冬酰胺的Freundlich等温方程线性拟合Fig.7 Linear fit of Freundlich isotherm equation of asparagine by chitosan
由表2可知,采用Langmuir和Freundlich等温吸附方程进行结果拟合的R2值分别为0.978 8和0.7980,吸附方程分别为Ce/qe=0.011 4 Ce+1.768 4、lnqe=1.454 5+0.435 0 lnCe。通过比较,Langmuir等温吸附方程的相关系数比Freundlich等温吸附方程更接近于1。由此说明,壳聚糖对天冬酰胺的吸附更符合Langmuir等温吸附模型。根据Langmuir等温吸附模型的假定,认为在水溶液中壳聚糖对天冬酰胺的吸附呈单分子层吸附,饱和吸附量为87.72 mg/g。

表2 壳聚糖吸附天冬酰胺的等温线拟合结果Table 2 Isothermal parameters for adsorption of asparagine by chitosan
3 结论
在水溶液中壳聚糖对天冬酰胺的吸附动力学符合准二级动力学方程,采用准二级动力学模型拟合得到的相关系数R2的范围为0.985 7~0.993 2。在天冬酰胺的初始质量浓度分别为50、100、150 mg/L时,壳聚糖对天冬酰胺的吸附平衡时间为120 min,吸附速率常数k值分别为0.003 211、0.001 220、0.001 023 g/(mg·min),其动力学方程分别为:t/qt=0.133 4t+5.541 9、t/qt=0.043 5t+1.550 9、t/qt=0.029 6t+0.856 6。其理论吸附量分别为 7.496 3、22.988 5、33.783 8 mg/g,与试验值6.108 9、19.235 9、28.825 2 mg/g较为接近。在水溶液中壳聚糖对天冬酰胺的吸附呈单分子层吸附,符合Langmuir等温吸附模型。其线性相关系数R2值为0.978 8,吸附方程和最大饱和吸附量分别为:Ce/qe=0.011 4 Ce+1.768 4和 87.72 mg/g。
蔗汁中的氨基酸及其它含氮物质,在制糖过程中可产生各种化学反应生成高分子的深色物质,对糖品质影响极大。本试验采用壳聚糖对小分子氨基酸类物质天冬酰胺的吸附能力进行了初步研究,结果表明壳聚糖对天冬酰胺具有一定的吸附能力,对蔗汁澄清工艺的新技术开发具有理论指导意义和实际应用价值。
