食源性致病菌的核酸可视微阵列检测技术
2020-11-11李云霞马生龙聂莹莹马莉萍
李云霞,马生龙,聂莹莹,马莉萍
(甘肃省科学院传感技术研究所 甘肃省传感器与传感技术重点实验室,甘肃 兰州730000)
近年来,食源性微生物中毒成为一个广泛且日益严重的全球性公共卫生问题[1-2]。调查表明,沙门氏菌、金黄色葡萄球菌、志贺氏菌是我国主要的食源性致病菌,由其引发的食物中毒平均发病率和病死率高,食品安全问题突出[3]。加强对有害病菌的检测研究,从而及时准确地检测出食品中的致病菌,是控制食品中病原菌污染和各类传染病蔓延的根本措施[4]。目前,国内外在食品中病原菌检测时常用的检测方法主要有传统生化培养检测法、免疫学方法、探针杂交、PCR法等[5-8],这些方法普遍存在速度慢或者假阳性率高的缺点,在相当大的程度上限制了对其快速检测和识别能力。因此,有必要建立起食源性致病菌的高通量、快速、准确的检测体系,以确保在相对较短的时间内正确判定食品的安全性,有效地预防和控制食源性疾病。
可视化视检测技术[9-10]是一种新型技术。与传统检测方法不同,它可以将特定的分子结合转变成可以直接通过肉眼观察到的信号,摆脱普通检测技术对专业人员和大型设备的依赖,具有快速、准确、方便的特点,在致病菌检测中具有良好的应用前景[11-13]。本研究中利用纳米金结合银染放大信号的方法,建立了一种可视化的食源性微生物快速检测微阵列,实现对3种食源性微生物的可视化快速检测。
1 材料与方法
1.1 试剂与仪器
沙门氏菌(21842)、金黄色葡萄球菌(10001)、志贺氏菌(10865):购自中国工业微生物菌种保藏管理中心(CICC);纳米金(自制)、醛基化玻片(自制)、吐温20(Tween 20)、牛血清蛋白(BSA)、0.1 mol/L磷酸缓冲液(PB)(pH 7.2)、0.1 mol/L磷酸缓冲生理盐水(PBS)、0.1 mol/L NaCl、0.2×洗液(SSC:质量分数0.1%十二烷基磺酸钠(SDS)、0.03 mol/L NaCl、0.3 mmol/L C6H5Na3O7·2H2O)、对苯二酚、柠檬酸、柠檬酸三钠、硝酸银、DNA Marker、所需探针序列:由生工生物公司合成;核酸提取试剂盒QIAamp Viral RNA Mini Kit(Qiagen)、PCR扩增试剂盒:购自上海生工生物有限公司。
杂交液:45.5μL检测探针,17.5μL 20×SSC,3 μL质量分数10% SDS,5 mg硫酸葡聚糖,2μL去离子甲酰胺,32μL去离子水。
JEM-2100HR高分辨透射电镜:日本电子公司产 品;Bio-Rad T100 PCR仪、Bio-Rad powerpac Unversal电泳仪、Bio-Rad ChemiDoc MP凝胶成像分析系统:美国伯乐公司产品;HZQ-FX全温振荡器:哈尔滨市东联电子技术开发有限公司产品;EMS-20恒温水浴锅:金坛市宏凯仪器厂制造;岛津紫外分光光度计:日本岛津公司产品;Sartorius ST124分析天平:德国赛多利斯公司产品;H1650型离心机:湖南湘仪公司产品;微量移液器:德国Eppendorf公司产品;DZF-6050真空干燥箱:上海一恒科学仪器有限公司产品;压力蒸汽灭菌锅:上海申安医疗器械厂制造。
1.2 引物、探针的设计与合成
在GenBank中获取细菌核酸序列,找到沙门氏菌invA基因、金黄色葡萄球菌nuc基因序列、志贺氏菌ipaH基因序列,利用Primer Premier 5.0软件设计与invA基因、nuc基因、ipaH基因序列两端互补的特异性探针(氨基化修饰的基片探针,巯基化修饰的检测探针)和PCR引物,并利用NCBI数据库在线Blast分析筛选。引物和探针均由上海生工生物有限公司合成。设计的探针和PCR引物见表1—2。
1.3 检测探针的标记
检测探针标记到纳米金表面:取10 nmol/L粒径为17 n的纳米金溶液1 mL,以9 000 r/min离心40 min弃上清液,加入100μL去离子水重悬;加浓度为100μmol/L的检测探针5μL,使总探针的终浓度达到5μmol/L,在室温中放置过夜;之后分3次逐渐加入1 mol/L NaCl,0.1 mol/L PB(pH 7.2)至最终浓度分别为0.1 mol/L和10 mmol/L,充分混匀,室温放置30 h;用0.01 mol/L PB(0.1 mol/L NaCl)溶液9 000 r/min离心40 min,清洗2次,弃上清液,再加100μL含有1 mol/L NaCl和0.1 mol/L PB(pH 7.2)的重悬液,于4℃下储存备用。

表1 核酸探针序列表Table 1 List of nucleic acid probe sequences

表2 PCR引物序列Table 2 Sequences of PCR primers
1.4 微阵列的制备
将5个不同浓度(1 mmol/L、100 nmol/L、1 nmol/L、100 pmol/L、1 pmol/L)氨基化探针点样于醛基化基片的表面,点样直径100μm,点间距3 mm,点样量0.1μL,每个浓度多次重复,水浴37℃固定18 h,经质量浓度为10 mg/mL的BSA封闭未反应的醛基,37℃水浴放置1 h,用0.1 mol/L的PBST(1×PBS+质量分数0.05%吐温)清洗2次,每次3 min,干燥后备用。
1.5 细菌基因组DNA的提取和扩增
快速提取细菌基因组DNA,用试剂盒提取:将细菌接种于牛肉膏蛋白胨液体培养基中,在37℃摇床培养12 h,取3 mL培养液3 000 r/min离心10 min,取上清液1 mL进行核酸提取,按DNA快速提取试剂盒说明书操作。
20μL PCR反应体系:10×Taq Buffer含KCl 2μL,引物各0.5μL(100 umol/L),4种dNTP混合物各1μL(0.2 mmol/L),模板DNA 1μL(100μmol/L),1.5 mmol/L MgCl 1.5μL,Taq DNA聚合酶0.5μL,加三蒸水至20μL。 扩增条件:94℃预变性5 min;经 变 性(94℃,30 s),退 火(55℃,30 s),延 伸(72℃,30 s),35个循环;最后于72℃延伸5 min。
1.6 微阵列的杂交
在基片的每个点样区滴加1μL杂交液,并将基片放置在保湿盒中,置于42℃水浴锅中杂交2.5 h。清洗液(0.03 mol/L氯化钠、0.3 mmol/L SSC、质量分数0.1% SDS)预热到42℃,轻轻冲洗芯片3次。ddH2O冲洗2次,氮气吹干。
1.7 银染
取350μL柠檬酸缓冲液,加入150μL对苯二酚(0.51 mol/L),再加入50μL AgNO3溶液,常温避光银染10 min,终止银染反应,用清水冲洗3次观察结果。
2 结果与讨论
2.1 检测探针的标记
从图1(a)中可见17 nm纳米金颗粒均匀,界面清晰而且分散性良好;图1(b)(c)(d)标记探针的纳米金可见周围有一层物质,纳米金在一定范围有聚集现象,表明探针已经标记到了纳米金上。随着探针的标记,纳米金粒径增大,对应的紫外吸收峰有向长波段红移的趋势[14-15];由图1(e)可看出:标记前纳米金最大吸收峰值在521 nm;标记沙门氏菌探针后最大吸收峰在528 nm;标记金黄色葡萄球菌探针后的最大吸收峰在527 nm;标记志贺氏菌探针后的最大吸收峰在525 nm,标记了探针的纳米金最大吸收峰波长移动了7 nm。这也说明核酸探针标记到了纳米金颗粒表面,使纳米金粒子尺寸和形状有所改变,改变了纳米金的光谱特性[16]。

图1 纳米金及修饰后的3种检测探针的TEM图和紫外-可见光谱扫描图Fig.1 Scanning results of AuNP probes with TEM and UV-Vis spectrum
2.2 细菌基因组DNA的提取结果
将提取的沙门氏菌、金黄色葡萄球菌和志贺氏菌的基因组DNA,采用分度光度计对提取的DNA溶液纯度、浓度进行检查,在1.5 g/dL琼脂糖凝胶中,100 V电压下,电泳时间30 min进行电泳检测,凝胶成像仪观察分析,与标记物(Marker)相比在6 500 bp附近有3条明亮条带(见图2)。
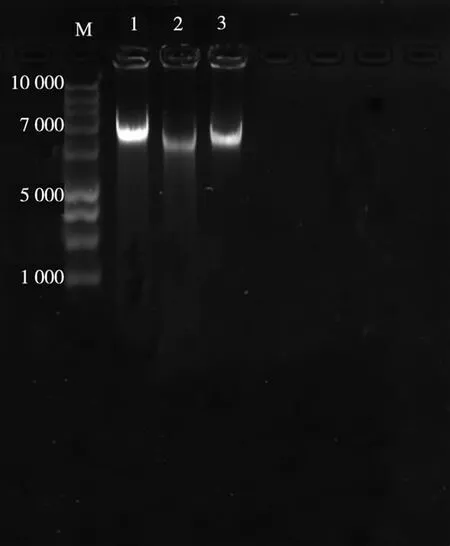
图2 3种菌的基因组DNA电泳图Fig.2 Salmonella、Staphylococcus aureus and Shigella DNA electrophoresis
2.3 细菌基因组DNA的PCR扩增
通过查阅沙门氏菌invA基因、金黄色葡萄球菌nuc基因、志贺氏菌ipaH基因的相关文献,并根据本实验中探针的位置,从表1中相对应引物对3株致病菌株进行扩增。对沙门氏茵、金黄色葡萄球菌、志贺氏菌PCR扩增结果做凝胶电泳:1.5 g/dL琼脂糖凝胶,100 V电压,电泳时间25 min,凝胶成像仪观察分析,1、2、3泳道分别得到长度为425、280、312 bp左右目的片段,片段符合预期扩增片段长度。而且泳道亮度很强,说明扩增产物较多(见图3)。

图3 沙门氏菌invA基因、金黄色葡萄球菌nuc基因序列和志贺氏菌ipaH基因PCR电泳图Fig.3 Salmonella invA gene、Staphylococcus aureus nuc gene and Shigella ipaH gene PCR
2.4 微整列杂交
将检测探针分别与基因组DNA(1 nmol/L)、PCR产物及特异靶序列在醛基化玻片上进行杂交,银染放大信号后呈现出肉眼可见的信号,见图4。

图4 特异靶序列、DNA及PCR银染显色Fig.4 Results of silver staining with specific target sequences,DNA and PCR
由实验可以看出检测探针分别与基因组DNA、PCR产物及特异靶序列杂交,银染显色,三者的结果一致都显示阳性,证明了提取的基因组DNA与检测探针杂交、PCR产物与检测探针杂交的方法都是可行的,但从操作的过程来讲用提取的基因组DNA与检测探针杂交银染显色,这一方法更简便快捷。
2.5 微阵列特异性实验
采用3种检测探针分别与3种菌的基因组DNA做杂交实验,通过银染放大信号,研究其特异性。
如图5(a)为特异靶序列invA只与沙门氏菌基因组DNA有杂交结合,结果显示阳性,而与金黄色葡萄球菌基因组DNA、志贺氏菌基因组DNA没有杂交反应,结果显示阴性;图5(b)为特异靶序列nuc只和金黄色葡萄球菌基因组DNA有杂交结合显示阳性结果,而与沙门氏菌、志贺氏菌DNA没有杂交反应,结果显示阴性;图5(c)为特异靶序列ipaH只和志贺氏菌基因组DNA有杂交结合,显示阳性,而与沙门氏菌、金黄色葡萄球菌DNA没有杂交反应,结果显示阴性。表明该方法的检测具有较高的特异性。

图5 微阵列特异性实验结果Fig.5 Specific experimental results of microarray substrate
2.6 微阵列灵敏度实验
将特异靶序列、基因组DNA(1 nmol/L)和PCR产物,使用UV-2550岛津紫外分光光度计测定其浓度,稀释原液配成5个不同浓度(1 mmol/L、100 nmol/L、1 nmol/L、100 pmol/L、1 pmol/L),进行杂交显色实验(见图6)。
由实验可以看出在5种不同浓度下,检测探针分别与基因组DNA、PCR产物及特异靶序列的杂交银染,结果一致都显示阳性,但随着浓度的减小,阳性信号相应的减弱。实验结果显示该微整列检出限为1 mmol/L~1 pmol/L。

图6 微阵列基片敏度实验结果Fig.6 Sensitivity experimental results of microarray substrate
3结语
银染信号放大技术已在致病菌的检测中被广泛应用,其有效提高了检测灵敏度。李向丽等[17]采用纳米金标记结合银染信号放大技术实现了对福氏志贺氏菌的检测,银染后检测信号增强了上万倍,对目标菌DNA检测限达2 fmol/L。刘小兰等[18]将PCR扩增的金黄色葡萄球菌nuc基因与生物素探针、纳米金探针形成的三明治结构固定在已包被链霉亲和素的微孔板上,然后在低温下逐步银染显色,从而放大检测信号,检测灵敏度为1 pmol/L。
作者通过银染放大信号技术,建立了一种同时检测沙门氏菌、金黄色葡萄球菌和志贺氏菌的可视化微阵列,为3种食源性微生物的检测提供了快速、准确、灵敏的方法。首先对invA基因序列、nuc基因序列、ipaH基因序列进行扩增,分别得到425、280、312 bp左右PCR产物。通过比较检测探针与基因组DNA、PCR产物及特异靶序列的杂交银染,目标菌都显示了阳性,非目标菌显示阴性。在微阵列特异性实验中,基因组DNA跟设计对应检测探针杂交结果显示阳性,跟其他菌检测探针不杂交,结果显示阴性,证明了该方法具有特异性。在微阵列灵敏性实验中,检测探针分别与基因组DNA、PCR产物及特异靶序列杂交时,在1 mmol/L~1 pmol/L浓度范围内,银染结果肉眼清晰可见。通过上述实验数据比较,证明作者建立的可视化核酸微阵列检测食源性微生物的方法是成功的。
作者建立的可视化核酸微阵列对食源性致病菌的检测灵敏、准确、简便,实用性强,摆脱了基因芯片在杂交结果分析阶段对荧光扫描仪的依赖,杂交结果明显直观。为食源性致病菌的检验提供了新的思路和方法,可在基层或偏远地区的快速初筛领域推广应用。
