重组猪干扰素α对急性病毒性腹泻仔猪肾脏损伤的保护作用研究
2020-11-03周炜夏兵兵吴博何志远蒋敏之许智勇赵俊王明丽
周炜,夏兵兵,吴博,何志远,蒋敏之,许智勇,赵俊,3*,王明丽,3*
(1.芜湖英特菲尔生物制品产业研究院有限公司,安徽芜湖 241000;2.安徽医科大学科教大楼生物工程实验室,合肥 230032;3.芜湖天明生物技术有限公司,安徽芜湖 241000)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由冠状病毒属中的猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的仔猪以呕吐、水样腹泻、脱水、厌食和迅速消瘦衰竭为临床特征,以肠道扩张、肠壁变薄、胃肠道出血和肠系膜淋巴结肿胀为主要病理变化的高度接触性传染病。1971年,英国首次报道了该病。我国于1976年首次报道,于1980年首次分离到 PEDV。2009年,韩国报道了 PEDV 毒株S基因发生变异。该病可感染所有阶段的猪,7日龄内仔猪感染后损伤最为严重,死亡率高达100%,育肥猪感染后出现腹泻、消瘦,母猪则表现腹泻、无乳等症状[1-2]。我国自2010年以来,PEDV感染呈现大面积爆发并伴有高致死率[3],已对养猪业造成严重危害[4]。干扰素(interferon,IFN)作为一种常用的广谱抗病毒药物,刺激机体产生成百上千种的干扰素刺激基因(IFN-stimulated gene,ISG)产物,具有抗病毒、抑制增殖和免疫调节功能,但不是直接灭活病毒,而是诱导机体产生多种具有抗病毒作用的蛋白质,抑制病毒蛋白的合成,适用于病毒性传染病的紧急预防和早期治疗。
研究表明,PEDV引发的腹泻可导致仔猪体内的蛋白质代谢紊乱,腹泻仔猪的血清球蛋白、尿素和肌酐水平显著升高(P<0.05),在引起腹泻造成哺乳仔猪的肠道损伤的同时,通过对感染PEDV病毒仔猪的小肠和肝肾组织切片对比观察发现,被感染仔猪除了肠道中小肠绒毛萎缩,大量炎性细胞浸润外,肝肾组织也出现了不同程度的损伤,如肝细胞局部变性坏死,肾小球充血、肾小管上皮细胞脱落坏死等[5]。
目前尚无有效药物治疗PED,临床主要以止泻、补液等对症治疗手段维持仔猪存活,但往往预后不良,常以发育迟缓的“僵猪”为结局,经济损失严重。本研究模拟PEDV自然粪口感染途径,建立了人工感染PEDV哺乳仔猪急性腹泻模型。在此模型上,采用了自行研制的重组猪干扰素α(recombinant porcine interferon α,rPoIFNα)进行抗病毒治疗,以观察评价该生物制剂对哺乳仔猪病毒性腹泻导致肾脏损伤的保护性治疗作用。
1 材料与方法
1.1 材料
1.1.1 试验动物 试验仔猪购自江苏句容康荣有限公司。选择10日龄健康三元哺乳仔猪,体重2.75±0.25 kg,雌雄兼用。对备选试验仔猪采集肛拭子样本,使用RT-PCR检测样本TGEV S基因、PEDV M基因和PoRV VP7基因片段;采集试验猪血样,使用中和试验方法-固定病毒稀释血清法对上述病毒的中和抗体进行检测,中和抗体≤1∶2为阴性。核酸片段和抗体检测均为阴性的试验猪方可使用。
1.1.2 病毒株 PEDV由实验室自行分离并测序鉴定,病毒滴度为1.0×105.5TCID50/mL。
1.1.3 重组猪干扰素α(冻干型) 安徽九川生物科技有限公司提供,批号20190301,100万单位/头份,用2 mL生理盐水溶解。
1.1.4 主要试剂和耗材 痢菌净(乙酰甲喹)、头孢噻呋钠、复合维生素B注射液,均购自合肥中龙神力动物药业有限公司;核酸提取试剂盒(9766)和逆转录试剂盒(6110A),均购自TaKaRa公司;5 mL无菌采血管、注射器、笼具。
1.1.5 试验地点及基本条件 饲养试验在洁净良好的动物房中完成(安徽医科大学实验动物中心)。仔猪采取隔离饲养方式,一猪一笼;试验期间保持通风良好,维持室温在为25~30 ℃,环境湿度为40%~80%。
1.2 试验分组及动物饲养
1.2.1 动物分组 选取试验仔猪15头,随机分组备用。一组为rPoIFNα治疗组,5头;一组为PEDV感染对照组,5头;一组为正常对照组5头。三组仔猪饲养条件均相同。
1.2.2 动物饲养 将7日龄仔猪单只隔离后,使用人工配制乳(幼儿奶粉、婴儿大米粉、葡萄糖)饲喂,适应性喂养3日。在此期间,可观察并淘汰因运输过程出现挤压受伤、因人工配制乳不耐受出现呕吐或腹泻症状以及无法自主从人工自制喂乳器吸食的仔猪。每日饲喂6次,攻毒当日饲喂5次(含10%葡萄糖溶液补饲),间隔3 h饲喂一次,以自制喂养器(洗耳球尖端剪断后安装在去掉针头的注射器头部,可对仔猪进食量进行准确控制并煮沸消毒。让仔猪自行吸食。同时在人工配制乳中添加复合维生素B,每日1次,0.2 mL/头。
1.3 攻毒及治疗方案
1.3.1 人工感染PEDV的剂量与途径 攻毒前仔猪禁食不禁水12 h,模拟自然感染途径经口饲喂接种病毒。rPoIFNα治疗组和PEDV感染对照组仔猪接种PEDV病毒悬液4 mL,正常对照组同时经口接种等量生理盐水。
1.3.2 重组猪干扰素α(冻干型)治疗方案 rPoIFNα治疗组仔猪在饲喂接种病毒8 h后,每头猪给予颈部肌肉注射1头份剂量的重组猪干扰素α(冻干型),间隔24 h再注射一次,连续注射三次,并同时给予辅助治疗;PEDV感染对照组仔猪则给予rPoIFNα治疗组同等的辅助治疗,但不注射重组猪干扰素α(冻干型),每头猪给予肌肉注射等量2 mL灭菌生理盐水,间隔24 h再注射一次,连续注射三次。
1.3.3 防治细菌继发感染 仔猪刚出现呕吐或腹泻症状时,对PEDV感染对照组和rPoIFNα治疗组所有仔猪同时肌肉注射痢菌净,剂量为每次2 mg/kg,每日2次,间隔12 h;仔猪攻毒24 h后对两组的所有仔猪增加肌肉注射头孢噻呋钠,每次3 mg/kg,每日2次,间隔12 h。
1.3.4 纠正脱水 仔猪中开始出现呕吐或腹泻症状时,即给予口服补液盐水,仔猪自由饮用。
1.4 观察、检测指标及方法
1.4.1 临床观察、数据统计及样本采集 逐日对每只仔猪仔细观察和详细记录各种临床症状出现的时间至接种病毒后72 h,在第72 小时进行前腔静脉采血2 mL/头和膀胱穿刺取尿5 mL/头,随后将仔猪麻醉处死并剖检,观察肠道肾脏组织脏器标本的大体外观变化和组织病理变化,对血液和尿液样本进行生化指标检测。
1.4.2 粪便形态评分标准 参考人用布里斯托大便分类法[6],设定人工感染仔猪流行性腹泻病毒模型腹泻指数评分标准(表1),以腹泻指数评分标准达到2分以上(含2分)为仔猪具有流行性腹泻发病症状。

表1 腹泻指数评分标准Tab 1 Diarrhea index scoring criteria
1.4.3 治疗有效率临床判定标准 有效:观察至攻毒后第72 小时,PEDV感染对照组3头以上(含3头)仔猪发病腹泻指数达到3分,rPoIFNα治疗组腹泻指数降为2分或以下;无效:观察至攻毒后第72 小时,PEDV感染对照组3头以上(含3头)仔猪腹泻指数达到2分或以上,rPoIFNα治疗组腹泻指数较对照组不降低。有效率=(rPoIFNα治疗组有效数-PEDV感染对照组未发病数)/PEDV感染对照组发病数×100%。
1.5 组织病料病毒核酸检测 剖检rPoIFNα治疗组、PEDV感染对照组和正常对照组仔猪,分别采集其小肠及肾皮质组织,冻存于-80 ℃,备用。将组织病料剪碎后用0.01 mol/L PBS按1∶10体积稀释后匀浆,并置-80 ℃反复冻融三次;冻融后的样品4 ℃、12000 g离心15 min,收集上清液并用0.22 μm滤器过滤除菌后,RT-PCR检测PEDV M基因。PEDV M基因扩增引物序列:F1:5’-AACGGTTCTATTCCCGTTGATG-3’;R1:5’-TAAATGAAGCACTTTCTCACTATC-3’,预期扩增产物大小663 bp;内参β-acting基因扩增引物序列:F2:5’-CCACTGGCATTGTCATGGAC;R2:5’-GAAGAGCGCCTCTGGACAC-3’,预期扩增产物大小344 bp,以上引物序列均由大连宝生物工程(大连)有限公司合成。将PCR产物用1%琼脂糖凝胶电泳检测观察结果,出现阳性条带送深圳华大基因生物科技有限公司测序。
1.6 数据处理 采用t检验对相关数据进行统计学处理,结果P<0.05表示有统计学意义,两者差异有显著性;P<0.01表示有高度统计学意义,两者有极显著差异。
2 结果与分析
2.1 临床观察与腹泻指数评分
2.1.1 临床治疗结果 rPoIFNα治疗组和PEDV感染对照组仔猪均在接种病毒第24小时内出现呕吐或粥样腹泻出现发病;第24~48小时间,PEDV感染对照组有3头出现腹泻指数为3,其余2头在第48小时时腹泻指数为2,直至第72小时,1头仔猪腹泻指数为2,4头仔猪腹泻指数为3:主要为黄色水样腹泻,体重快速下降表现外形消瘦。rPoIFNα治疗组3头在第48小时时腹泻指数为2,至第72小时时好转为腹泻指数1,另2头仔猪排便正常;正常对照组仔猪始终排便正常(表2)。

表2 哺乳仔猪人工感染PEDV 第72小时结果Tab 2 Results of artificial infection with PEDV in suckling piglets at 72 h
2.1.2 剖检结果 剖检发现所有试验发病仔猪主要病理变化发生在肾脏和肠道。三组仔猪肾脏表面无出血点,与正常对照组相比(图1C),PEDV感染对照组仔猪肾脏肿大,表面肿胀呈丘壑隆起(图1A),其体积已超过正常对照组仔猪肾脏约30%,脏器系数高出正常对照组约15%,具有统计学意义;rPoIFNα治疗组肾脏变化则无统计学意义(表3)。PEDV感染对照组表现空肠扩张有轻度充气现象,肠壁充血、变薄;结肠和盲肠充气扩张严重,肠壁变薄透明;胃部充气扩张严重(图2A);rPoIFNα治疗组空肠无明显扩张,肠壁未见明显充血及变薄,肠壁毛细血管树枝样充血,结肠有轻度充气扩张(图2B)。

表3 各组仔猪肾脏检测结果Tab 3 kidney related data of experimental piglets

A:PEDV感染对照组;B:rPoIFNα治疗组;C:正常对照组A::PEDV control group;B:rPoIFNα treatment group;C:Negative control group图1 试验仔猪肾脏外观观察Fig 1 Appearance of kidney in experimental piglets

A:PEDV感染对照组;B:rPoIFNα治疗组;C:正常对照组A:PEDV control group;B:rPoIFNα treatment group;C:Negative control group图2 试验仔猪肠道剖检观察Fig 2 Observation on intestinal dissection of experimental piglets
2.2 肾组织HE染色病理学镜下观察结果 观察三组仔猪肾组织制作病理切片发现,PEDV感染对照组仔猪肾脏样本肾间质中每个视野内有2个或以上嗜酸性粒细胞,同时发现肾小管上皮细胞大量空泡变性(图3A);rPoIFNα治疗组则偶见肾小管空泡变性,未见嗜酸性粒细胞(图3B)。
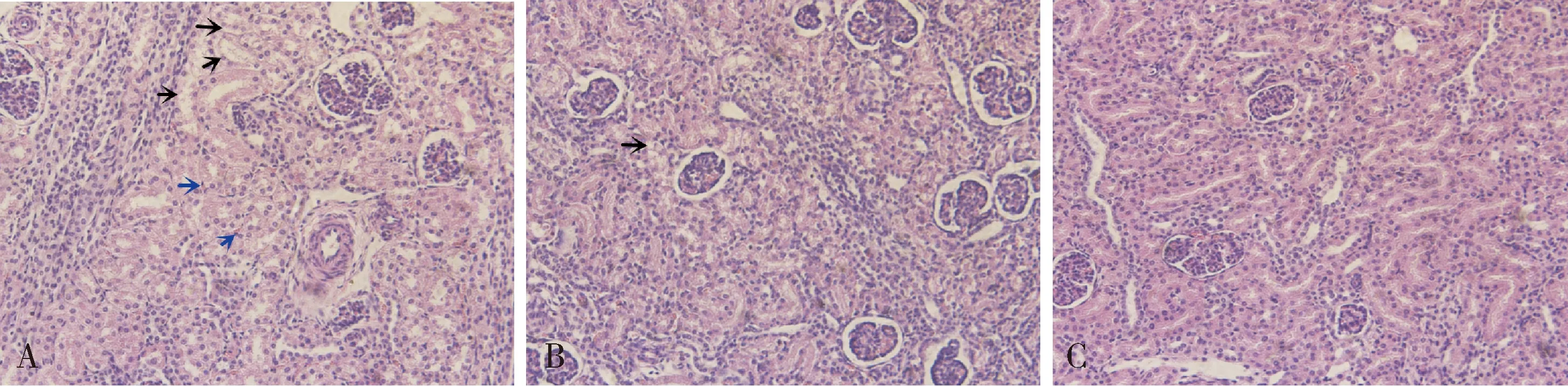
A:PEDV感染对照组;B:rPoIFNα治疗组;C:正常对照组 黑色箭头:空泡变性;蓝色箭头:嗜酸性粒细胞A:PEDV control group;B:Interferon treatment group;C:Negative control group Black arrows:vacuolar degeneration;Bule arrows:eosinophils图3 仔猪肾脏病理切片(200×)Fig 3 Pathological section of kidney in piglets (200×)
2.3 病料组织病毒核酸检测结果 RT-PCR检测各组小肠与肾皮质组织病料,结果显示,PEDV感染对照组病料中检测到的PEDV M基因核酸含量较高,可扩增出特异性目的条带,扩增产物大小为663 bp(图4),将扩增产物进行测序,部分峰图(图5)与GenBank公布的PEDV M基因序列比对分析,匹配度达到99%[8];rPoIFNα治疗组发病仔猪相应组织提取的PEDV M基因核酸含量降低明显,3头发病仔猪仅1头病料可扩增出特异性目的条带,阳性率约30%,与PEDV感染对照组存在统计学差异。

M:DNA标准2000;1:PEDV M阳性对照;2-3:正常对照组仔猪病料组织;4-6:rPoIFNα治疗组发病仔猪病料组织;7-10:PEDV感染对照组腹泻指数为3的仔猪病料组织M:DNA Marker 2000;1:PEDV M positive control;2-3:Diseased tissue of normal control piglets;4-6:Diseased tissue of diseased piglets in rPoIFNα treatment group;7-10:Diseased tissue of diseased piglets with diarrhea index 3 in PEDV control group图4 仔猪小肠组织病料PEDV M基因RT-PCR检测结果Fig 4 RT-PCR results of PEDV M gene in piglets tissue disease material

图5 RT-PCR扩增PEDV M基因测序部分峰图Fig 5 Sequencing partial peaks of PEDV M gene amplified by RT-PCR
2.4 各组仔猪血液肾功能检测 攻毒后72 h所有仔猪无菌采集全血后,分离血清进行肾脏生化指标检测。结果显示,仔猪血肌酐虽然均在参考值以内,但rPoIFNα治疗组与PEDV感染对照组存在显著差异,与正常对照组无明显差异;三组仔猪的尿素氮和尿酸数据均无明显差异(表4)。
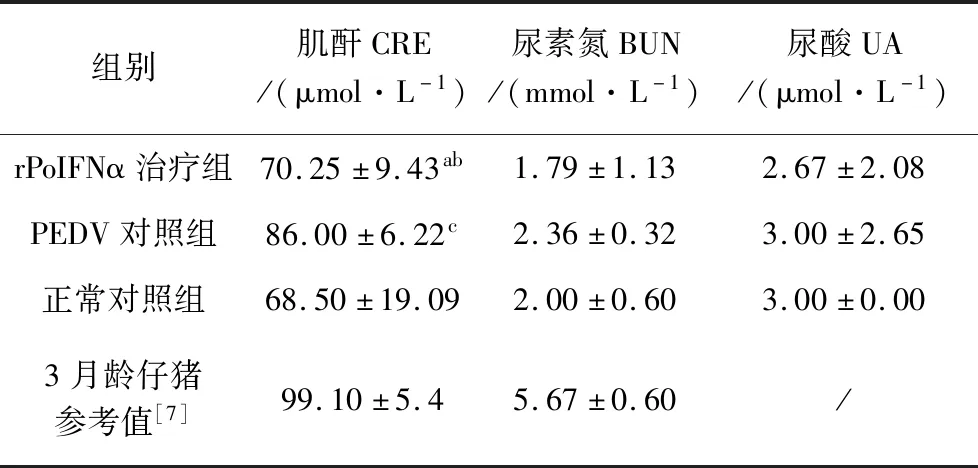
表4 各组仔猪肾功能检测结果Tab 4 Renal function test of experimental piglets
2.5 尿常规检测结果 攻毒后72 h所有仔猪从膀胱直接抽取尿液进行尿常规检测,表5检测结果显示,与正常对照组相比,rPoIFNα治疗组和PEDV感染对照组尿液pH均有所降低,尿比重增加,其中PEDV感染对照组尿比重上升明显,提示仔猪脱水状态较rPoIFNα治疗组更为严重,并且PEDV感染对照组仔猪尿液中出现蛋白尿,尿沉渣镜检出颗粒管型,表明重度腹泻的仔猪肾脏功能严重受损。

表5 各组仔猪尿常规主要检测结果Tab 5 The main results of urine routine test of experimental piglets
3 讨论与结论
现有研究已发现,2019新型冠状病毒引起的新型冠状病毒肺炎(COVID-19),除了呼吸系统典型症状外,肾脏也是新型冠状病毒感染的主要靶点之一,病毒入侵诱发的细胞因子风暴、炎症细胞浸润和病毒直接攻击肾脏均可以引起肾脏损伤,并且临床证据也表明,肾脏损伤比例较高[9]。糖皮质激素是肾病综合征等肾脏疾病的常用药物,但从已有统计结果来看,SARS治疗中激素类药物是引起不良反应的主要因素[10],而目前临床专家对糖皮质激素在COVID-19 的治疗过程中的作用仍有较大争议[11]。因此需要对抗病毒药物能否同时对肾脏起到保护作用做进一步研究。本研究所采用的PEDV同为冠状病毒科冠状病毒属成员之一,基因组是单股正链RNA,对易感者感染性极强。虽然PEDV主要临床症状表现为腹泻,但其对肾脏损伤的病理表现与COVID-19相类似,均表现出炎性细胞浸润、肾小管坏死、空泡变性等[12-13],可利用该病毒的人工感染模型来研究干扰素及新型药物对冠状病毒造成的肾脏损伤所起到保护作用的分子机制。
PEDV主要利用其S蛋白与仔猪肠道细胞表面受体结合,通过膜融合侵入易感的小肠绒毛上皮细胞并大量复制[14],与SARS、MERS等冠状病毒感染机制基本相同。同时发现,这些高致病性病毒的致病机制与病毒感染宿主后大量上调炎症因子分泌而抑制干扰素通路有关[15]。但随着近年来对IFN抗病毒相关机制的研究发现,IFN主要是通过激活下游干扰素信号通路,转录多种ISG,启动宿主对病毒等的防御反应。ISG根据其功能主要有3类,第一类是具有直接抗病毒功能的 ISG;第二类是增强宿主对病毒的识别和反应的正调控因子;第三类是 IFN 诱导产生的负调控分子[16]。如干扰素诱导跨膜蛋白(interferon-inducedtransmembrane protein,IFITM)是一种具有广泛抑制病毒感染的ISG,可通过抑制病毒与宿主细胞间的膜融合,有效抑制冠状病毒感染[17];细胞因子信号转导抑制因子(suppressor of cytokine signaling,SOCS)是重要的 IFN负调控因子,通过负反馈方式调节细胞因子启动的 JAK/STAT 信号传导通路[18],从而可抑制炎性细胞因子的表达而减少炎症损伤。综上所述,给予外源性IFNα从理论上可以有效抑制PEDV感染以及减轻因病毒感染导致的各重要器官炎症损伤。
本次研究使用rPoIFNα治疗PEDV感染引发的仔猪急性病毒性腹泻,从试验结果上来看,rPoIFNα对于PEDV感染仔猪具有明显治疗效果,PEDV感染对照组出现的临床较典型的肠道扩张充血等病理变化与rPoIFNα治疗组相比,后者已明显减轻或与正常对照组类同。虽然没有可供参考的14日龄仔猪(攻毒72 h后仔猪日龄)肾脏生化指标,但三组试验仔猪血肌酐数值与腹泻指数相关,腹泻指数越高,血肌酐数值越高。rPoIFNα治疗组的仔猪肌酐指标明显降低并且与正常对照组无明显差异;同时因为血肌酐只有在肾小球滤过率下降比例较大时(超过50%),其数值才会超出正常值范围,因此本研究的三组试验仔猪血肌酐指数虽均在参考值范围内,但由于造成急性肾损伤(acute kidney injury,AKI)的因素多样,单纯基于肌酐水平变化的诊断容易对真实肾功能造成误判[19]。综合尿常规检测结果,rPoIFNα治疗组仔猪从生化指标上已基本恢复,与正常对照组仔猪无显著差异。
许慧莹等[20]报道嗜酸性粒细胞胃肠炎的发病机制常与过敏原引起的机体产生的超敏反应有关。本研究在光镜下观察了经HE染色的病理切片发现,PEDV感染对照组仔猪肠、肾脏组织内均发现数量不等的嗜酸性粒细胞,提示PEDV感染仔猪导致的肠、肾脏损伤的发生与发展确与机体的超敏反应有关。同时发现,rPoIFNα治疗组仔猪肾组织未见嗜酸性粒细胞,提示使用rPoIFNα治疗后,因干扰素诱导的ISG的负调控作用,可降低机体的超敏反应,从而一定程度上减轻或消除因超敏反应导致的肾脏损伤。此外PEDV感染导致的典型肾小管上皮细胞空泡变性在rPoIFNα治疗组偶见,同样说明IFNα对于治疗急性肾小管损伤具有一定的保护作用。
本次研究发现,使用rPoIFNα治疗可明显保护感染PEDV仔猪的肾脏及其功能,但使用时机为早期、足量才能达到明显临床效果。对于肾脏损伤各个时间段的病理变化尚缺少完整研究,并缺乏对于感染组与治疗组仔猪脏器中发病各阶段的病毒核酸定量检测,只能提示rPoIFNα早期治疗效果。下一步研究的主要方向之一是对病毒感染量与肾脏损伤程度之间的关联观察及分析。同时需要考虑的是,rPoIFNα同样也可能因ISG的正调控作用导致细胞因子风暴从而加重病情[21]。此研究为今后指导临床采用IFNα治疗新冠病毒等感染,减轻对肾脏损伤提供了试验基础,也为病毒感染导致的AKI提供新治疗思路。
