连花柴芩可溶性粉的毒理学研究
2020-11-03李晓王学方范毅张丽先陈娟吴春丽曹静亚
李晓,王学方,范毅,张丽先,陈娟,吴春丽,曹静亚
(1.河南省生物技术开发中心,郑州 450002;2.河南省科高植物天然产物开发工程技术有限公司,郑州 450002;3.河南中亚神鹏医药科技有限公司,郑州 450061;4.郑州大学药学院,郑州 450001)
连花柴芩可溶性粉是由《温病条辨》中的“银翘散”和《伤寒杂病论》中的“小柴胡汤”两个经典方加减组方而成,结合银翘散辛凉透表、清热解毒[1]和小柴胡汤和解少阳、和胃降逆、扶正祛邪的功效[2],临床拟用于风热犯肺所致的鸡发热、咳嗽、口渴喜饮、食欲减退等证。方中连翘[3]、山银花[4]为君药,辛凉解表、疏散表邪;柴胡[5]和解退热,升举阳气;黄芩[6,7]清热燥湿,泻火解毒,两药配伍,清解半表半里之邪,使郁热外达为臣药;紫苏叶祛风解表、行气和胃,甘草补脾益气、祛痰止咳、调和诸药共为佐使。现代药理研究表明本方具有明显的抗炎解热、止咳祛痰与调节免疫的功效[8]。本研究旨在探讨连花柴芩可溶性粉对小鼠急性毒性试验的安全性,对连续30 d给药的大鼠长期毒性试验中大鼠的一般症状、体重、摄食量、血液学、血液生化学、脏器系数以及组织病理学的影响[9-14]。研究其可能引起的不良反应和毒性特征,判断连花柴芩可溶性粉的毒性靶器官或靶组织,以期为临床用药的安全性提供依据。
1 材 料
1.1 受试药物 连花柴芩可溶性粉,河南中亚神鹏医药科技有限公司提供,批号20170617,经河南省兽药监察所检验符合规定。
1.2 试验动物 SPF级昆明小鼠,雌雄各半,体质量范围18±2 g,SPF级SD大鼠,雌雄各半,给药时动物体重范围为180(g)±20%,购自河南省实验动物中心,许可证号SCXK(豫)2010-0002。普通环境饲养,自由摄食、进水。
1.3 主要试剂 谷草转氨酶(AST)、谷丙氨酸转氨酶(ALT)、总蛋白(TP)、血糖(GLU)、总胆固醇(CHO)、甘油三酯(TG)、白蛋白(ALB)、尿素氮(BUN)和肌酐(CRE)试剂盒购自艾美捷科技有限公司。苏木素染色液、伊红染色液、中性树胶、苦味酸均购自Sigma公司。
1.4 主要仪器 ABX-PENTRA-80全自动血细胞分析仪,法国HORIBA公司;C2000-4型血凝仪,北京普利生仪器有限公司;XSP-24 N型生物显微镜,南京江南光电集团股份有限公司;TDL80-2B低速台式离心机,上海安亭科学仪器总厂;BT-2000PLUS全自动生化分析仪,意大利BT公司;DSI 905电解质分析仪,上海迅达医疗仪器有限公司;FA1004 N电子天平,上海精密科学仪器公司天平仪器厂;YD-12P型全自动生物组织脱水机,浙江金华益迪医疗设备厂;YD-6L型全自动生物组织冷冻包埋机,浙江金华益迪医疗设备厂;YD-B型智能型生物组织烤片机,浙江金华益迪医疗设备厂;LEICA RM2235型生物组织切片机,德国LEICA公司;DM-BA300数码生物显微镜,厦门麦克奥迪公司。
2 方 法
2.1 小鼠急性毒性实验 预实验以连花柴芩可溶性粉药液的粘滞度能勉强通过小鼠用12号灌胃针头的浓度0.625 g·mL-1为最大给药浓度,以小鼠单次最大灌胃容量20 mL·kg-1计算,灌胃2次,最高剂量组设为25.0 g·kg-1。24只小鼠,雌雄各半,随机分4组,以最大给药容积24 h内分2次给药,共给药1 d,试验期间小鼠健康活泼,无一死亡。
正式试验取健康小鼠40只,雌雄各半,随机分为4组,每组10只。以预实验的最高剂量组25.0 g·kg-1,设为试验高剂量组,按剂量等比级数1∶0.5,依次得到试验中剂量组12.5 g·kg-1和试验低剂量组6.25 g·kg-1,空白对照组灌服无菌蒸馏水,各组均按20 mL·kg-1单次灌胃容量,每天灌胃2次(间隔时间<3 h),共给药1 d,常规饲养2周,记录各组小鼠的死亡情况,中毒情况,中毒发生时间,持续时间等,对死亡动物及时进行剖检,记录病变情况。
2.2 大鼠长期毒性试验
2.2.1 动物的分组与给药
2.2.1.1 动物分组 为保持体重测定方法和给药时体重标准的一致性,根据检疫期末日体重分组。选取雌雄各40只体重相近且符合试验要求的大鼠,使用EXCEL软件将大鼠按性别、体重随机分为4组,即试验高、中、低剂量组与空白对照组,每组20只,同时采用SPSS18.0软件分析各组大鼠体重差异,保证试验前各组大鼠体重无显著差异。
2.2.1.2 剂量设计与给药 小鼠急性毒性试验结果显示,供试品在小鼠的最大给药剂量为25.0 g·kg-1。因此,本试验高剂量按最大给药剂量设定,3个剂量组分别为,高剂量组25.0 g·kg-1、中剂量组12.5 g·kg-1、低剂量组6.25 g·kg-1,并加设空白对照组。按20 mL·kg-1灌胃给药,每日2次(间隔时间<3 h),每周给药7 d,连续30 d。在末次给药后24 h处死所有动物,进行实验室检测和病理形态与组织学检查。
2.2.2 试验观察
2.2.2.1 一般状况观察 试验期间,每天观察记录试验动物的大体反应、活动状况、毛色、粪便,记录动物的异常表现及死亡情况。
2.2.2.2 体重测定 动物入室当日与给药前各测定体重一次,给药期均每周测定一次。其中,称重当日称重后给药,解剖日提前测定体重。
2.2.2.3 摄食量测定 为保证摄食量测定的规范性和完整性,摄食量测定的日期规定在体重测定日期。(给予量-剩余量)/进食动物数/测定周期,即每天每只动物平均摄食量。
2.2.3 指标检测 末次给药24 h后,称重,采血,血液用于血液学和血液生化指标测定,然后处死大鼠,迅速解剖,观察主要脏器有无病变,并对大鼠主要脏器称重并计算其脏器系数;病理解剖对心、肝、肾、脾、肺等肉眼观察及组织病理学检查。
2.2.3.1 血液学指标 测定前一日撤除饲料,禁食过夜。检测日麻醉动物、解剖,由腹主动脉取血2 mL,加入EDTA-K2+常规管中。检测血液学指标:红细胞计数(RBC)、血红蛋白(HGB)、白细胞计数(WBC)、中性粒细胞(NEU)、淋巴细胞(LYM)、单核细胞(MONO)、嗜酸性粒细胞(EOS)、嗜碱性粒细胞(BASO)的分类计数。
2.2.3.2 血液生化指标的检测 检测指标:测定前一日撤取饲料,禁食过夜。检测日麻醉动物、解剖,从腹主动脉取血约5 mL,分离血清。检测血液生化指标:谷草转氨酶(AST)、谷丙氨酸转氨酶(ALT)、总蛋白(TP)、血糖(GLU)、总胆固醇(CHO)、甘油三酯(TG)、血清白蛋白(ALB)、尿素氮(BUN)和肌酐(CRE)。
2.2.3.3 组织病理学检查 于试验结束进行剖检。剖检试验大鼠的同时,称取大鼠体重及各主要脏器(包括心、肝、脾、肺、肾、脑、睾丸、卵巢子宫)重量,做好记录,计算各脏器的相对重量(脏/体比值)。对高剂量组和对照组的心、肝、脾、肺、肾、胃、小肠、睾丸及卵巢进行组织病理学检查。当判断某个脏器由药物引起病理变化时,追加检测中、低剂量组相应脏器的组织学变化。
2.2.4 数据统计 体重测定、摄食量、脏器重、血液学检测、血液生化学检测的数据采用SPSS17.0进行统计分析(One-way ANOVA法检验,组间用LSD法两两比较,检验水准α=0.05);病理检查根据镜检记录进行分析。
3 结果与分析
3.1 小鼠急性毒性试验 试验期间小鼠无死亡,精神状态、运动、饮食欲无异常变化。
给药当天除试验高剂量组见个别小鼠活动减少,其余各组小鼠毛色光滑,粪便、摄食、活动均未见异常;自给药后第2 d开始各组小鼠活动、体重增长、粪便等均未见异常,与空白对照组比较无明显差异,且14 d内无死亡及其他异常发生。各组处死后剖检,试验高、中、低剂量组各小鼠主要脏器 (心、肝、脾、胃、肺、肾等)经观察未见异常改变。
3.2 大鼠长期毒性试验
3.2.1 一般症状 试验期间,没有发现明显与受试物相关的动物异常活动。所有剂量组动物的饮食、饮水、粪便等均正常。未发生因给予受试物作用引起大鼠濒死和死亡的毒性反应。
3.2.2 体重 大鼠连续灌胃给药30 d,各试验组雌、雄动物的体重及增值与空白对照组动物比较,均未见显著性差异,结果见表1、表2。

表1 雌性大鼠体重测定表Tab 1 Body weight measurement of female rats
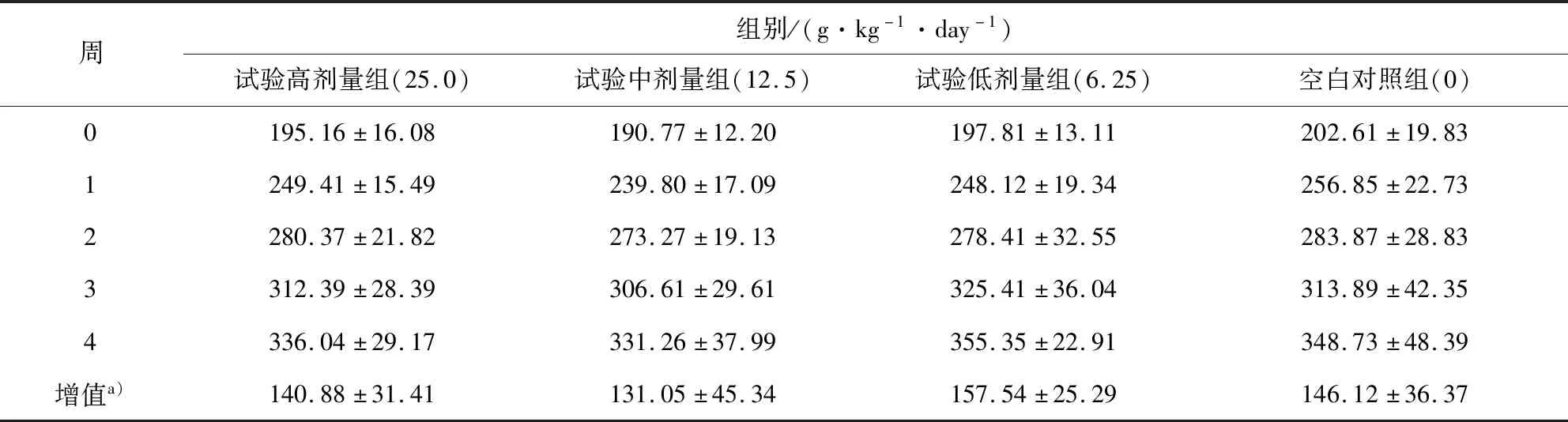
表2 雄性大鼠体重测定表Tab 2 Body weight measurement of male rats
3.2.3 摄食量 雌性动物给药第3周和4周,试验高剂量组与空白对照组相比有下降趋势(P<0.05);雄性动物给药第2周,试验高剂量组与空白对照组相比有下降趋势(P<0.05),其他各组各时段均未见显著性差异,结果见表3、表4。
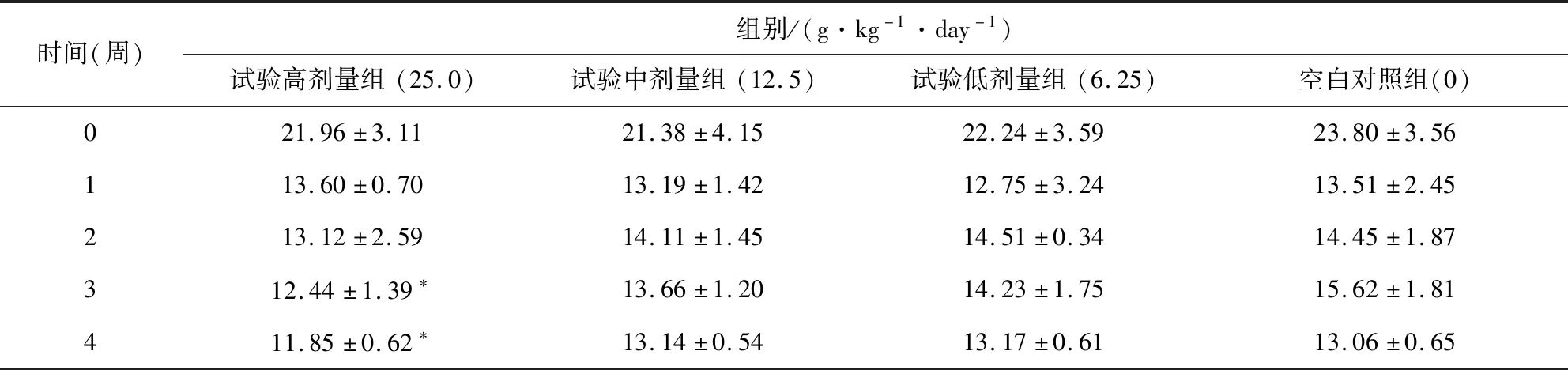
表3 雌性大鼠摄食量测定表Tab 3 Determination of food intake of female rats

表4 雄性大鼠摄食量测定表Table 4 Determination of food intake of male rats
3.2.4 血液学 雌性动物试验高剂量组与空白对照组相比LYM有降低趋势,MONO、BASO、EOS有增加趋势(P<0.01或P<0.05);试验中剂量组与空白对照组相比LYM有降低趋势,MONO、BASO有增加趋势(P<0.01或P<0.05);试验低剂量组与空白对照组相比MONO、BASO有增加趋势(P<0.01或P<0.05)。结果见表5。

表5 雌性大鼠血液学检测表Tab 5 Hematology test table of female rats
雄性动物试验高剂量组与空白对照组相比NEU有增加趋势(P<0.05);其他指标均未出现统计学差异。结果表6。
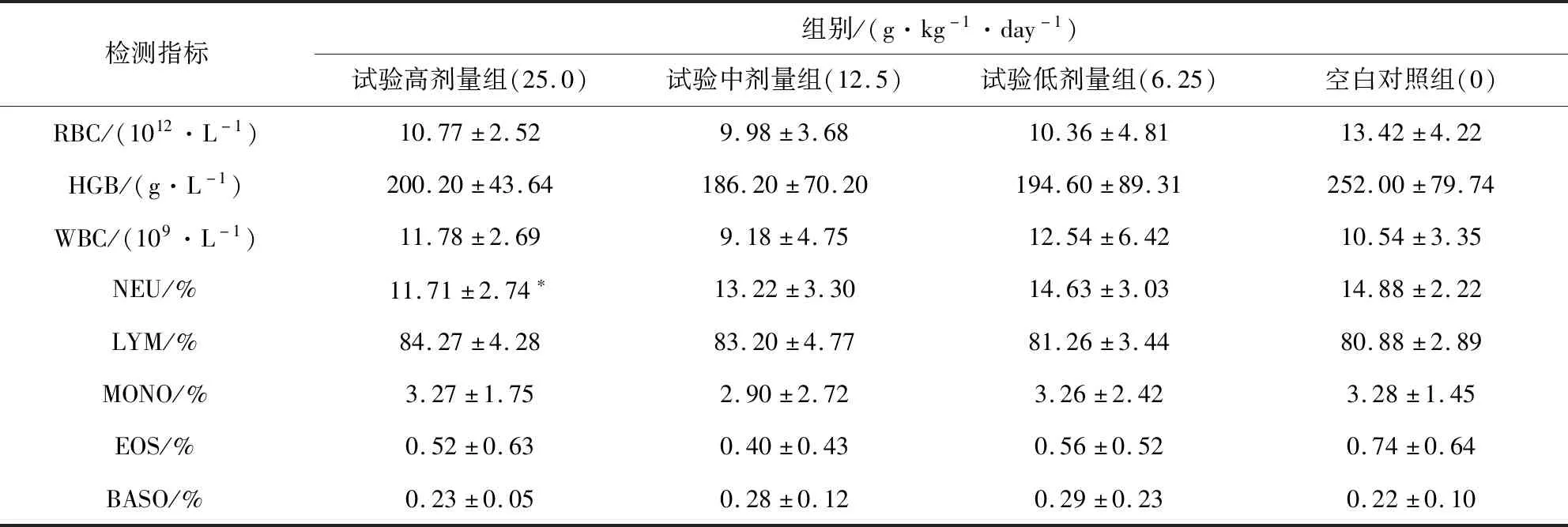
表6 雄性大鼠血液学检测表Tab 6 Hematology test of male rats
3.2.5 血液生化学 雌性动物试验高剂量组与空白对照组比较ALB、GLU均有增加趋势(P<0.01或P<0.05);试验中剂量组与空白对照组比较ALB、GLU均有增加趋势(P<0.01);试验低剂量组与空白对照组比较CHO有降低趋势(P<0.01),BUN有增加趋势(P<0.01)。结果见表7。

表7 雌性大鼠血液生化学检测表Tab 7 Biochemical examination of blood of female rats
雄性动物试验高剂量组与空白对照组比较ALT、GLU有降低趋势(P<0.05),ALB、BUN有增加趋势(P<0.01);试验中剂量组与空白对照组比较GLU有降低趋势(P<0.05),试验低剂量组与空白对照组比较GLU有降低趋势(P<0.01)。其他指标均未出现统计学差异。结果见表8。

表8 雄性大鼠血液生化学检测表Tab 8 Biochemical examination of blood of male rats
3.2.6 脏器系数 大鼠连续给药30 d,雌性动物试验低剂量组的脾脏脏器系数较对照组有增加趋势(P<0.05)。其他指标均未出现统计学差异。结果见表9、表10。
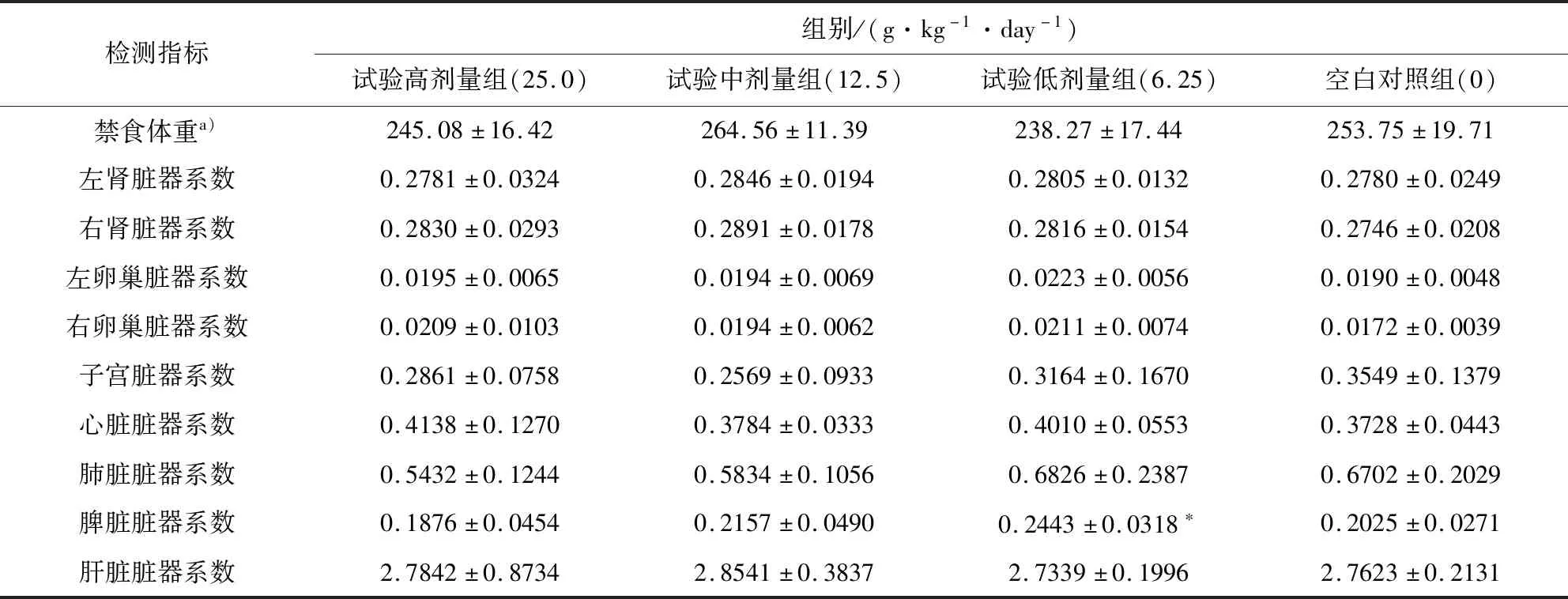
表9 雌性大鼠绝对/相对脏器系数表Tab 9 Absolute / relative organ coefficient of female rats

表10 雄性大鼠绝对/相对脏器系数表Tab 10 Absolute/relative organ coefficient of male rats
3.2.7 病理解剖及组织病理学 给药30 d,各组剖检后肉眼观察动物的心、肝、脾、肺、肾、肾上腺、脑、睾丸、附睾、子宫、卵巢等,未见异常变化。对主要脏器肝、肾、脾、胃肠、睾丸及卵巢进行组织病理学检查也未见与受试物毒性作用相关的组织病理学变化。组织病理学图片见附图(图1-图18)。
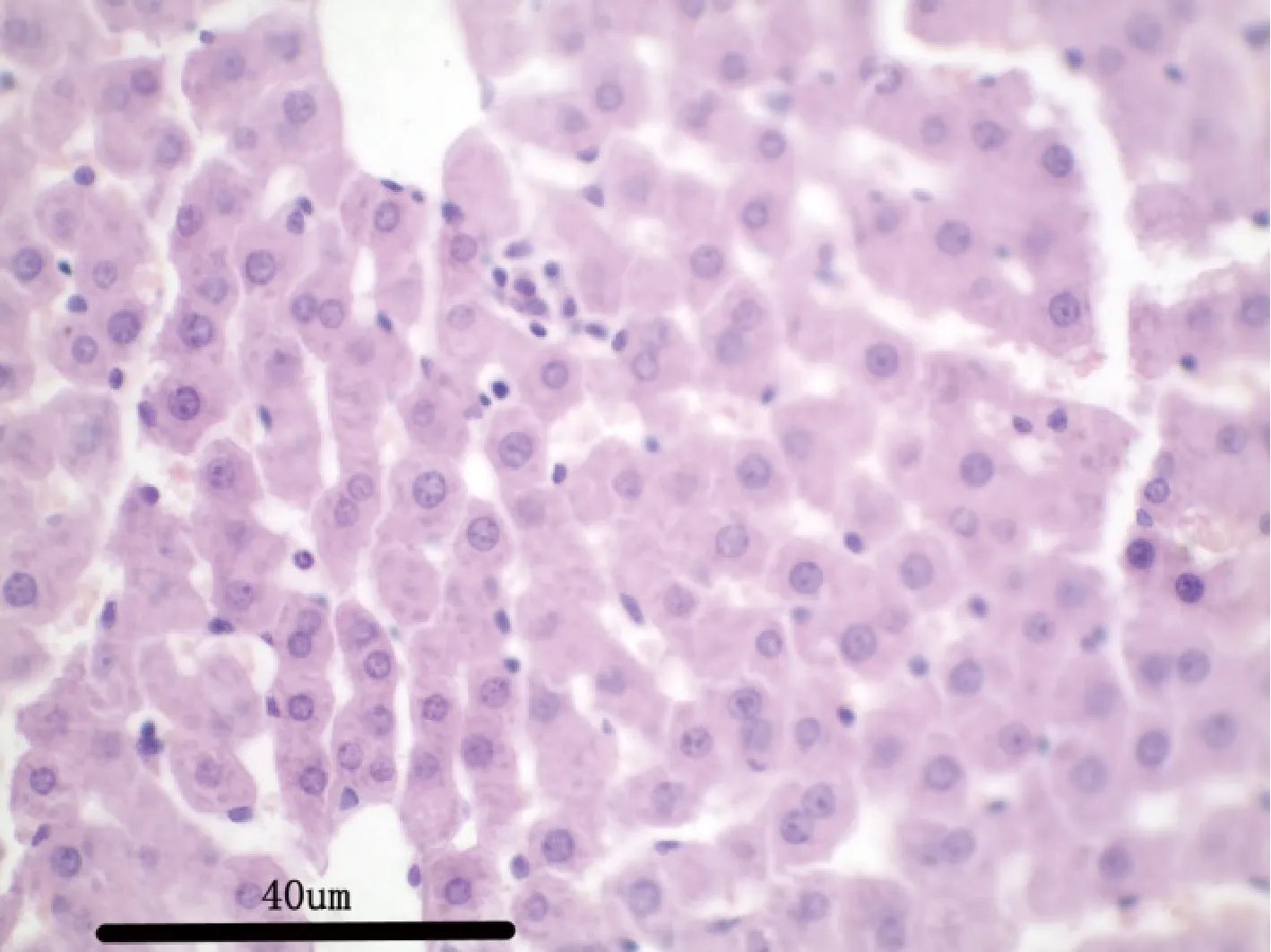
图1 空白对照组大鼠:肝脏H&E 染色,40×Fig 1 Rats in blank control group:Liver H &Estaining,40×
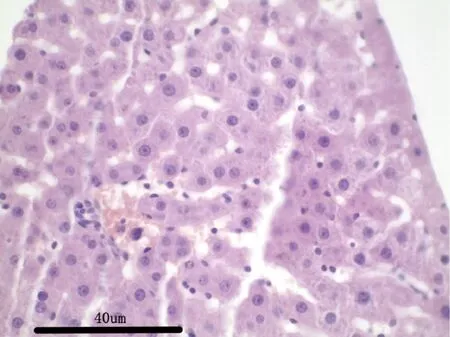
图2 试验高剂量组大鼠:肝脏H&E 染色,40×Fig 2 Rats in the high dose group:Liver H &Estaining,40×

图4 试验高剂量组大鼠:心脏H&E 染色,40×Fig 4 Rats in the high dose group:heart H &Estaining,40×
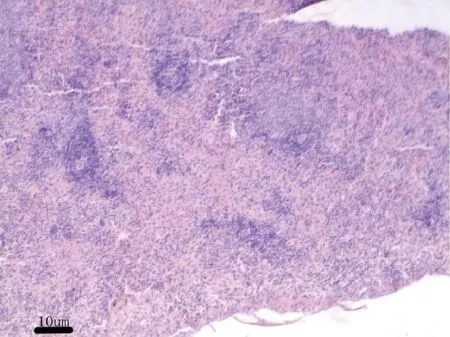
图5 空白对照组大鼠:脾脏H&E 染色,10×Fig 5 Rats in blank control group:spleen H &Estaining,10×
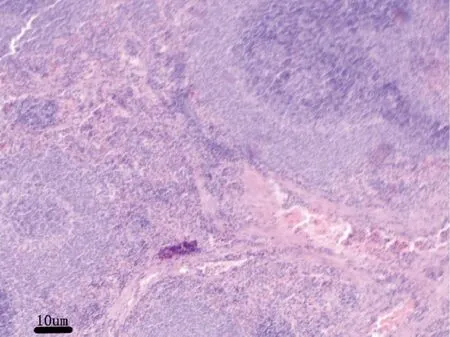
图6 试验高剂量组大鼠:脾脏H&E 染色,10×Fig 6 Rats in the high dose group:spleen H &Estaining,10×
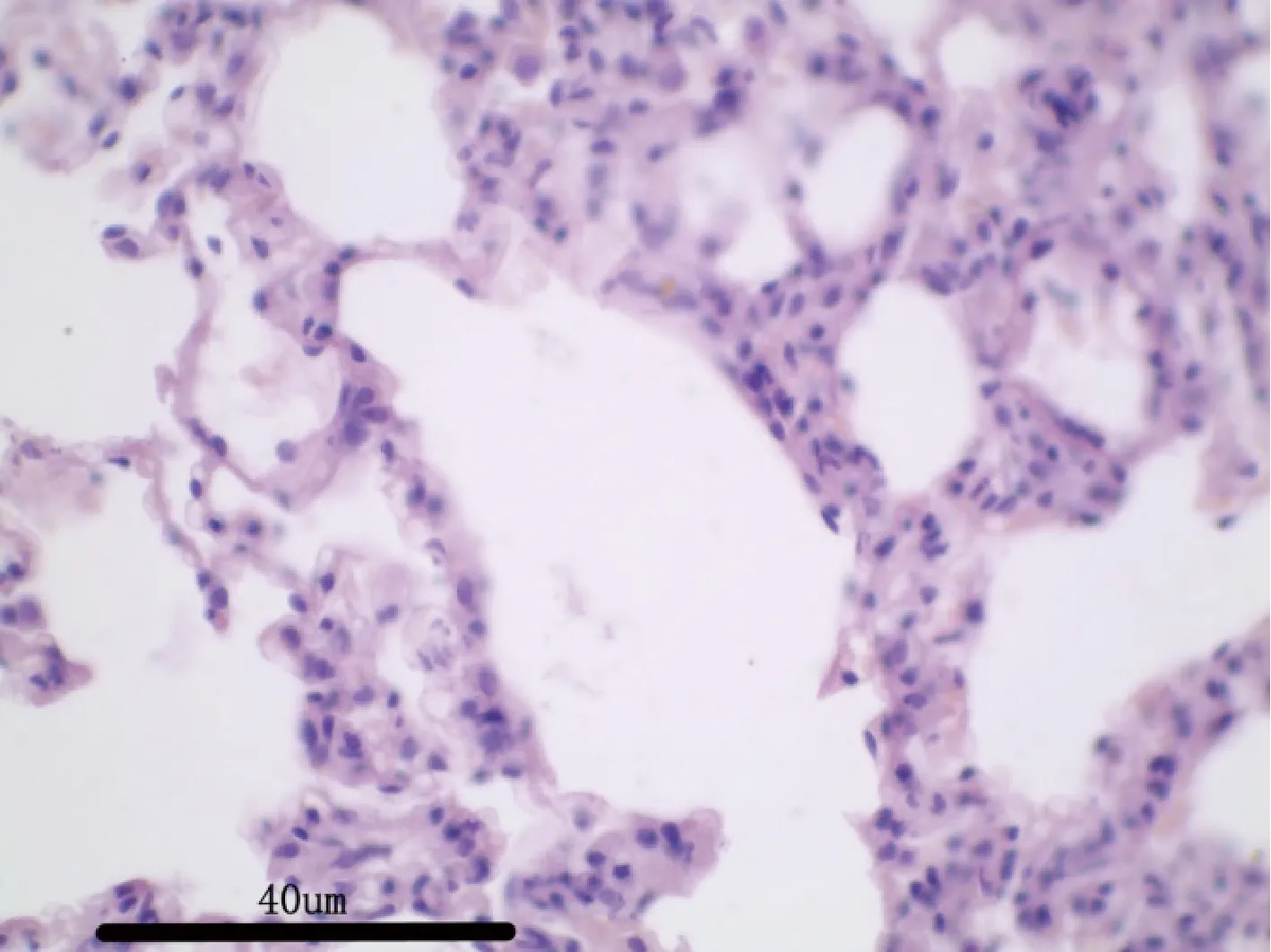
图7 空白对照组大鼠:肺脏H&E 染色,40×Fig 7 Rats in blank control group:lung H &Estaining,40×

图8 试验高剂量组大鼠:肺脏H&E 染色,40×Fig 8 Rats in the high dose group:lung H &Estaining,40×
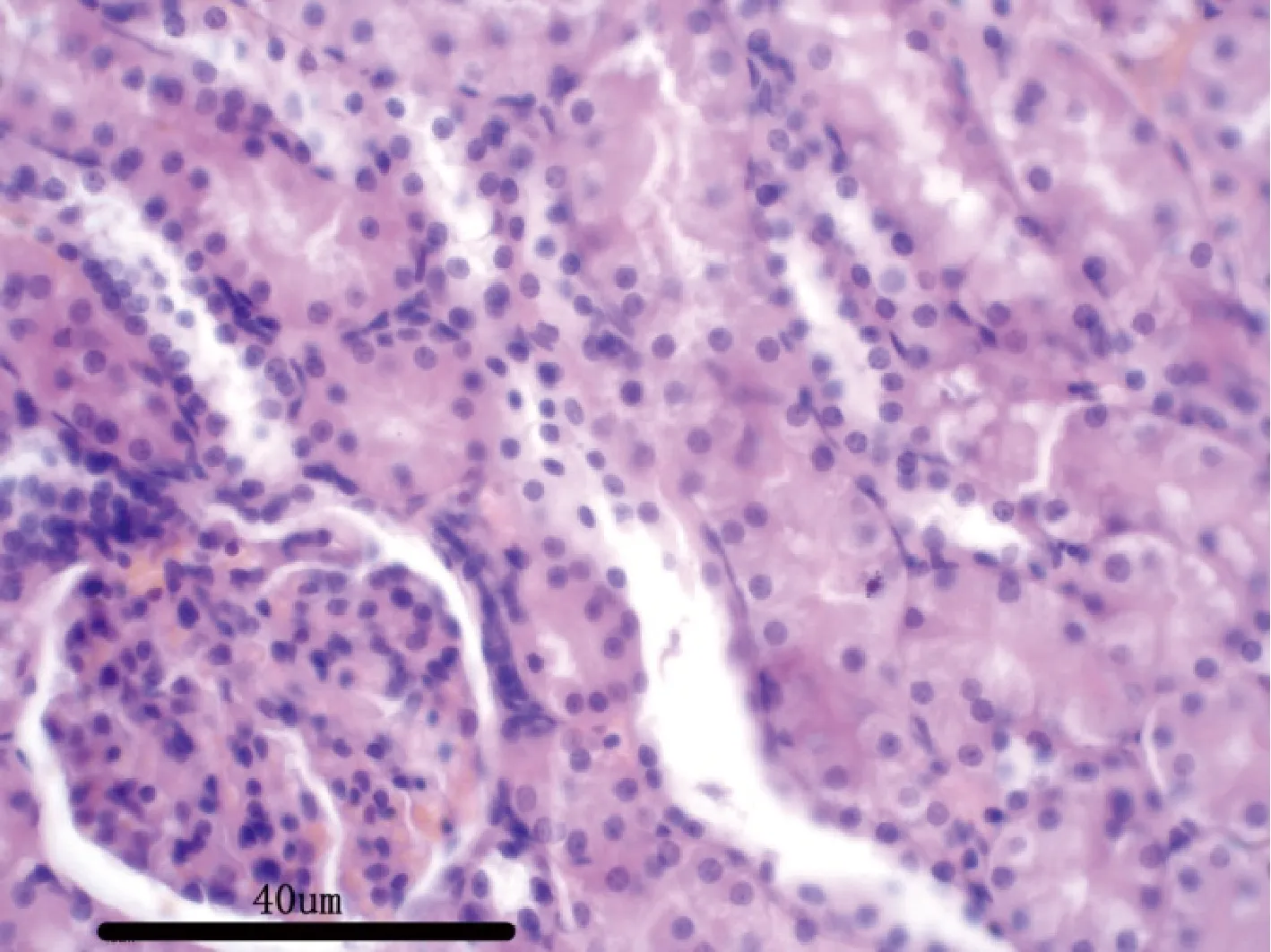
图9 空白对照组大鼠:肾脏H&E 染色,40×Fig 9 Rats in blank control group:kidney H &Estaining,40×

图10 试验高剂量组大鼠:肾脏 H&E 染色,40×Fig 10 Rats in the high dose group:kidney H &Estaining,40×
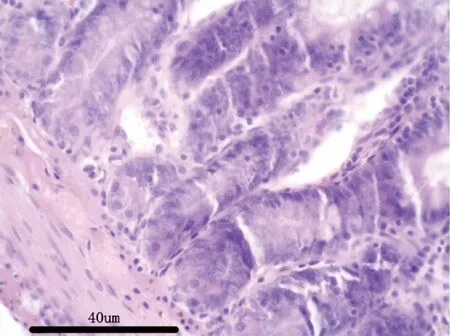
图11 空白对照组大鼠:空肠H&E 染色,40×Fig 11 Rats in blank control group:jejunum H &Estaining,40 ×
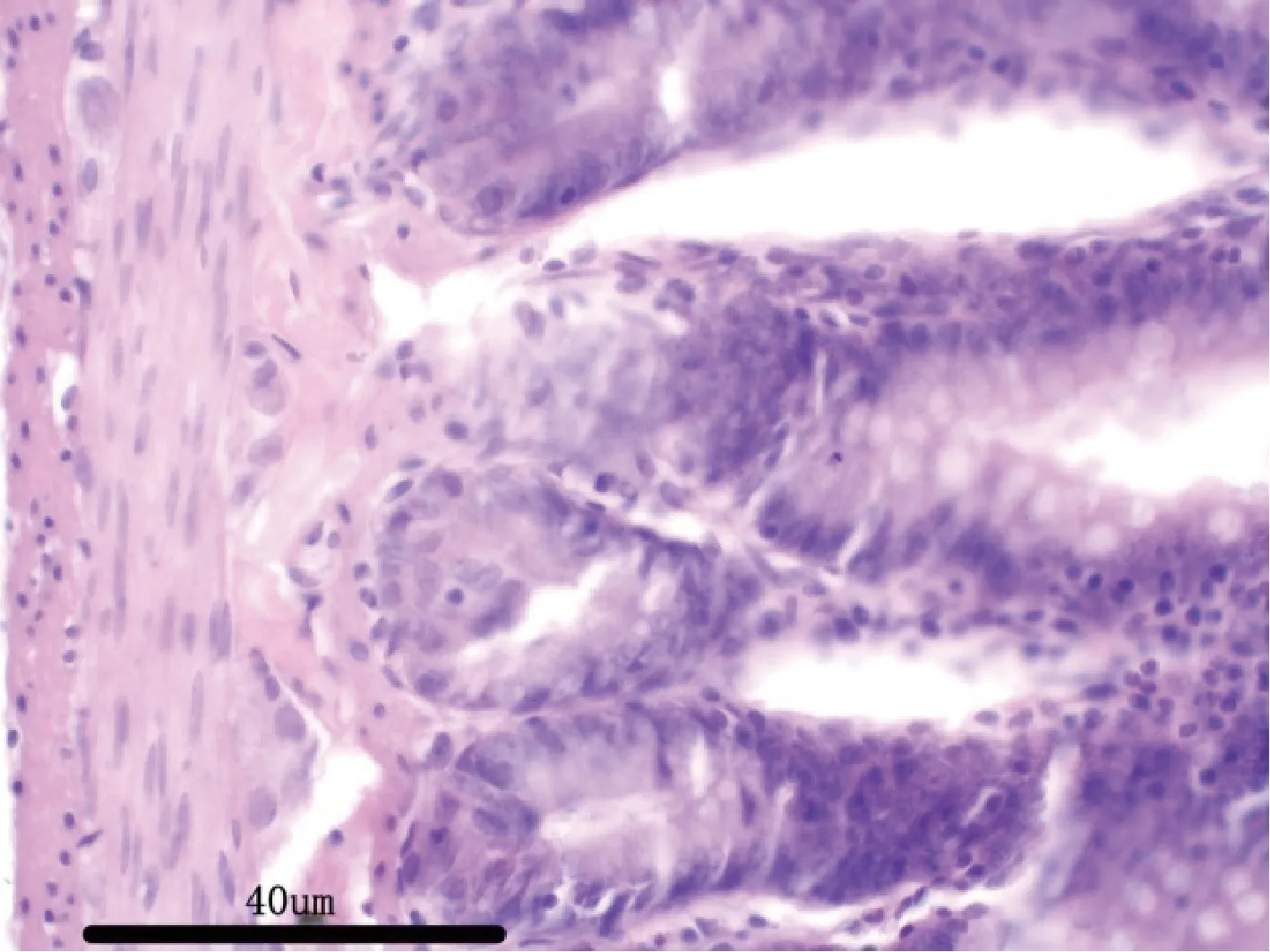
图12 试验高剂量组大鼠:空肠H&E 染色,40×Fig 12 Rats in the high dose group:jejunum H &Estaining,40×

图13 空白对照组大鼠:胃H&E 染色,40×Fig 13 Rats in the blank control group:stomach H &Estaining,40×
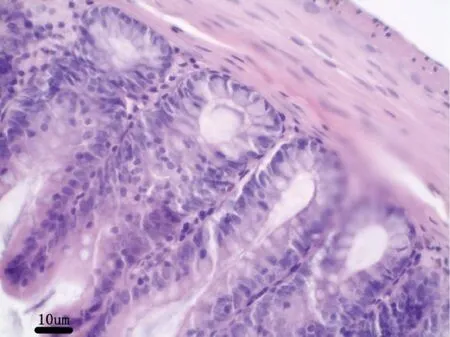
图14 试验高剂量组大鼠:胃H&E 染色,40×Fig 14 Rats in the high dose group:stomach H &Estaining,40×

图15 空白对照组大鼠:卵巢H&E 染色,40×Fig 15 Rats in the blank control group:ovary H &Estaining,40×
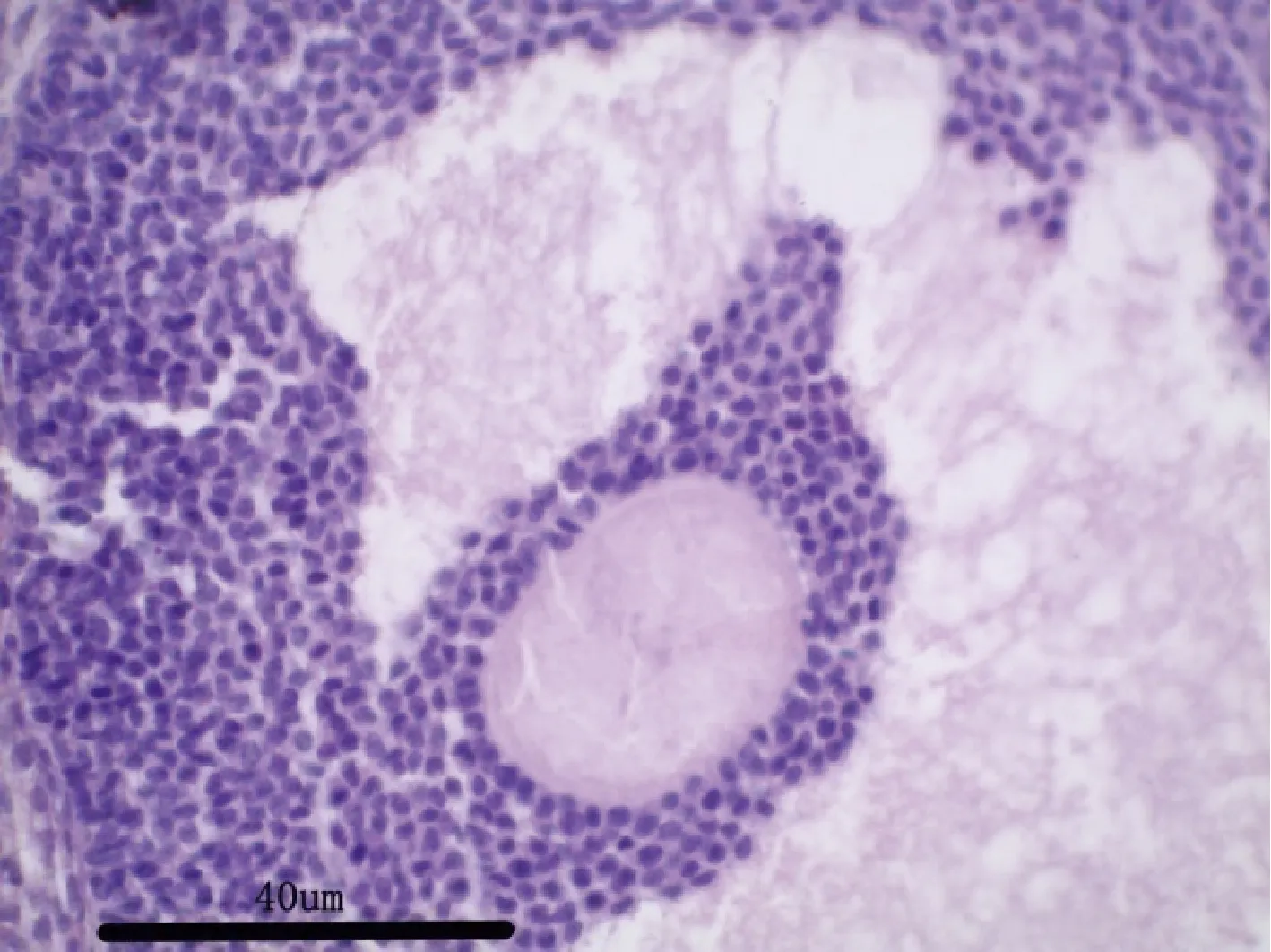
图16 试验高剂量组大鼠:卵巢H&E 染色,40×Fig 16 Rats in the high dose group:ovary H &Estaining,40×

图17 空白对照组大鼠:睾丸H&E 染色,40×Fig 17 Rats in the blank control group:testis H &Estaining,40×
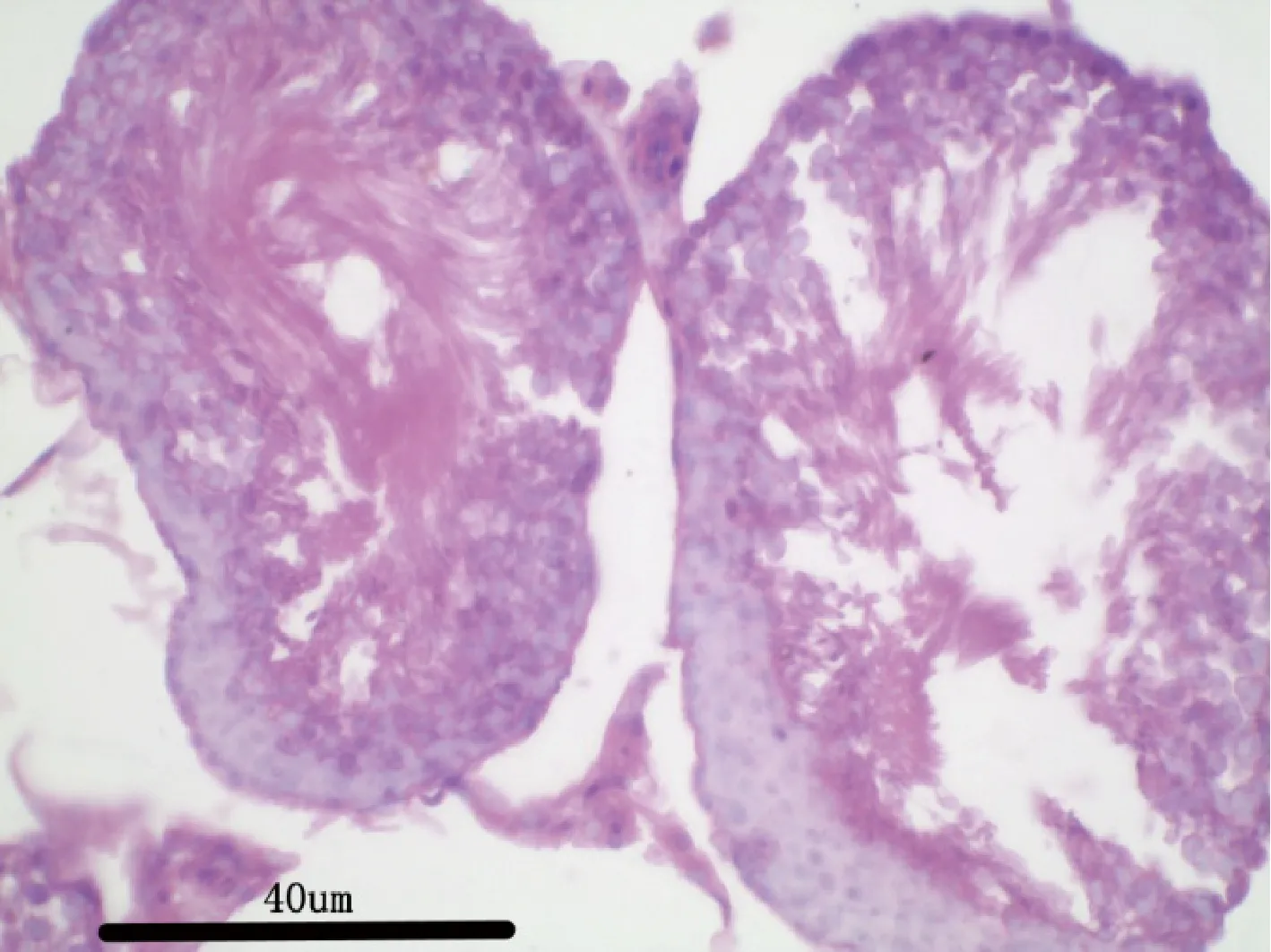
图18 试验高剂量组大鼠:睾丸H&E 染色,40×Fig 18 Rats in the high dose group:testis H &Estaining,40×
4 讨论与结论
4.1 小鼠急性毒性试验 急性毒性试验是对动物进行1次给药或在24 h内进行2 ~ 3次给药,通过观察动物的中毒症状及死亡情况等指标来判断毒性反应的性质和程度,评价药物的毒性大小的试验。
急性毒性预实验以连花柴芩可溶性粉药液的粘滞度能勉强通过小鼠用12号灌胃针头的浓度0.625 g·mL-1为最大给药浓度,以小鼠单次最大灌胃容量20 mL·kg-1计算,灌胃2次,最高剂量组设为25.0 g·kg-1灌服给药仍不引起小鼠死亡。因受小鼠给药容积与药物浓度的限制,无法测定LD50。因此,正式实验条件下,连花柴芩可溶性粉以最大给药浓度对小鼠灌胃给药,给药量达25.0 g·kg-1,小鼠全部存活,未出现明显的急性毒性反应,无法测出LD50,说明口服连花柴芩可溶性粉LD50>25.0 g·kg-1。按照毒理学急性毒性剂量分级表,口服LD50>5000 mg·kg-1时为实际无毒,综上连花柴芩可溶性粉口服给药具有较好的安全性。
4.2 大鼠长期毒性试验 长期毒性试验是通过临床表现、血液学、血清生化、病理组织切片来考察灌胃药物对大鼠持续给药的毒性。在长期毒性实验的摄食量检查结果中,虽然在雌雄动物给药组与对照组出现了统计学差异,但在体重及增重差异比较中,给药组各阶段体重与对照组相比未见显著性差异,认为摄食量的变化没有毒性评价意义;在血液学及血液生化学分析中显示的多种统计学差异,是SD大鼠血液及血液生化学正常标准范围内的变化,因此同样认为没有临床评价意义;在脏器指数检测中,雌性动物药组脾脏相对脏器系数较对照组有增加趋势,但是并没有呈浓度依赖性。在血液生化学及组织病理学检测中未出现相关变化,并且没有浓度依赖性及性别依赖性变化,因此认为此变化与受试物的毒性无相关联系。
毛东有等[15]研究表明,连翘酯苷为连翘主要成分之一,对小鼠腹腔注射的急性毒性试验的LD50为1976.5 mg·kg-1,95%可信限为1863.7~2096.1 mg·kg-1。根据化学物急性毒性(LD50)剂量分级表,连翘酯苷分级为低毒。朱江波等[16]研究表明,连翘酯苷不止对实验动物本身,对胚胎、胎儿和致畸性也均无明显毒性。由此可见,连翘酯苷为连翘的主要成分,连翘作为连花柴芩可溶性粉的主要成分,在以往的实验中证实了其低毒安全的特性。佟继铭等[17]研究了大鼠长期口服黄芩茎叶总黄酮产生的毒性反应及其严重程度,结果,大鼠用药90 d时2.0 g·kg-1总黄酮组大鼠RBC高于羧甲基纤维素钠对照组,停药14 d恢复正常。其它组大鼠的各项指标均无异常改变,也未发现迟发性毒性反应,说明黄芩茎叶总黄酮毒性较低。刘静等[18]研究表明,长时间给予大鼠一定剂量的柴黄口服液,其一般指标、增重及饲料利用、脏器指数、血液学常规、血液生化学检查及组织病理学等方面指标测定结果与对照组无显著差异(P>0.05)。
试验通过将连花柴芩可溶性粉对SD大鼠灌胃30 d重复给药,观察动物出现损害的靶组织或靶器官及剂量效应关系,结果表明,所有检测指标未出现因给予受试物而引起相关的毒性变化,且未发现连花柴芩可溶性粉的目标脏器。通过长期毒性试验观察、血液生理生化指标测定、剖检和病理切片观察,连花柴芩可溶性粉口服给药无毒副作用剂量为25.0 g·kg-1·d-1,表明连花柴芩可溶性粉具有较好的安全性。
通过急性毒性,长期毒性研究,表明连花柴芩可溶性粉口服给药不会对动物机体产生急、慢性毒副作用,具有较好的安全性,为其临床应用提供了参考依据。
