红曲霉对发酵兔肉香肠抗氧化活性及生物胺含量的影响
2020-10-22彭荣蔡琼贺稚非李洪军
彭荣,蔡琼,贺稚非,李洪军*
1(西南大学 食品学院,重庆,400715) 2(重庆工商大学 环境与资源学院,重庆,400067)
兔肉具有“四高四低”的品质特点,“四高”即高蛋白、高赖氨酸、高消化率、高卵磷脂,“四低”指低脂肪、低胆固醇、低热量、低尿酸[1-5]。随着人们营养保健意识的提升,兔肉越来越受到高血压、心脑血管疾病、肥胖症和糖尿病患者的青睐。红曲可有效调节人体血脂,特异性降低低密度脂蛋白、胆固醇以及产生动脉粥样硬化的血清总胆固醇的含量[6-8]。因此利用红曲特殊的营养功能和色泽,生产兔肉发酵香肠,可很好的结合两者的优点。使红曲发酵香肠具有独特的发酵风味,且具有色香浓郁、味道鲜美、易于贮藏等特点[9-12]。
生物胺(biogenic amine)是一类含氮低分子量有机化合物的总称[13],且具有生物活性,是食品新鲜程度和被微生物污染程度的标志,研究食品中生物胺的产生与转化,对改善和提高食品质量和安全性有着重要意义[13-22]。自由基具有高氧化活性,是引起食品中脂质氧化的重要因素,发酵肉制品具有更强的自由基清除能力,将更好的提高其品质。
目前,红曲霉作为发酵剂对发酵兔肉香肠品质影响的相关研究较少,本文通过检测添加和未添加红曲霉的发酵兔肉香肠在不同贮藏温度下理化特性(抗氧化活性、pH、挥发性盐基氮(total volatile basic-nitrogen, TVB-N)、硫代巴比妥酸值(thiobarbituric reactive substances, TBARS))和生物胺含量的变化,比较分析其差异,探究红曲霉对于兔肉发酵香肠品质的影响,旨在为红曲霉在新型兔肉产品生产中的应用提供科学的理论依据。
1 材料与方法
1.1 材料与仪器
兔肉、羊肠衣与台湾风味香肠配料购于重庆四公里永辉超市,猪肥膘购于重庆四公里农贸市场,实验前将其绞碎置于4 ℃冰箱保存。
组胺二盐酸盐、酪胺盐酸盐、尸胺二盐酸盐、腐胺、色胺、2-苯乙胺、丹磺酰氯(分析纯),Adamasg公司;精胺、亚精胺盐酸盐、1,7-庚二胺(分析纯),Acros公司。
安捷伦1260高效液相色谱仪,安捷伦科技有限公司;XZ-3L手摇灌肠机,南宁旭昆机电设备有限公司;TD25-WS离心机,湘仪离心机仪器有限公司;Vortex1旋涡混匀器,德国艾卡公司;DHG-9070A电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司。
1.2 实验方法
1.2.1 工艺流程及香肠配方
工艺流程:原料→修整→剔骨→绞碎混合(兔肉和猪肥膘质量比为5∶1)→腌制(4 ℃添加辅料降低pH到5左右腌制24 h)→灌装(红曲霉发酵组灌装红曲米和肉糜,自然发酵组灌装蒸煮米和肉糜)→发酵(置于30 ℃发酵3 d)→转入不同温度下进行贮藏(4、28、37 ℃)。
红曲发酵组:绞碎的兔肉1.5 kg,绞碎的肥猪肉0.3 kg,经红曲霉发酵2周的蒸煮籼米0.5 kg,香肠辅料154 g,香辛料300 g,100 mg/mL柠檬酸100 mL,将其混合均匀后进行灌装。
自然发酵组: 绞碎的兔肉1.5 kg,绞碎的肥猪肉0.3 kg,未经红曲发酵的蒸煮籼米0.5 kg,香肠辅料154 g,香辛料300 g,100 mg/mL柠檬酸100 mL,将其混合均匀后进行灌装。
1.2.2 理化指标检测
37 ℃组贮藏17 d,28 ℃组贮藏32 d,4 ℃组贮藏53 d,在此期间抽样检测样本数据。
1.2.2.1 红曲霉发酵兔肉香肠的抗氧化活性
1)对香肠采样的前处理
参考文献[23]对方法进行改进:称取3.0 g肉样,研磨成肉泥,加入体积分数为50%乙醇溶液100 mL,60 ℃条件下保温17 h,滤纸2次过滤,得到样品提取液。
2)DPPH自由基清除率的测定
参考文献[24],配制0.135 mmol/L 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)工作液,取2.0 mL提取液,加入2.0 mL DPPH工作液,漩涡混匀,室温下避光静置30 min,于波长525 nm处测定吸光度,参比溶液为纯水。按公式(1)计算DPPH自由基清除率:
(1)
式中:A1,2.0 mL提取液+2.0 mL DPPH工作液吸光度;A2,2.0 mL提取液+2.0 mL无水乙醇吸光度;A0,2.0 mL纯水+2.0 mL DPPH工作液吸光度。
3)羟自由基清除率的测定
向试管中依次加入4mL 9 mmol/L FeSO4溶液,4 mL 9 mmol/L乙醇-水杨酸溶液,接着加入4 mL提取液,最后加入4 mL 8.8 mmol/L H2O2溶液后摇匀,在37 ℃下恒温水浴加热20 min后取出,测其在527 nm处的吸光度。按公式(2)计算羟自由基清除率:
(2)
式中:A1,4.0 mL提取液+4.0 mL FeSO4溶液+4.0 mL水杨酸溶液+4.0 mL H2O2溶液吸光度;A2,未加H2O2显色测得的吸光度;A0,4.0 mL去离子水替代提取液所测得吸光度。
4)超氧阴离子自由基清除能力的测定
取4.5 mL 0.05 mol/L的Tris-HCl缓冲液置于试管中,加入4 mL提取液,空白试验用等量去离子水代替,涡轮混匀后在25 ℃恒温水浴中20 min,取出后同时加入经过25 ℃恒温预热的0.5 mL 0.03 mol/L邻苯三酚溶液,迅速混匀后倒入比色皿中,在波长为325 nm的条件下测定其反应2 min后的吸光度。按公式(3)计算机超氧阴离子自由基清除率:
(3)
式中:A1,4.0 mL提取液+4.5 mL Tris-HCl缓冲液+0.5 mL邻苯三酚溶液吸光度;A2,未加入邻苯三酚测得的吸光度;A0,4.0 mL去离子水替代提取液所测得的吸光度。
1.2.2.2 其他重要理化指标检测
按照GB 5009.237—2016 《食品安全国家标准 食品pH值的测定》测定香肠pH值;按照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》,采用半微量定氮法进行TVB-N测定;按照GB/T 35252—2017 《动植物油脂2-硫代巴比妥酸值的测定》,进行TBARS的测定。
1.2.3 生物胺含量的检测
1.2.3.1 前处理
分别于贮藏后的各个时间段取样分析。称取2.0 g样品于研钵中,加入10 mL 0.4 mol/L高氯酸进行研磨,将其倒入50 mL离心管中,于3 000 r/min离心10 min,上清液移入50 mL棕色容量瓶中。再重复提取1次,上清液合并于容量瓶中,用0.4 mol/L高氯酸溶液定容至刻度。取1.0 mL提取液用于生物胺含量的检测。
1.2.3.2 衍生及检测
色谱条件:梯度洗脱,紫外检测波长254 nm,进样量20 μL,柱温30 ℃,流速1 mL/min,流动相A为超纯水,B为乙腈[25]。梯度洗脱条件见表1。
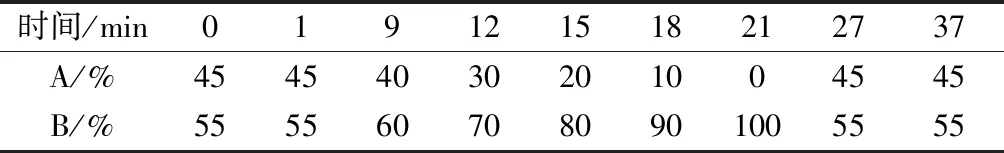
表1 梯度洗脱条件Table 1 Gradient elution conditions
1.2.3.3 色谱图及标准曲线
生物胺混合标品的高效液相色谱(high performance liquid chromatography,HPLC)图如图1所示,以生物胺混合标准溶液做线性实验,结果如表2所示,相关系数R2均大于0.995。

1-色胺;2-苯乙胺;3-腐胺;4-尸胺;5-组胺;6-酪胺;7-亚精胺;8-精胺图1 生物胺混合标品HPLC色谱图Fig.1 HPLC chromatogram for a standard mixture of biogenic amines

表2 八种生物胺回归方程及相关系数Table 2 Regression equations and correlation coefficients of eight biogenic amines
1.3 数据分析
采用Excel 2007进行原始数据处理,运用SPSS 18.0软件对数据进行方差分析,采用Origin 8.0绘图。
2 结果与分析
2.1 红曲霉对兔肉香肠抗氧化活性的影响
2.1.1 DPPH自由基清除率
不同贮藏温度下红曲霉对发酵兔肉香肠DPPH自由基清除率的影响如图2所示。整体上,红曲发酵组的DPPH自由基清除率随时间变化均呈现的波动差异不显著,自然发酵组则在一定范围内有显著波动;在不同的贮藏温度条件下,红曲发酵组的DPPH自由基清除率均高于自然发酵组。赵文红等[26]研究发现,添加红曲有利于提高客家黄酒的DPPH自由基清除能力,红曲的添加量与黄酒的抗氧化活性呈正相关性。这与本研究结果一致,其原因应是ABD RAZAK等[27]发现的经红曲霉发酵的米糠总酚含量增加,引起发酵样品抗氧化活性提升。

a-4 ℃贮藏;b-28 ℃贮藏;c-37 ℃贮藏图2 红曲霉对发酵兔肉香肠DPPH自由基清除率的影响Fig.2 Effect of Monascus on DPPH free radical scavenging activity of fermented rabbit meat sausage
2.1.2 羟自由基清除率
由图3可知,随贮藏时间变化,4 ℃和28 ℃贮藏条件下红曲发酵组和自然发酵组的羟自由基清除率由开始的显著差异逐渐趋于一致,后期无显著性差异;37 ℃贮藏条件下红曲发酵组和自然发酵组整体上都呈显著下降趋势,但组间差异显著,在第17天红曲发酵组的羟自由基清除率降至50.8%,相对下降量为40.5%;自然发酵组降至16.5%,相对下降量为63.6%。综上可知,在较高贮藏温度下,红曲发酵组相较于自然发酵组对羟自由基的清除效果更好。刘燕等[28]研究发现经红曲发酵的燕麦多糖比未发酵的燕麦多糖羟基自由基清除率提高了20.64%,也验证了红曲发酵使产物有更高的抗氧化活性。

a-4 ℃贮藏;b-28 ℃贮藏;c-37 ℃贮藏图3 红曲霉对发酵兔肉香肠羟自由基清除率的影响Fig.3 Effect of Monascus on hydroxyl free radical scavenging activity of fermented rabbit meat sausage
2.1.3 超氧阴离子自由基清除率
从图4可知,在前发酵期间,2组的超氧阴离子自由基清除率都有明显提高。在进入不同温度贮藏后,红曲发酵组和自然发酵组的清除率均在一定范围内波动,组内变化不显著,较为稳定,但组间均存在一定差异。可以推断,样品对超氧阴离子自由基的清除能力与温度变化并无太大关系,也不随发酵进程的推进而明显减弱;但红曲发酵组的超氧阴离子自由基清除能力显著高于自然发酵组。
宋云刚[29]研究发现香菇红曲黄酒对超氧阴离子自由基清除能力是一般黄酒的4倍,但并未研究单独添加红曲的影响。该研究在一定程度上与本研究结果类似。其机理应与KULLISAAR等[30]研究发现的乳酸菌抗氧化酶系统具有较强的超氧化物歧化酶活性及TALWALKAR等[31]研究发现的超氧化物歧化酶对超氧阴离子自由基的清除作用相同,但还待后期研究验证。
2.2 红曲霉对兔肉香肠pH的影响
由图5可知,在发酵及贮藏初期,红曲发酵组的pH值低于自然发酵组。这是由于红曲霉喜酸性环境,故在制作红曲米时通过加入柠檬酸进行pH调节。不同贮藏温度下,红曲发酵组和自然发酵组的pH值均随着发酵和贮藏时间降低,自然发酵组中37 ℃下降幅度最大,17 d内从5.81迅速降至4.21,相对降低量达27.5%;红曲发酵组中37 ℃下降最多,17 d从5.28降至4.68,相对降低量为11.4%。自然发酵组的pH下降程度高于红曲发酵组,自然发酵组产品酸化明显,而红曲发酵组产品的pH值降幅相对较小,变化趋势更加趋于稳定。由此推测,红曲对于发酵香肠的过度酸化具有一定抑制作用,有助于维持香肠品质的稳定。高士昌等[32]研究发现在宰后肉中肌糖原酵解和ATP分解,导致乳酸和磷酸的含量增加,pH将下降。李燚[33]研究发现在火腿肠中添加红曲霉菌丝体能抑制细菌生长和pH的下降趋势,其机理应是红曲霉具有的蛋白酶分解产生的碱性含氮物平衡了pH的进一步降低,WANANGKARN等[34]研究支持了这种推断。
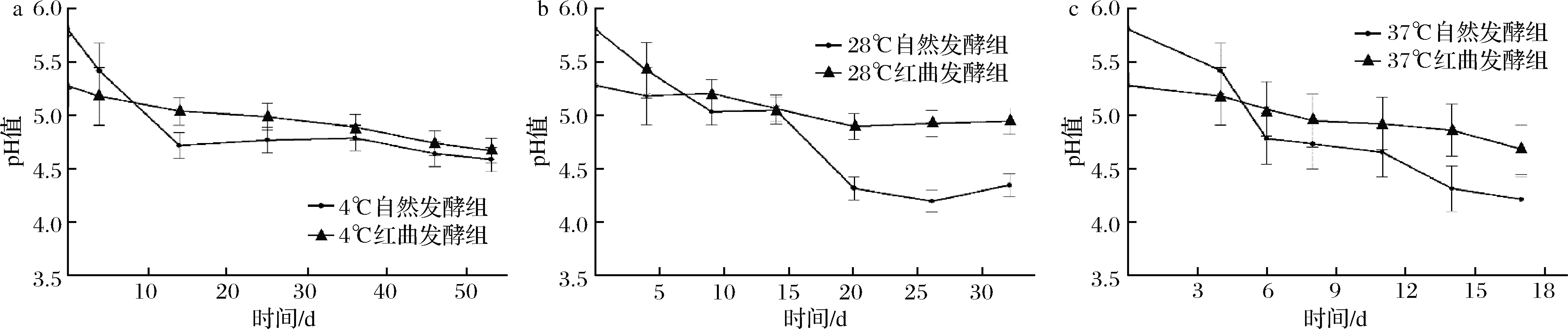
a-4 ℃贮藏;b-28 ℃贮藏;c-37 ℃贮藏图5 红曲霉对发酵兔肉香肠pH的影响Fig.5 Effect of Monascus on pH of fermented rabbit meat sausage
2.3 红曲霉对兔肉香肠TVB-N的影响
由图6可知,随贮藏时间2组香肠的TVB-N值均呈明显的上升趋势,红曲发酵组的初始TVB-N值高于自然发酵组。王中帅[35]研究证实,红曲本身具有一定的TVB-N值,这也可能导致添加红曲的香肠TVB-N初始值较高。但在进入不同温度贮藏后,自然发酵组的TVB-N值上升速度明显高于红曲发酵组,且贮藏温度越高,上升越快,在37 ℃贮藏条件下,红曲发酵组的TVB-N值由5.78 mg/100 g增加到45.4 mg/100 g,增加量为39.62 mg/100 g;自然发酵组由0.42 mg/100 g 增加到53.6 mg/100 g,增加量为53.19 mg/100 g。这说明,在贮藏过程中,自然发酵组香肠的腐败速度是快于红曲发酵组的。翟钰佳等[36]研究发现不同的贮藏时间和温度对发酵香肠的TVB-N值有显著影响,低温贮藏更有利于保持香肠的品质和安全性,其研究的乳酸菌羊肉发酵香肠在4 ℃下贮藏4周后的TVB-N值达到21.88 mg/100 g,而本研究的红曲发酵组在4 ℃下贮藏53 d后的TVB-N值为15.13 mg/100 g,因此推断红曲霉在抑制发酵香肠腐败,维持其品质方面具有一定作用。
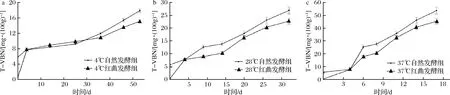
a-4 ℃贮藏;b-28 ℃贮藏;c-37 ℃贮藏图6 红曲霉对发酵兔肉香肠TVB-N的影响Fig.6 Effect of Monascus on TVB-N of fermented rabbit meat sausage
2.4 红曲霉对兔肉香肠TBARS值的影响
由图7可知,红曲发酵组和自然发酵组的TBARS值均随贮藏时间呈上升趋势,在发酵前期0~4 d,红曲发酵组的TBARS值高于自然发酵组,分析原因可能是在灌装香肠时,发酵红曲米和新蒸煮米间存在氧化时间差异,故在发酵初期红曲发酵组的脂肪氧化值略高于自然发酵组。在进入不同温度贮藏和后发酵期后,4 ℃和28 ℃贮藏条件下,自然发酵组的上升幅度明显高于红曲发酵组,37 ℃贮藏条件下2组的差异不显著。杜宝等[37]研究发现不同发酵剂对发酵香肠TBARS值有抑制作用,且贮藏温度越低,脂质氧化程度越小,这与本研究结果一致,红曲霉作为发酵剂对于抑制兔肉香肠脂类氧化有一定的作用。ZHANG等[38]研究发现脂肪氧合酶酶活力越高,TBARS值越低,红曲霉是否具有较高脂肪氧合酶还需后期验证。

a-4 ℃贮藏;b-28 ℃贮藏;c-37 ℃贮藏图7 红曲霉对发酵兔肉香肠TBARS的影响Fig.7 Effect of Monascus on TBARS of fermented rabbit meat sausage
2.5 红曲霉对兔肉香肠中生物胺含量的影响
对不同贮藏温度下红曲发酵兔肉香肠组和自然发酵兔肉香肠组的生物胺进行HPLC检测分析,检测结果如表3、表4和表5所示。
37 ℃贮藏17 d后,红曲发酵组中生物胺的含量均未超过国家标准,而自然发酵组中腐胺、尸胺、酪胺在贮藏11 d后含量超过美国食品药品管理局(Food and Drug Administration,FDA)食品中含量<100 mg/kg的规定[39],而组胺在贮藏14 d后也急速上升,17天后超过FDA食品中组胺含量<50 mg/kg的规定[40],含量达到144.43 mg/kg。与鱼肉的生物胺含量组成比例有所不同,徐杰等[41]研究了凡纳滨对虾在0和4 ℃贮藏时生物胺的变化,得出在2种贮藏温度下尸胺和腐胺的变化均最显著,可以作为评价新鲜程度的参考指标。兔肉香肠的生物胺比例中,腐胺含量最高,其次是尸胺,因此可以优先将这2种生物胺作为评价发酵兔肉香肠新鲜程度的参考标准。

表3 37 ℃下兔肉香肠贮藏过程中生物胺含量变化 单位:mg/kg
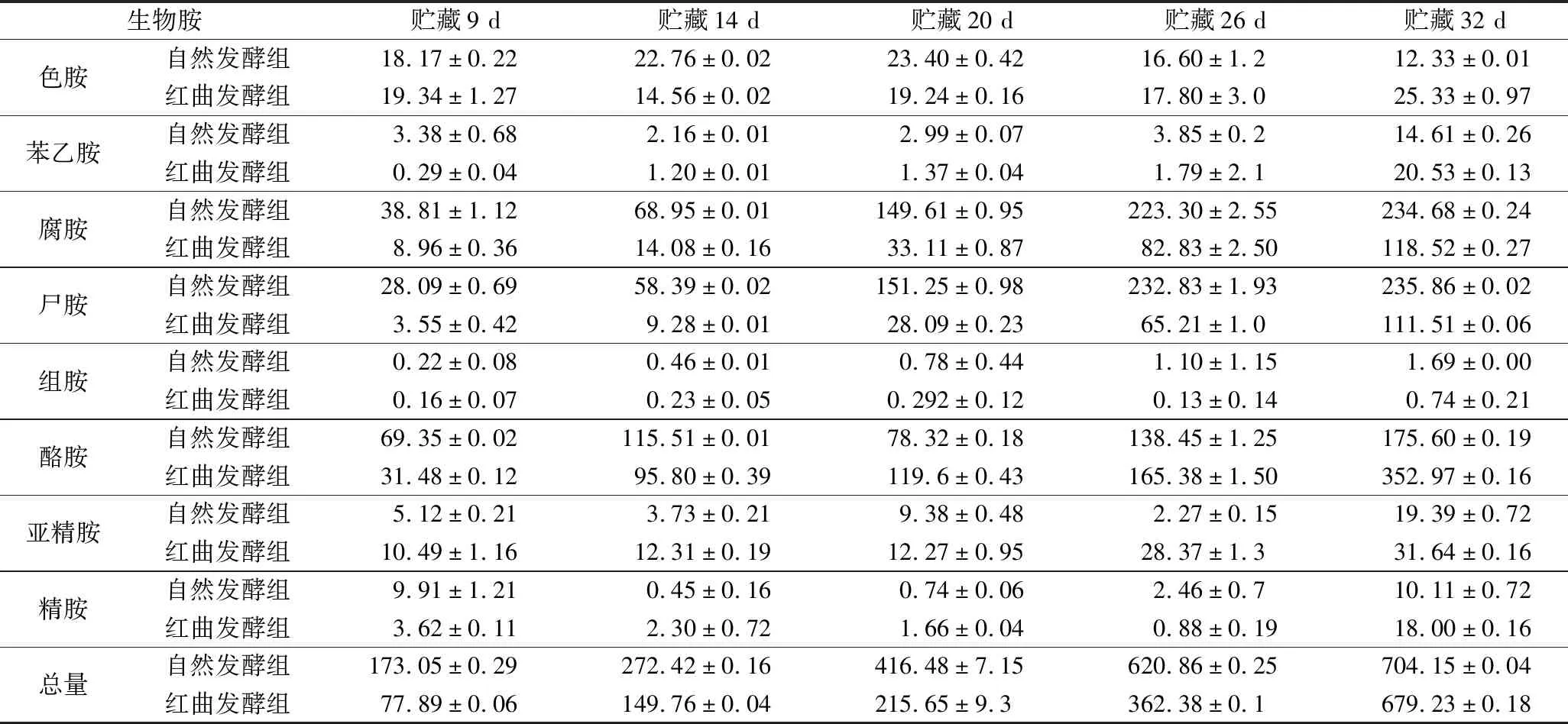
表4 28 ℃下兔肉香肠贮藏过程中生物胺含量变化 单位:mg/kg
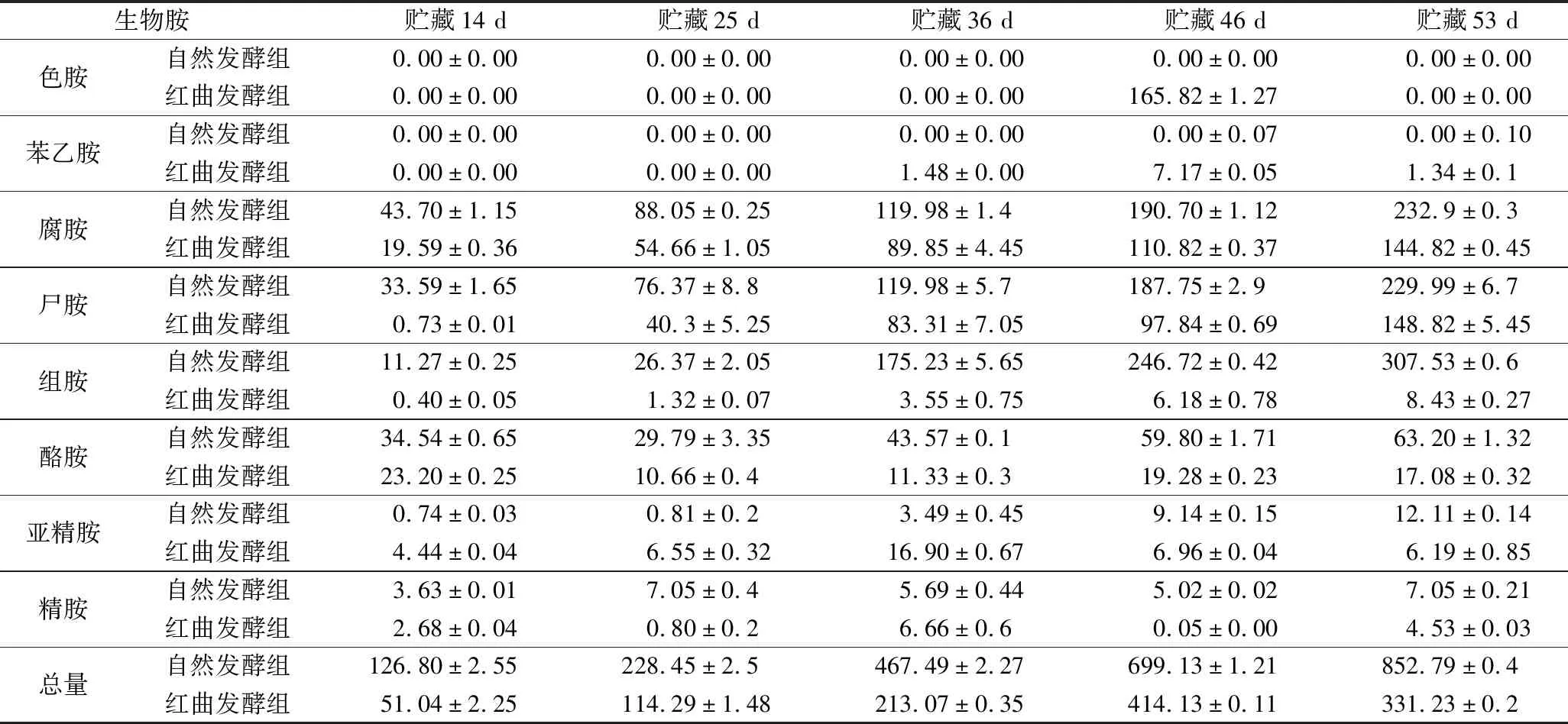
表5 4 ℃下兔肉香肠贮藏过程中生物胺含量变化 单位:mg/kg
28 ℃贮藏20 d后,自然发酵组中腐胺、尸胺含量均超过规定,而红曲发酵组中腐胺、尸胺含量在32 d才超过规定,但2组中的酪胺含量均在第20天超过规定。CHIN等[42]指出25 ℃下肉杆菌产生的酪胺远高于15 ℃下的产胺量,这也可能是兔肉香肠出现这种情况的原因。
4 ℃贮藏36 d后,自然发酵组中腐胺、尸胺、组胺超过规定,而红曲发酵组中腐胺在46 d,尸胺在53 d超过规定。有研究表明4 ℃下低温贮藏的肉由于嗜冷假单胞菌的存在也容易产生大量腐胺[43]。
结果表明,红曲霉发酵对生物胺生成有一定抑制作用,其原因应是红曲霉发酵的代谢产物抑制了其他有害微生物的生长,阻止了兔肉蛋白的降解;贮藏过程中经红曲霉发酵的兔肉香肠生物胺总量明显低于自然发酵的兔肉香肠。翟钰佳等[44]以植物乳杆菌为发酵剂也显著抑制了羊肉发酵香肠生物胺的形成,这与本研究结果相似。
对不同贮藏温度下的2组香肠在贮藏第14天进行了同步检测,选取了总生物胺进行了比较分析。由图8可知,37 ℃贮藏自然发酵组的生物胺总量达到492.96 mg/kg,而28和4 ℃贮藏自然发酵组的总量分别为272.42和126.80 mg/kg;37 ℃贮藏红曲发酵组的总量为140.73 mg/kg,均低于不同贮藏温度自然发酵组的含量,而28和4 ℃贮藏红曲发酵组的总量为149.76和51.04 mg/kg。确定红曲霉和贮藏温度对发酵兔肉香肠生物胺含量均有显著性影响,而且红曲发酵组内的差异明显小于自然发酵组。
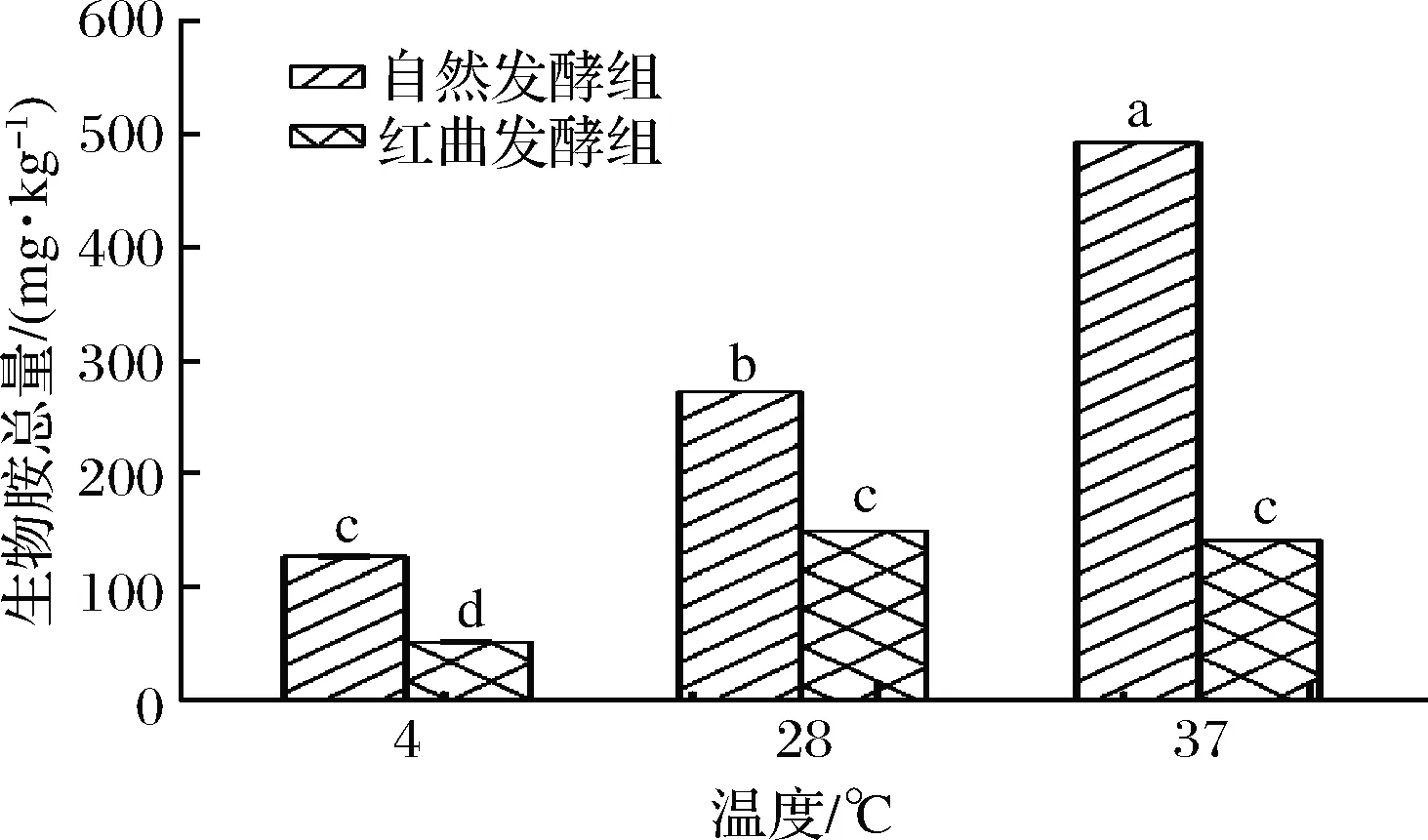
图8 贮藏第14天红曲霉和贮藏温度对生物胺含量的影响Fig.8 Effects of Monascus and storage temperatures on biogenic amine content during 14 days of storage
对不同贮藏温度下发酵兔肉香肠进行了横向对比,选择香肠生物胺最高的单项腐胺的含量作为对比标准。由图9可知,37 ℃贮藏自然发酵组在第11天超过100 mg/kg的限度,达到131.33 mg/kg,红曲发酵组在17 d还没超过限度,达到39.59 mg/kg;28 ℃贮藏自然发酵组在贮藏20 d后达到149.61 mg/kg,红曲发酵组在32 d超过限度,达到118.51 mg/kg;4 ℃贮藏自然发酵组在贮藏36 d超过限度,达到119.98 mg/kg,红曲发酵组在46 d超过限度,达到110.82 mg/kg。结果表明降低贮藏温度能有效提升兔肉发酵香肠的贮藏期,且同一贮藏温度下红曲发酵组和自然发酵组间的腐胺值差异显著。
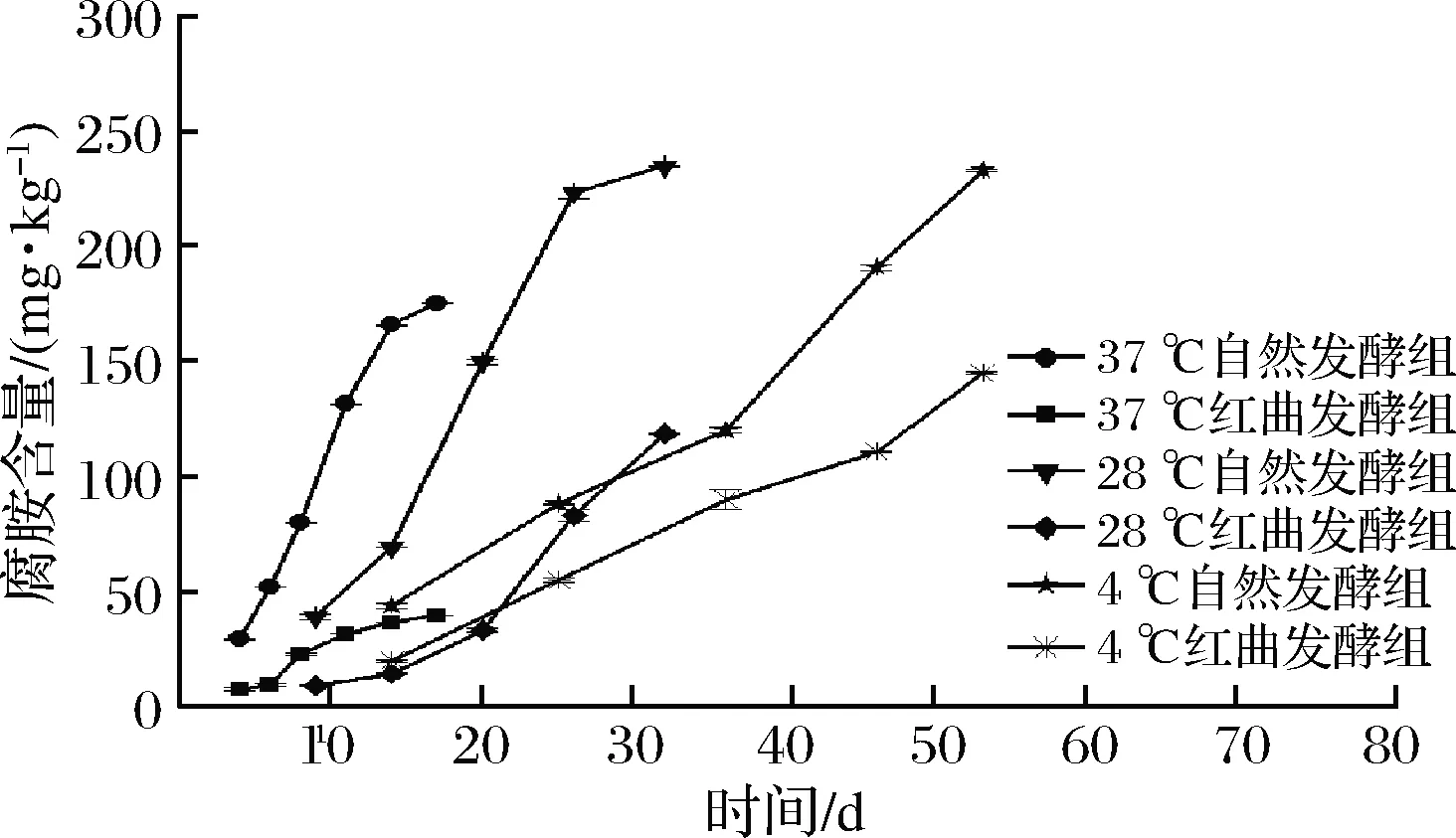
图9 红曲霉及贮藏温度对腐胺含量的影响Fig.9 Effect of Monascus and storage temperature on putrescine content
3 结论
1)红曲霉作为发酵剂,可以显著提高发酵香肠抗氧化能力。3种温度下自由基清除率的最大值出现在不同时期,这几项指标的变化也不具有同步性。随贮藏时间的变化,在pH方面,红曲发酵组和自然发酵组的pH值均呈现下降的趋势,但红曲发酵组的曲线相对平缓,pH下降幅度相较自然发酵组更小,更具稳定性;在TVB-N值上,2组的TVB-N值均随时间变化而逐渐升高,但红曲发酵组的TVB-N值的增幅比自然发酵组的值低;在TBARS方面,由于香肠配料比的问题,红曲发酵组在前期的TBARS值高于自然发酵组,在进入贮藏后,自然发酵组脂质氧化速度高于红曲发酵组,红曲发酵组TBARS值的增幅较自然发酵组低。
2)不同贮藏温度下,自然发酵组和红曲发酵组的生物胺含量都随着贮藏时间的推移而逐渐增高,但自然发酵组的生物胺含量增速明显高于红曲发酵组,腐胺和尸胺较组胺更适合作为兔肉肠品质的评价标准;同一贮藏时间对比和达到同一生物胺含量限度所需的时间对比均表明红曲霉和贮藏温度对发酵兔肉香肠的贮藏期有显著影响。
总体而言,实验结果均表明不同贮藏条件下,红曲发酵的兔肉香肠在抗氧化活性上和抑制生物胺生成上优于自然发酵兔肉香肠,而生物胺含量和理化指标的变化在一定程度上可以客观反映发酵兔肉香肠的品质变化,为深入研究红曲霉发酵兔肉香肠提供了参考和数据支持。
