发酵乳杆菌LBM97所产细菌素提取方法的优化及比较
2020-10-22顾雅昕乔柱郭行王欣伊扬磊单媛媛刘变芳周元吕欣
顾雅昕,乔柱,郭行,王欣,伊扬磊,单媛媛,刘变芳,周元,吕欣
(西北农林科技大学 食品科学与工程学院,陕西 杨凌,712100)
乳酸菌细菌素是由乳酸菌通过核糖体合成对同种细菌(窄谱)或跨属细菌(广谱)有活性的抗菌肽[1],因其具有安全、无毒和降解无残留等特点,部分乳酸菌细菌素已作为食品保鲜剂[2-4]应用于食品工业,并且有潜力作为抗生素替代物[5-6]应用于医药行业。但细菌素由于产量低、提取复杂和生产成本高等因素制约其商业化应用[7],近年来,大多数提高细菌素产量的研究集中在优化培养条件上[8],而对细菌素提取方法的选择少有报道。
粗提取是细菌素研究的基础工作,常见的提取方法有(NH4)2SO4沉淀法、有机溶剂抽提法、双水相萃取法、pH吸附解吸法、蒸发浓缩法、膜分离法和喷雾干燥法等[9-11]。其中(NH4)2SO4沉淀法是目前应用最广泛的粗提细菌素方法;有机溶剂抽提法也是常用的提取方式之一,对亲脂性蛋白和小分子蛋白有较好的提取效果,根据细菌素的特性可选择极性不同的有机溶剂,本文选择极性适中的乙酸乙酯,在不确定细菌素的性质时较为适用,此外,联用旋转蒸发的方式能有效去除萃取剂和挥发性有机酸,为细菌素样品排除部分干扰;除上述2种常用方法外,pH吸附解吸法,又称菌体吸附法,利用革兰氏阳性菌在pH环境改变时对周边蛋白质吸附能力变化的原理获取细菌素,通常认为细菌在pH 6时对蛋白质的吸附能力最强,在pH 2时吸附能力最弱[12],因细菌素不仅存在于发酵液中,还存在于细菌自身周围,这种方法可以防止在获取发酵上清液时对细菌周围细菌素的损失。对于pediocin PA-1[13]、sakacin C2[14]和pentocin MQ1[15]等已知性质的细菌素来说,在进行批量化生产时,可根据其类别[16]和理化性质选择合适的粗提取方法,从而减少损失和杂质干扰,提高得率;对于未知性质的细菌素来说,细菌素的挖掘成果和产量(指单种细菌素的产量或多种细菌素的混合总产量)是衡量提取效率的重要指标。以本课题组研究的面包乳杆菌MN047为例,经多肽组学法检测可产生10多种细菌素[17],但传统的分离纯化方式仅能得到1种[18]。随着Leuconostocpseudomesenteroides607[19]、CarnobacteriummaltaromaticumC2[20]和LactobacillussakeiD98[21]等可产生不止1种细菌素的菌株陆续被发现,考虑某些细菌素可能因含量少或其他原因在纯化过程中被筛除,因此选择合适的提取方法对提高细菌素产量和后续研究至关重要。
课题组的前期研究中分离到1株可同时抑制革兰氏阳性菌和革兰氏阴性菌的乳杆菌LBM97,经16S rDNA鉴定为发酵乳杆菌(Lactobacillusfermentum)。本文分别使用(NH4)2SO4沉淀法、乙酸乙酯抽提法和pH吸附解吸法对L.fermentumLBM97进行细菌素提取,优化3种方法的提取条件,并对各方法获得的细菌素样品进行比较与评价,选择合适的提取方法和条件,以期为提高细菌素得率和全面挖掘L.fermentumLBM97所产细菌素提供基础。
1 材料与方法
1.1 菌株与培养基
L.fermentumLBM97分离自陕西省汉中市西乡县浆水;指示菌金黄色葡萄球菌(Staphylococcusaureus) ATCC25923和大肠杆菌(Escherichiacoli) ATCC25922获赠于食品科学与工程杨保伟教授实验室。
MRS培养基(g/L):葡萄糖2,蛋白胨1,牛肉膏1,酵母浸粉0.5,醋酸钠0.5,柠檬酸氢二铵0.2,K2HPO40.2,吐温-80 0.1,MgSO40.02,MnSO40.005。
LB培养基(g/L):NaCl 1,胰蛋白胨1,酵母浸粉0.5。
1.2 仪器与设备
DRP-9082恒温培养箱,上海森信实验仪器有限责任公司;ST 16R高速冷冻离心,美国Thermo Fisher Scientific公司;SENCO-R旋转蒸发器,上海申生有限公司;IS128实验室pH计,上海仪迈仪器科技有限公司;LGJ-10C真空冷冻干燥机,北京四环科技仪器厂有限公司;JY04S-3C凝胶成像仪,北京君意东方电泳设备有限公司;Victor X3多功能酶标仪,珀金埃尔默仪器(上海)有限公司。
1.3 实验方法
1.3.1L.fermentumLBM97的培养时间
过夜培养的L.fermentumLBM97按照体积分数0.05%的接种量接种于MRS液体培养基中,37 ℃条件下分别培养48、60和72 h,6 000 r/min离心10 min保留上清液,取200 μL各样品进行抑菌试验,使用改良的牛津杯双层琼脂扩散法[22]测定各条件下细菌素粗样的抑菌效果,下层为质量浓度20 g/L的琼脂,上层为质量浓度8 g/L的LB琼脂培养基,指示菌为S.aureus和E.coli,培养12 h后观察结果。使用凝胶成像仪采集图片、AutoCAD 2018测量抑菌圈直径;使用考马斯亮蓝G-250法和酶标仪测定各样品中的蛋白质含量,2项指标测定每个样品重复3次。
1.3.2 三种方法提取细菌素及优化
按照1.3.1小节的方法得到发酵液后,分别使用(NH4)2SO4沉淀法、乙酸乙酯抽提法和pH吸附解吸法提取100 mL发酵液中的细菌素。
(NH4)2SO4沉淀法:6 000 r/min离心10 min保留上清液,分次加入充分烘干研磨的(NH4)2SO4细粉末,使溶液中(NH4)2SO4的溶解度分别达到60%、70%、80%、90%和100%。待完全溶解后放入4 ℃冰箱过夜充分沉淀,12 000 r/min离心15 min收集沉淀,用蒸馏水溶解沉淀并定容至2 mL,测定粗品蛋白质含量并取200 μL进行抑菌试验。
乙酸乙酯抽提法:6 000 r/min离心10 min保留上清液,以乙酸乙酯与发酵液体积比1∶5、2∶5、3∶5、4∶5、5∶5、6∶5和7∶5进行萃取,使用旋转蒸发器对萃取后的乙酸乙酯进行蒸发浓缩,待容器内液体完全蒸干后,用蒸馏水溶解沉淀并定容至2 mL,测定粗品蛋白质含量并取60 μL进行抑菌试验(加样量为200 μL时,抑菌圈过大不易测量,为使样品平行于同一指示菌平板上,故以60 μL为加样量,pH吸附解吸法亦同)。
pH吸附解吸法:优化过程采用3组单因素试验进行。70 ℃水浴加热30 min,以杀死菌体和钝化酶活力。(1)吸附pH的优化:用5 mol/L NaOH溶液调节菌悬液至pH 5.5~7.0(吸附),4 ℃静置90 min,离心(6 000 r/min、20 min、4 ℃)保留菌体。用相同pH的5 mmol/L 磷酸缓冲盐溶液洗涤菌体2次,将菌体溶于0.1 mol/L 柠檬酸中,再用1 mol/L 柠檬酸调至适宜的pH 2.0(解吸),随后立即离心去除菌体。将上清液用0.2 mol/L的NaHPO4溶液调节pH至4.0,进行冻干浓缩,最终用pH 6.0的磷酸缓冲盐溶液将各粗样定容至2 mL,测定粗品蛋白质含量并取60 μL进行抑菌试验。(2)解吸pH的优化:吸附pH采用已优化的吸附pH,解吸pH为1.6~2.1,其余步骤同上。
1.3.3 细菌素的抑菌性比较
以各方法中的最优条件制备细菌素样品,使用牛津杯琼脂扩散法进行抑菌试验,加样量为60 μL。记录抑菌圈直径并观察指示菌在培养12、24和36 h时的变化情况。
1.4 数据分析

2 结果与分析
2.1 培养时间的确定
乳酸菌通常在培养16~20 h进入生长稳定期[23-25],在此时期可产生大量细菌素、有机酸和H2O2等代谢产物。为充分获取此时期所产的细菌素,将菌株发酵至48、60和72 h进行抑菌性测定。结果表明,L.fermentumLBM97对革兰氏阴性菌和革兰氏阳性菌的抑制效果不同,对革兰氏阳性菌的抑菌界线较清晰但抑菌直径小于革兰氏阴性菌(图1)。在不同培养时间下对2种指示菌的抑菌效果无显著差异,邓肯多重比较数据显示在培养60 h时,对2种指示菌均表现出较好的抑菌效力,对S.aureus和E.coli的平均抑菌直径分别为14.00和16.40 mm,因此以60 h作为后续试验的培养时间。
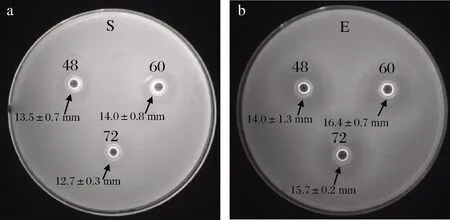
a-S.aureus;b-E.coli图1 各培养时间下发酵上清液对指示菌的抑制效果Fig.1 Antimicrobial activity of fermentation supernatant on indicator with different culturing time 注:S和E分别表示指示菌类型(下同);48、60和72分别表示培养时间
2.2 三种提取方法的优化结果
(NH4)2SO4沉淀法提取的蛋白质样品中,25 ℃下(NH4)2SO4溶解度为80%时具有最高的蛋白质质量浓度(4 804.70 μg/mL)和对2种指示菌最强的抑菌活性,对S.aureus和E.coli的平均抑菌直径分别为13.67和15.20 mm(图2),略低于发酵上清液的抑菌性,考虑到发酵上清液中还存在有机酸等其他抑菌物质,因此结果仍具有参考价值。
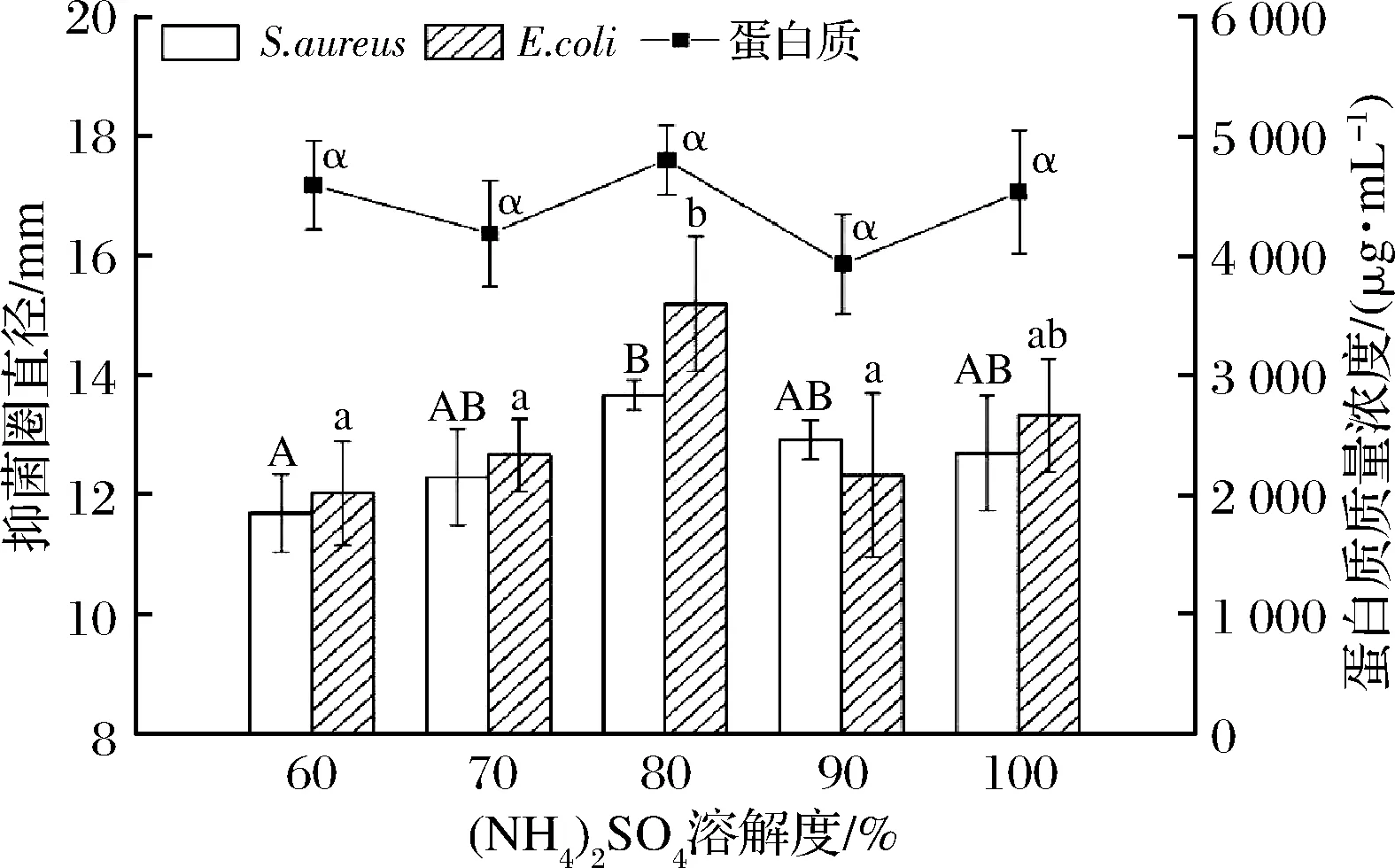
图2 各(NH4)2SO4溶解度下样品的抑菌圈直径和蛋白质含量Fig.2 Diameters of inhibition zone and protein concentrations of specimens under different solubilities of ammonium sulfate 注:同类字母(ABCD/abcd/αβχδ)用于描述同一指标,含不同 字母表示有显著差异;相同字母表示无显著差异(下同)
乙酸乙酯抽提法中,提取的样品蛋白质含量随乙酸乙酯所占体积比的增加而增加。在乙酸乙酯和发酵上清液体积比(以下简称体积比)为1∶5、2∶5和3∶5时,两相易发生乳化现象,样品中存在蛋白质却无抑菌性;在体积比为4∶5时,样品出现抑菌性,并随体积比的增加而增大,在体积比为7∶5时,对S.aureus和E.coli的平均抑菌直径分别为17.00和17.27 mm,蛋白质质量浓度为396.35 μg/mL,表现出最好的抑菌性和最高的蛋白质含量(图3)。此时的样品对2种指示菌的抑菌效果与其他样品均有显著差异。
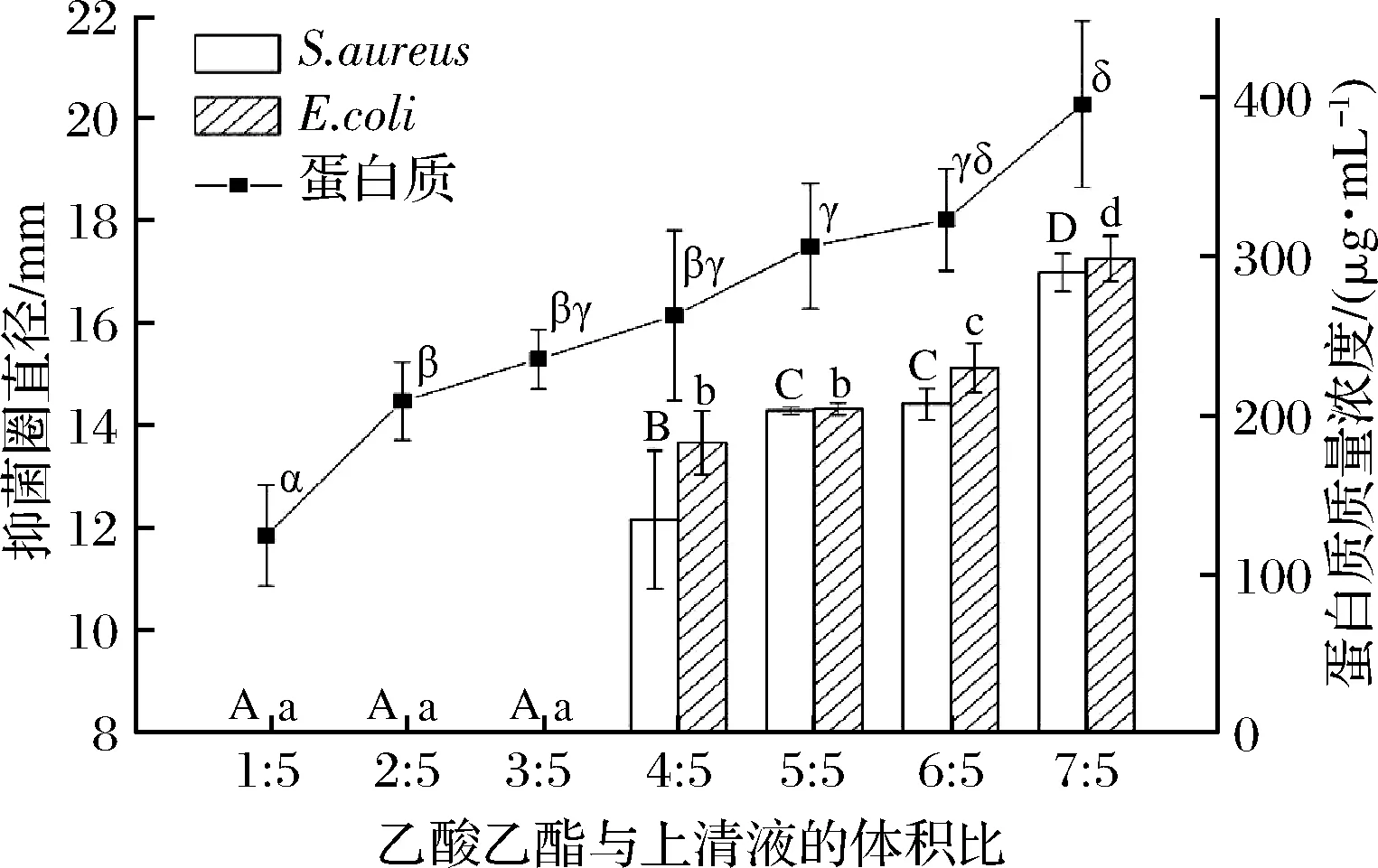
图3 乙酸乙酯与发酵上清液的不同体积比的样品抑菌 圈直径和蛋白质含量Fig.3 Diameters of inhibition zone and protein concentrations of specimens under different volume ratios of ethyl acetate and fermented supernatant
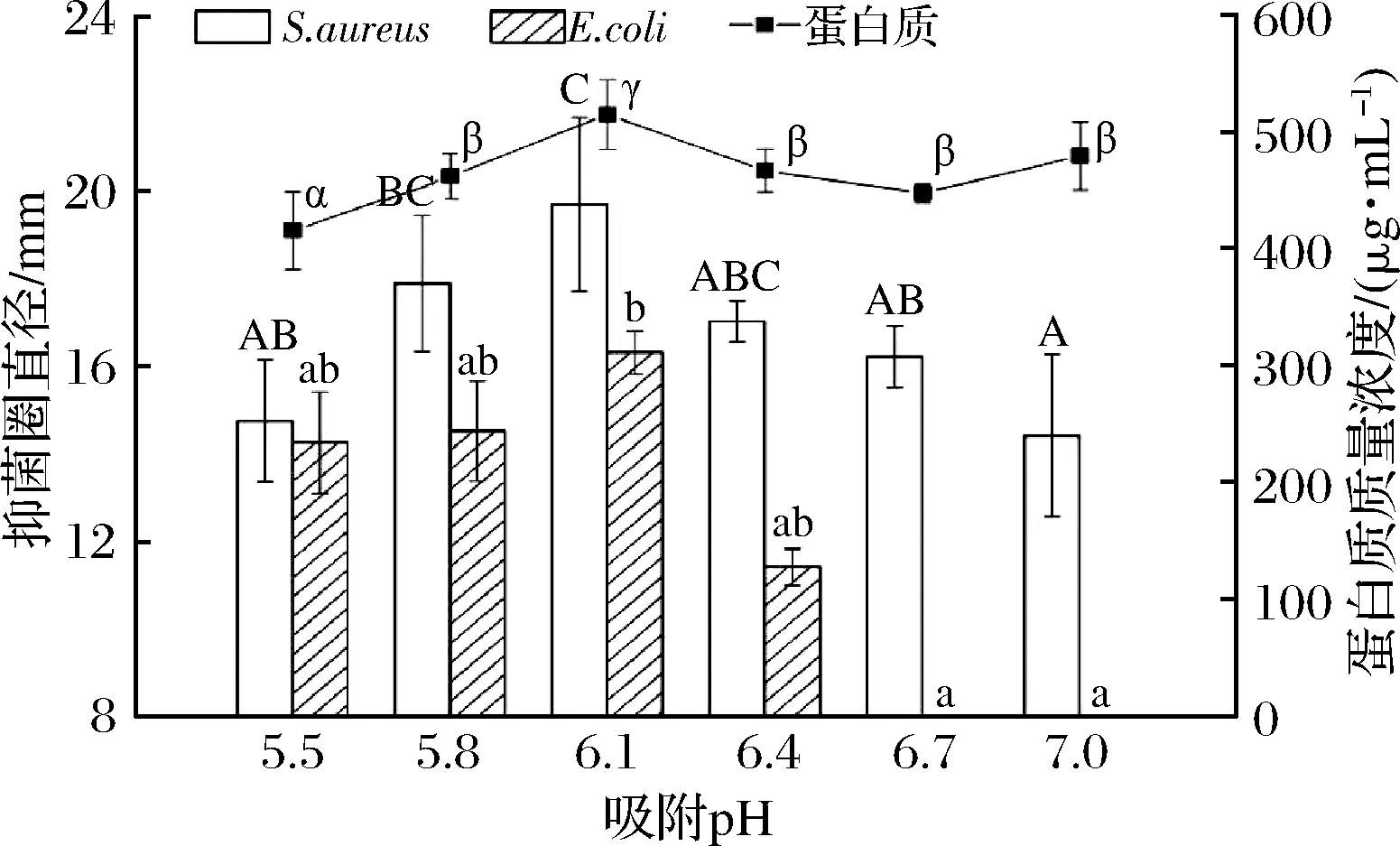
图4 各吸附pH条件下样品的抑菌圈直径和蛋白质含量Fig.4 Diameters of inhibition zone and protein concentrations of specimens under different adsorption pH
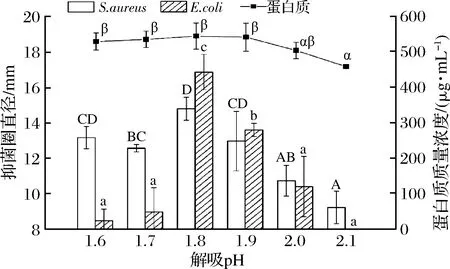
图5 各解吸pH条件下样品的抑菌圈直径和蛋白质含量Fig.5 Diameters of inhibition zone and protein concentrations of specimens under different desorption pH
pH吸附解吸法可见在2组优化试验的抑菌效果和蛋白质含量大致趋势为先增后降。优化吸附pH时,吸附pH 6.1、解吸pH 2.0的条件下具有最佳抑菌效果和最高的蛋白质含量,对S.aureus和E.coli的抑菌圈直径分别为19.70和16.33 mm,蛋白质质量浓度为514.76 μg/mL;优化解吸pH时,以pH 6.1为吸附pH,测得解吸pH 1.8时具有最佳抑菌效果和最高的蛋白质含量,对S.aureus和E.coli的抑菌圈直径分别为16.33和16.87 mm,蛋白质质量浓度为543.96 μg/mL。解吸pH优化后蛋白质含量提高,抑菌圈直径无明显变化或减小的原因可能与琼脂板的厚度和保存时间差异有关[26]。
2.3 三种提取方法的比较
以指示菌不生长区域为强抑菌圈,以指示菌浓度明显低于正常生长浓度区域为弱抑菌圈。S.aureus和E.coli在培养12 h后(图6-a和图6-b),(NH4)2SO4沉淀法得到的细菌素粗品对2种指示菌均无抑制作用,这与对比试验的加样量有关;pH吸附解吸法提取的蛋白质样品对S.aureus有较小的强抑菌圈和较大的弱抑菌圈,而对E.coli仅有较弱的抑菌圈;乙酸乙酯抽提的蛋白质样品对S.aureus表现出较大的强抑菌圈和较小的弱抑菌圈,对E.coli仅有弱抑菌圈。在培养24 h时观察到各抑菌圈逐渐缩小(图未列出)。在培养36 h后(图6-c和图6-d),pH吸附解吸法提取的蛋白质样品所表现出的弱抑菌圈基本消失,对S.aureus的强抑菌圈无明显变化;乙酸乙酯抽提出的蛋白质样品对S.aureus的抑菌圈逐渐缩小,边缘也变得模糊不清,对E.coli仍有一定的抑菌效果,但也明显降低。可见3种方式得到的样品成分存在差异。
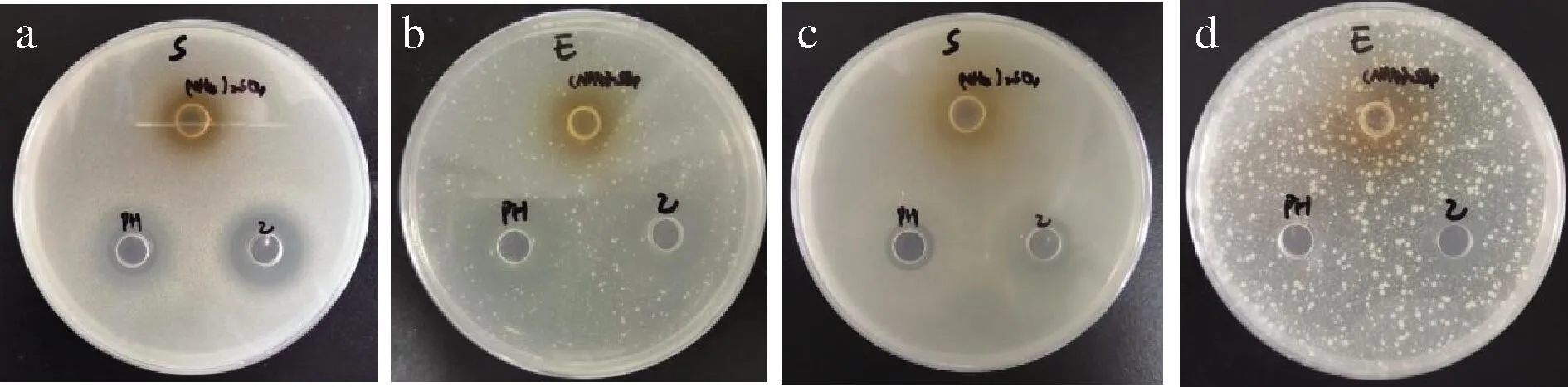
图6 三种方法提取的细菌素样品的抑菌效果比较Fig.6 Antimicrobial activity of bacteriocins isolated using 3 methods 注:第一排为(NH4)2SO4沉淀样品、第二排左孔为pH吸附解吸 样品、第二排右孔为乙酸乙酯抽提样品
菌株的生存环境和功能影响着细菌素的产生和性质,运用不同的提取方法往往有较大的差异。其中(NH4)2SO4沉淀法的操作方式简单易行,并能提取出最多的蛋白质,蛋白质含量约是另外2种方法的8~15倍,但抑菌效果明显偏低,推测是(NH4)2SO4对上清液中的蛋白质不具选择性,导致大量杂蛋白析出。并且此方法在提取过程中会沉淀大量色素,影响后续纯化。乙酸乙酯抽提法并不是提取蛋白质的专用方法,虽然应用于L.fermentumLBM97效果较显著,但样品抑菌性会随着指示菌的培养时间增加而逐渐失效,可能是细菌素的稳定性低或样品中的其他抑菌物质消耗导致的。此外,乙酸乙酯具有刺激性气味和低毒性,且本试验中未找到其抽提峰值,若继续增加用量可能伴随试剂的浪费和人体的损伤。pH吸附解吸法试验周期略长,在本试验中的平均抑菌直径也略低于乙酸乙酯抽提法得到的细菌素样品,但优化试验的最佳条件明显,提取到的细菌素稳定性高,在指示菌培养36 h时仍保持良好的抑菌效果,蛋白质含量也较高。比较3种提取方法的原理差异,分析此方法提取到的细菌素大概率被细菌分泌后保留于菌体周围,而不是分泌到环境中,因此增强了细菌素溶液的抑菌性。
目前研究多是通过优化培养基来提高细菌素产量,选择合适的提取方法对于提高细菌素产量、提升细菌素活性也是至关重要的。ZIMINA等[27]使用(NH4)2SO4、活性炭和氯仿作为提取剂提取沙福芽孢杆菌B-12180和短小芽孢杆菌B-12182所产的细菌素,发现在培养18 h后通过(NH4)2SO4沉淀法得到的细菌素样品具有较好的抑菌活性,抑菌直径分别为14~18 mm和10~11 mm。许亦峰等[28]的研究表明,通过(NH4)2SO4沉淀和酸沉淀2种方法对枯草芽孢杆菌FB123细菌素进行粗提,酸沉淀法得到的样品比活力约为(NH4)2SO4沉淀法的1.5倍。DUNDAR等[29]的研究中提到,对比(NH4)2SO4沉淀法和pH吸附解吸法对粪肠球菌W3细菌素的提取,发现2种方法均能提出目的蛋白,pH吸附解吸法得到的样品活性为原上清液活性的16%,约是(NH4)2SO4沉淀法的4倍。可见不同菌种发酵液中细菌素的适宜提取方法存在差异,这可能与细菌种属以及存在环境的差异有关[30],也可能与细菌素本身理化性质例如等电点、亲疏水性的差异有关。
3 结论
本文采用(NH4)2SO4沉淀法、乙酸乙酯抽提法和pH吸附解吸法提取L.fermentumLBM97发酵60 h的发酵液中的细菌素并优化提取条件,对比研究发现pH吸附解吸法提取效果较好,因未能将所有细菌素的提取方法逐一比较,所以仅能从试验中的3种方法得出pH吸附解吸法为粗提L.fermentumLBM97细菌素的适宜方法,在吸附pH 6.1、解吸pH 1.8条件下具有较好的抑菌效果和较高的蛋白质含量。在考虑样品间细菌素存在差异的情况下,将于后期使用肽酶法或组学法对各样品进行深入研究,以期全面获取L.fermentumLBM97所产细菌素。本文为L.fermentumLBM97细菌素的后续鉴定、理化性质和作用机制的研究提供原料与数据基础,为研究者对细菌素提取方法的选择提供参考。
