AP1S1基因在乳腺癌中的表达与临床意义
2020-10-13单本杰沈国栋沈夏波胡世莲潘跃银
刘 宇,单本杰,沈国栋,沈夏波,胡世莲,潘跃银
乳腺癌是全球女性最常见的恶性肿瘤之一,也是导致肿瘤死亡的主要原因。近年来的技术进步使得乳腺癌患者的生存期延长[1]。然而乳腺癌具有高度遗传异质性特征,某些类型的乳腺癌细胞具有高度侵袭转移性[2],且容易复发,造成患者术后缓解若干年仍可死于远处转移。因此,如何早期预测患者预后仍然是急需解决的难题。
衔接因子相关蛋白复合体1,σ1 亚基 (AP-1 complex subunit sigma-1A,AP1S1)是属于接头蛋白复合体1(adaptor protein complex 1,AP-1)受体分子上的一种连接蛋白,在高尔基体中参与蛋白质分选[3]。AP1S1在皮肤和脊髓发育中的关键作用,目前已知与AP1S1相关的疾病包括智力障碍、肠病、耳聋、周围神经病、角化病和小矮星综合征等疾病[4]。AP1S1在肿瘤领域研究较少,尤其与乳腺癌发生发展是否有关还未见报道,该研究旨在探讨AP1S1基因表达与乳腺癌患者预后的相关性。
1 材料与方法
1.1 临床样本按照安徽医科大学附属省立医院医学研究伦理委员会批准方案,收集2005~2016年在本院甲乳外科行乳腺癌根治术或改良根治术并且病理诊断明确的蜡块标本组织110例。所有病例都是经安徽医科大学附属省立医院病理科专业医师诊断,临床分期是根据美国癌症联合委员会(AJCC)癌症分期手册第7分类标准。
1.2 细胞株与试剂人乳腺癌细胞株MDA-MB-231与SKBR3购自中国医学科学院肿瘤研究所。胎牛血清(FBS)购自美国Clark公司;RPMI1640培养基购自美国Corning公司;胰酶消化液、TRIzol试剂购自上海生工生物科技有限公司;抗AP1S1抗体购自上海Invitrogen公司;总RNA抽提试剂盒购自德国Analytik Jena公司;siRNA、逆转录反应试剂盒及荧光定量PCR(qPCR)试剂盒购自上海吉玛生物科技有限公司;CCK-8试剂盒购自日本同仁公司。
1.3 方法
1.3.1生物信息学分析 利用在线数据处理软件GEPIA(http://gepia.cancer-pku.cn/)[5]与UALCAN(http://ualcan.path.uab.edu)[6]分析美国TCGA(the cancer genome atlas)数据库中AP1S1在乳腺癌组与正常对照组的表达水平,并且通过Kaplan-Meier生存分析、Log-Rank检验AP1S1表达水平与患者总体生存期(overall survival,OS)和无病生存期(disease free survival,DFS)的相关性。
1.3.2细胞培养 MDA-MB-231和SKBR3乳腺癌细胞株培养于含10% FBS 的RPMI1640培养基,置于37 ℃、5% CO2饱和湿度条件下培养。
1.3.3质粒转染 转染前24 h,接种适当数量的细胞至细胞培养板中,每孔中加入不含抗生素的培养基,使转染时的细胞密度能够达到30%~50%。按产品说明书配置siRNA-lipo2000混合液,将siRNA-lipo2000混合液加入含有细胞的400 μl培养基的培养孔中,轻轻混匀;培养4~6 h后,将孔中含siRNA-lipo2000混合液的培养基移去,更换新鲜培养基;将培养板置于37 ℃的CO2培养箱中培养24~96 h;效果检测:转染完成后24~72 h均可进行siRNA沉默效果检测,最佳检测时间与细胞类型、转染试剂、检测目的等相关。RNA水平的检测:mRNA是检测siRNA沉默效率的最佳指标,siRNA转染后24~72 h即可检测到靶基因mRNA表达降低,检测方法宜采用qPCR检测方法。
1.3.4免疫组化 将石蜡包埋的病例标本连续切片后按免疫组化流程常规操作,使用抗AP1S1抗体(稀释比例1 ∶1 000)在4 ℃孵育过夜;洗涤后使用适当的HRP标记二抗孵育1 h,使用DAB溶液着色,最后用苏木精复染。组织染色强度采用0、1、2、3计数,分别代表不存在、弱、中、强;分布评分采用阳性染色百分比<5%得分为0, 5%~25%得分为1,25%~<50%得分为2,≥50%得分为3;将强度和分布得分的总和用于确定表达水平,分数1或0表示低表达,分数≥2表示高表达。
1.3.5荧光定量PCR 采用TRIzol提取组织和细胞中的总RNA,将RNA反转成cDNA,然后PCR扩增,扩增的参数设置如下:95 ℃、8 min预变性;95 ℃、10 s,65 ℃、18 s,72 ℃、16 s,共40个循环,U6作为内参。引物如下:AP1S1(F:5′-GGAGCTGATCC ACCGATACG-3′,R:5′-CCTCTTGCAGTAGGTCAGC C-3′)、U6(F:5′-CTCGCTTCGGCAGCACA-3′;R:5′-AACGCTTCACGAATTTGCGT-3′)。
1.3.6Western blot实验 配胶和上样电泳:根据配方配制分离胶,待分离胶凝倒掉ddH2O后,用滤纸条吸干水分。样品上样:蛋白样品临上样前高速离心,上样时取上清液。80 V电压跑浓缩胶,120 V跑分离胶。转膜:准备滤纸10张和PVDF膜1张;配transfer buffer (5 ml 20×transfer buffer,20 ml甲醇,加水至100 ml);先加入甲醇,放入PVDF膜,浸泡30 s后转移到转膜液中待用。然后将PVDF膜和滤纸在transfer buffer中浸透。电泳结束后,在滤纸上再倒少量transfer buffer,然后膜在下、胶在上,放置在滤纸上。在胶上倒少量transfer buffer,设置12 V、48 min开始转膜。封闭:PVDF膜放入封闭液,4 ℃封闭过夜。一抗孵育:用PBST稀释一抗,待封闭完成后,用PBST漂洗2次。孵育抗体:在培养板的板盖上铺封口膜,将抗体滴加在封口膜的一端,镊子取出PVDF膜,PVDF膜一端接触抗体后,再向膜上加抗体液,水平置于4 ℃冰箱中,孵育过夜。二抗孵育:按1 ∶2 000的比例稀释二抗。摇床上PBST洗膜3次,每次10 min。用相同的方法孵育二抗。显影:Thermo公司Supersignal试剂,A、B 等体积混匀在试管中,滴在PVDF膜上,GE公司Las 4000mini显影拍照。
1.3.7CCK-8实验 96 孔板中每孔接种2×103个SKBR3和MDA-MB-231细胞,100 μl培养基培养过夜,然后使用AP1S1特异siRNA与对照分别转染细胞,48 h后每孔加入10 μl CCK-8溶液,孵育2 h后放入酶标仪中检测450 nm吸光度,计算细胞相对生长率=实验组OD值/对照组OD值×100% 。
1.3.8平板克隆实验 将转染AP1S1特异siRNA与对照siRNA的MDA-MB-231细胞株,消化细胞计数后分别以每皿种植100个细胞的密度培养2~3周,当培养皿中出现肉眼可见的克隆时终止培养,洗涤后加4%多聚甲醛固定15 min,加适量吉姆萨染液10~30 min,然后用流水缓慢洗去染色液,拍照并计数细胞克隆。
1.3.9细胞划痕实验 将转染AP1S1特异siRNA与对照siRNA的MDA-MB-231细胞株分别接种到6孔板中,待细胞贴壁生长至融合度约为80%时,用200 μl无菌枪头沿孔中轴线轻轻划痕,然后用PBS洗涤细胞2次以除去漂浮细胞,加入新鲜培养基后放入细胞培养箱培养;分别选择0、20 h时间点拍照,观察划痕愈合情况并测量细胞迁移距离。
2 结果
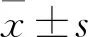
2.1 AP1S1在乳腺癌组织中表达上调和预后的相关性在GEPIA网页上在线分析TCGA数据库中1 085 例乳腺癌组和291例正常对照组AP1S1基因的表达水平,结果显示AP1S1在乳腺癌组的表达水平高于正常对照组(P<0.01),见图1A。随后利用UCLCAN软件分析1 097例乳腺癌组和114例正常对照组中AP1S1的表达水平,结果证实了乳腺癌组中AP1S1表达水平高于正常对照组(P<0.05),见图1B。根据AP1S1表达高低分析TCGA数据库中乳腺癌患者的OS和DFS,结果表明AP1S1高表达患者的OS与DFS均比低表达患者缩短(P值分别为0.001 3、0.008 3)(图1C、1D)。
2.2 AP1S1的表达与病例参数的相关性在UALCAN公开数据库中检索AP1S1表达与乳腺癌患者的病理亚型、年龄、肿瘤分期或者淋巴结转移之间的相关性,结果提示AP1S1表达水平与肿瘤分期相关,随着肿瘤分期升高,AP1S1的表达水平也越高(P<0.05),但与病理亚型、年龄、淋巴结转移状态无相关性(P>0.05),见图2。
2.3 临床标本检测AP1S1的表达水平纳入110例乳腺癌组织标本进行免疫组化检测,结果显示有53例AP1S1高表达,57例AP1S1低表达(图3);进一步把AP1S1表达与病例参数联系起来统计分析,发现AP1S1表达水平与肿瘤大小及AJCC分级相关(P<0.05),而与年龄及淋巴结转移状态、雌激素受体(ER)状态、孕激素受体(PR)状态、人表皮生长因子受体-2(HER2)状态无相关性(P>0.05),见表1。
2.4 AP1S1表达下调会抑制乳腺癌细胞的增殖与转移使用2种AP1S1siRNA与对照siRNA分别转染MDA-MB-231和SKBR3细胞株。采用qPCR方法验证siRNA转染效果,结果显示:在MDA-MB-231细胞系中AP1S1平均相对表达量为(0.826 7±0.035 1),siRNA1组平均相对表达量为(0.213 3±0.040 4),差异有统计学意义(t=19.84,P<0.000 1);siRNA2组中平均相对表达量为(0.320 0±0.030 0),差异有统计学意义(t=19.00,P<0.000 1)。在SKBR3细胞系中AP1S1平均相对表达量为(0.7567±0.035 1),siRNA1组中AP1S1平均相对表达量为(0.233 3±0.040 4),差异有统计学意义(t=16.93,P<0.000 1);siRNA2组AP1S1平均相对表达量为(0.430 0±0.040 0),差异有统计学意义(t=10.63,P=0.000 4)(图4A)。利用Western blot验证siRNA1处理MDA-MB-231和SKBR3细胞株AP1S1蛋白表达水平,结果显示使用siRNA1处理的两种细胞株的AP1S1蛋白表达水平均降低(图4B)。CCK-8检测结果显示2种AP1S1 siRNA处理的MDA-MB-231和SKBR3细胞较对照细胞的增殖速率均降低(图4C)。平板克隆结果显示AP1S1siRNA1组的MDA-MB-231和SKBR3细胞较对照NC组的克隆数减小(图4D)。细胞划痕实验结果表明,MDA-MB-231平均迁移距离为(169.00±17.06)mm,siRNA1组平均迁移距离为(80.67±14.64)mm,差异具有统计学意义(t=6.806,P=0.002);SKBR3平均迁移距离为(150.67±13.05)mm,siRNA1组平均迁移距离为(82.67±9.71)mm,差异具有统计学意义(t=7.240,P=0.002)(图4E)。
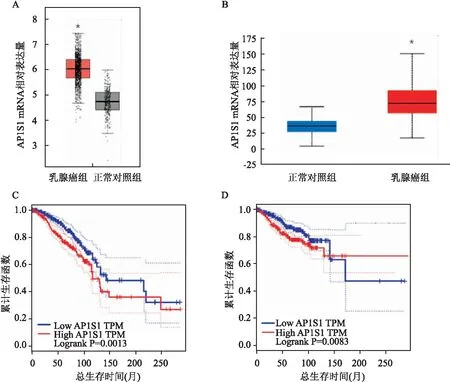
图1 公开数据分析显示AP1S1在乳腺癌组织中表达升高
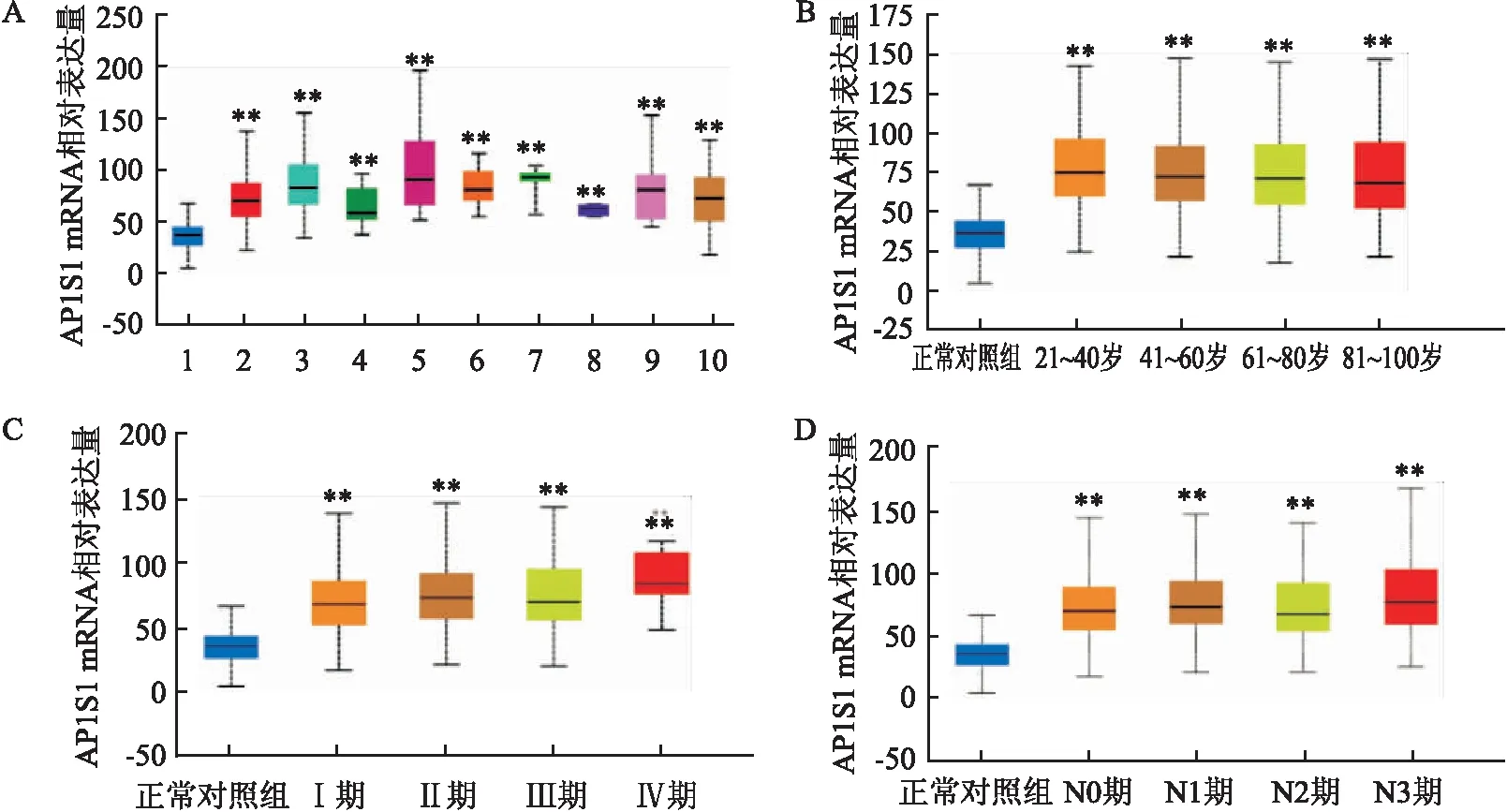
图2 乳腺癌临床特征与AP1S1表达水平的关系
图3 临床标本分析AP1S1在乳腺癌组织中的表达
3 讨论
近20年来,以手术为主要治疗方法,化疗、放疗、内分泌治疗及靶向治疗为辅助的多学科综合治疗模式得到了长足的发展[7],但是长期以来缺乏有效的预后预测手段来指导患者个体化治疗,以至于相当一部分化疗获益较少的低风险患者也不得不接受化疗。所以研究人员开展了多基因检测技术,用来评估患者复发风险和辅助化疗获益程度,并且多基因检测技术可以进一步提高传统的病理分型和免疫组化分型的预测价值,在提供预后信息、判断药物治疗敏感性方面具有非常大的发展空间[8]。但是这些基因对于患者的生存预后并不完善,需要我们提供更多的与预后有关的基因。因此通过生物信息学筛选出了AP1S1这个与生存预后有着密切关系的基因。
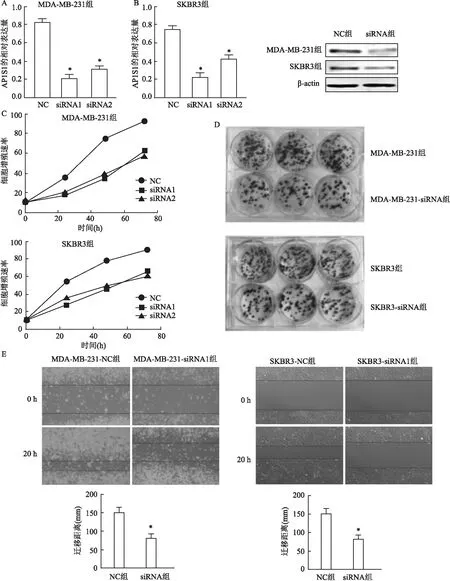
图4 AP1S1表达下调会抑制乳腺癌细胞的增殖与转移
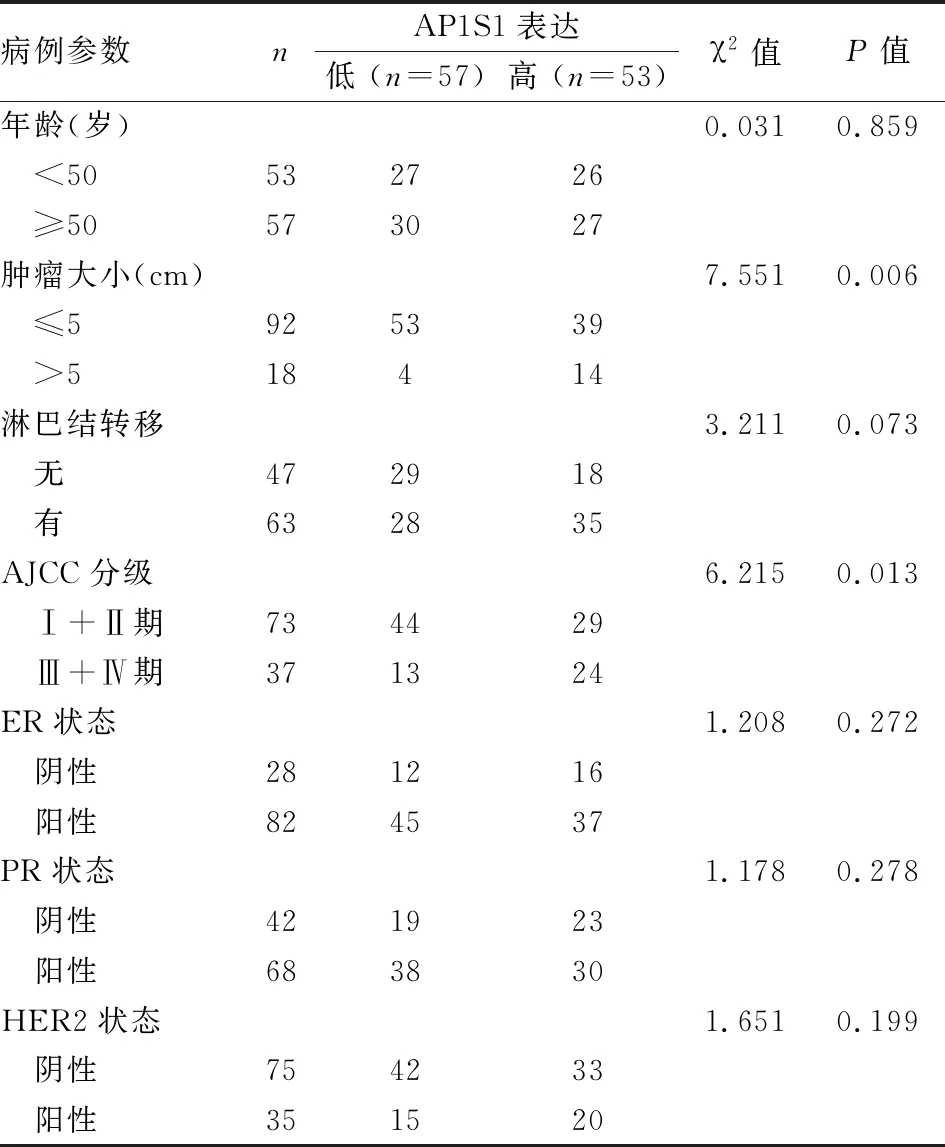
表1 AP1S1表达与乳腺癌病例参数的关系
有关AP1S1在肿瘤领域的研究尚不多见,有报道AP1S1可能成为急性骨髓性白血病(acute myeloid leukemia, AML)和前列腺癌的癌基因表达和DNA甲基化状态的综合标志物[9],也可能通过上调ERBB2与多形性胶质母细胞瘤(glioblastoma multiforme, GBM)发生发展,同时高表达水平的AP1S1会预示GBM患者的OS较短[10]。鉴于AP1S1在乳腺癌中的表达与生物学功能尚不清楚,本研究首先通过GEPIA和UALCAN在线数据库分析AP1S1在肿瘤组织与正常对照组织表达水平的差异,结果显示AP1S1在乳腺癌组织中呈高表达。进一步利用UALCAN数据库分析AP1S1表达水平与临床参数的相关性,显示肿瘤分期越晚,其AP1S1表达水平越高;通过GEPIA在线分析显示AP1S1高表达乳腺癌患者的OS与DFS也下降。为验证上述结果,使用临床病理标本分析证实了AP1S1表达水平与乳腺癌肿瘤大小及病理分期呈正相关(P<0.05)。为了解AP1S1基因表达的生物学意义,使用siRNA技术下调MDA-MB-231和SKBR3 细胞株AP1S1的表达,通过细胞平板克隆与CCK-8实验发现乳腺癌细胞的AP1S1表达下调后,其增殖与克隆形成速度均降低;接着采用细胞划痕实验检测AP1S1表达敲低对MDA-MB-231和SKBR3细胞迁移能力的影响,结果表明AP1S1表达下调会导致乳腺癌细胞的迁移能力降低。这些实验结果提示AP1S1对于乳腺癌应该是一种促癌基因和患者预后不良因素。其中AP1S1表达的临床意义及其促癌的分子机制需要更深入的研究。
综上,本研究表明AP1S1基因在乳腺癌组织中高表达,其表达水平与乳腺癌患者的预后相关;而且AP1S1基因表达能够促进乳腺癌细胞增殖、克隆形成与迁移能力。
