β-DG过表达对结肠癌细胞系SW620细胞凋亡的影响
2020-10-13潘林鑫
钱 成,徐 涛,潘林鑫
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤,可向肝、肺、脑、骨等脏器转移,晚期可出现贫血、消瘦、恶病质等表现,严重者危及生命。除了对结肠癌的临床研究外,目前对其细胞生物学研究也越来越深刻[1-2]。HCT116、SW620等细胞系是从结肠癌患者中分离建立的恶性细胞,广泛应用于结肠癌的细胞学研究。人类的肌营养不良蛋白 (dystroglycan,DG)是由位于染色体3p21上的DAG1基因编码的含有895个氨基酸残基的跨膜蛋白,在体内翻译修饰后发生多肽键断裂,最终水解成α-DG和β-DG 2个具有独立功能的蛋白。α-DG是位于细胞膜上的高度糖基化蛋白,并通过与多种细胞外基质(extracellular matrix,ECM)蛋白结合进行信号转导。而β-DG作为跨膜蛋白,其胞内区直接与抗肌萎缩蛋白(dystrophin,Dys)结合,从结构上分析,β-DG主要由2个结构域组成,即N端(654~750 aa)和C端(775~895 aa),它们通过跨膜结构域(transmembrane domain,TM)相连[3]。β-DG的N端与α-DG的C端通过非共价键的方式交联,其C端的酪氨酸序列能够结合胞内的信号分子,并通过酪氨酸的磷酸化参与激活多条信号转导途径,发挥着调节细胞的分化、增殖、凋亡以及改变细胞的极性等生物功能,在癌症、遗传性疾病等疾病的发生发展中扮演着重要角色[4-5]。该研究首先检测四株常见的人结肠癌细胞系中β-DG的内源表达情况,以确定β-DG低表达细胞系SW620,然后构建pcDGFP-β-DG的真核表达质粒,并过表达于SW620细胞中,研究β-DG对其细胞凋亡及相关蛋白表达的影响。
1 材料与方法
1.1 质粒、菌株与细胞pcDNA3.1-FLAG-DAG1和pcDGFP真核表达载体质粒由安徽医科大学生物系范礼斌教授实验室惠赠,DH5α感受态菌株HEK 293T和SW620等结肠癌细胞株由校实验中心实验室保存。
1.2 主要试剂与仪器DNA聚合酶购自日本TaKaRa公司;BamH I、Not I内切酶以及T4连接酶购自上海生工生物公司;胶回收、质粒小量抽提试剂盒购自美国Axygen公司;细胞裂解液、PMSF蛋白酶抑制剂、一抗稀释液购自上海碧云天公司;GFP抗体、β-DG抗体购自美国Santa Cruz公司;DMEM培养基购自澳洲HyClone公司;胎牛血清购自美国CLARK公司;脂质体转染试剂盒、Opti-MEM低血清培养基购自美国Invitrogen公司。AL600RGB凝胶成像系统购自美国GE公司;Axio Observer 3倒置荧光显微镜购自德国卡尔蔡司公司;MoFlo XDP超速流式细胞分选仪、CytoFlex流式细胞分析仪购自美国Beckman公司。
1.3 方法
1.3.1质粒构建[6]设计并合成引物序列:F:CC GGAATTCCGGGCCACCATGTCCATCGTGGTGGAA;R:AAGGAAAAAAGCGGCCGCAAAAGGAAAACAGG TGGGACCATAGGGA,以pcDNA3.1-FLAG-DAG1真核表达质粒为模板,PCR扩增出β-DG的CDS序列,将产物进行琼脂糖凝胶电泳,并利用胶回收试剂盒进行回收,得到其PCR纯化产物,利用限制性内切酶EcoR I和Not I对β-DG的PCR纯化产物和pcDGFP空载体分别进行双酶切,用T4 DNA连接酶将二者的酶切产物进行连接,并将连接产物转化于DH5α感受态细胞中,37 ℃培养至单克隆生成(约12 h),分别挑取数个单克隆进行扩大培养(约12 h),并抽提菌液中的质粒进行双酶切鉴定(EcoR I和Not I),选择鉴定正确的重组质粒送公司进行测序。
1.3.2细胞培养 37 ℃水浴复苏冻存于液氮中的各细胞系,并用完全培养基(90% DMEM高糖+10% FBS+青链霉素)进行培养,培养环境为37 ℃、5% CO2的恒温培养箱。定时观察细胞,及时更换完全培养基,待细胞生长至90%以上密度时即可进行细胞传代,将适量细胞重新接种至新的培养皿或培养瓶中,用于后续实验。
1.3.3质粒转染 本研究采用的转染方法为脂质体转染法,步骤如下(以六孔板为例):分别将适量pcDGFP-β-DG(2~3 μg)或pcDGFP和lip2000(4~6 μl)加到适量Opti-MEM转染液中(约200 μl),并轻轻充分混匀,室温静置5 min后将两者轻轻充分混匀,室温静置20 min后,将溶液加入待转染的细胞中,培养4~6 h后更换为完全培养基,继续培养48 h,用于后续蛋白表达实验。
1.3.4Western blot检测 转染pcDGFP-β-DG约48 h后,分选并收集阳性细胞进行裂解(冰上或4 ℃),30 min后收集细胞裂解液进行高速冷冻离心(14 000 r/min,10 min)并收集上清液,蛋白定量后取出适量上清液,加入等量2×SDS上样缓冲液充分混合,沸水浴5 min,冰浴5 min后取适量样本进行 SDS-PAGE电泳(80 V约0.5 h,100 V约1.5 h),200 mA恒流电转1 h,取出PVDF膜,用含5%脱脂奶粉的TBST溶液封闭1~2 h,TBST溶液洗膜后加入GFP一抗 (1 ∶500)进行孵育(4 ℃过夜或室温2 h),TBST洗膜后加入HRP标记的山羊抗兔IgG(1 ∶5 000)进行孵育(室温1 h),TBST溶液洗膜后用ECL试剂盒进行显色,在蛋白成像仪上进行拍摄。
1.3.5免疫荧光观察 转染pcDGFP-β-DG约24 h后,取出SW620细胞爬片,用预冷的PBS溶液清洗3次后进行固定(-20 ℃预冷甲醇2 min+70%乙醇5 min),由于GFP能够自发绿色荧光,因此无需进行一抗和二抗孵育,固定后用预冷的PBS溶液清洗3次后进行细胞核染色(0.15 g/L DAPI 2 min),弃DAPI溶液后用预冷的PBS溶液清洗3次后,用荧光封片胶将盖玻片封于载玻片上。4 ℃保存过夜后用荧光显微镜进行观察。
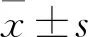
1.3.6细胞凋亡 将转染了pcDGFP-β-DG(实验组)和pcDGFP空载体(对照组),以及未转染(空白组)的SW620,用不含EDTA的胰酶消化后低速收集(1 000 r/min, 3 min),用预冷的PBS洗涤细胞2次后,加入400 μl×Binding Buffer重悬细胞(浓度大约为1×106/ml),加入5 μl Annexin V-FITC,轻轻混匀后于2~8 ℃避光条件下反应15 min,然后加入10 μl PI轻轻混匀后于2~8 ℃避光条件下反应5 min,混匀后放置于冰上,样品在1 h内用流式细胞仪检测凋亡情况。凋亡图分为4个象限,左下象限为细胞存活率(Q1-LL)、左上象限为细胞死亡率(Q1-UL)、右上象限为细胞晚期凋亡率(Q1-UR)、右下象限为细胞早期凋亡率(Q1-LR),本次实验凋亡率为Q1-UL、Q1-UR和Q1-LR 3个象限数值之和。
2 结果
2.1 结肠癌细胞系中β-DG的表达情况培养HT29、HCT116、SW480、SW620等结肠癌细胞系以及HEK293T肾上皮细胞系,并收集适量以上5种细胞进行裂解,提取总蛋白,定量分析后进行Western blot实验,当用β-DG抗体进行免疫印迹时,结果发现5种细胞蛋白样品在43 ku处均出现蛋白条带,大小基本符合β-DG的分子量。但与正常上皮细胞相比,各结肠癌细胞系中β-DG的表达量都有不同程度的减少,其中SW620细胞的β-DG表达量最少,适合用于后续β-DG的过表达实验,见图1。

图1 结肠癌细胞系中β-DG的表达情况

图2 pcDGFP-β-DG重组质粒的酶切鉴定与测序结果
2.2 β-DG真核表达载体的构建通过PCR扩增、双酶切、酶连、质粒转化与抽提后拟得到pcDGFP-β-DG重组质粒,利用EcoR I和Not I进行双酶切鉴定,琼脂糖电泳结果如图2A所示,重组质粒被切出两条亮带,通过DNA Marker、PCR产物和空载体的横向比较,发现一条亮带大小约为6 100 bp,与pcDGFP空载体的大小基本一致,另一条亮带大小约为720 bp, 与β-DG的片段大小基本一致。将此重组质粒送生物公司进行测序,并将测序结果与β-DG的CDS序列(729 bp)进行比对,碱基序列完全一致,表明pcDGFP-β-DG重组质粒构建成功,见图2B。
2.3 β-DG在SW620细胞中的过表达和荧光定位情况将pcDGFP-β-DG瞬时转染至SW620细胞中,收集、裂解细胞后进行Western blot检测,当用GFP抗体进行免疫印迹时,结果显示空载体对照组、β-DG过表达组分别在25 ku和70 ku左右的位置出现条带,即为GFP和GFP-β-DG(27+43 ku)融合蛋白的蛋白表达,而空白对照组未见任何条带,表明pcDGFP-β-DG重组质粒能够在SW620细胞中过表达,见图3。另外,制作SW620细胞爬片,过表达GFP-β-DG后进行免疫荧光制片,并在荧光显微镜下进行观察,结果显示GFP-β-DG自发绿色荧光,主要定位在细胞质中,细胞核内未见显著表达,且在细胞质中靠近核膜一侧的定位更加明显,见图3。
2.4 β-DG过表达对SW620细胞凋亡的影响分别将pcDGFP-β-DG和pcDGFP(作为对照)瞬时转染至SW620细胞中,约24 h后收集细胞,分别进行Annexin V-FITC/PI双染,然后利用流式细胞术检测凋亡情况,共进行3次重复实验,结果如表1所示,统计分析后发现,空白组(未转染)和对照组(转染pcDGFP空载体)细胞凋亡率的差异无统计学意义(P>0.05),与对照组相比,实验组(转染pcDGFP-β-DG)细胞的凋亡率升高(P<0.05),差异有统计学意义,见图4,表明过表达β-DG能够有效促进SW620结肠癌细胞凋亡。

图3 β-DG在SW620细胞中的过表达和荧光定位图 ×630

图4 β-DG过表达后SW620细胞的凋亡图
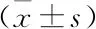
表1 β-DG过表达对SW620细胞凋亡的影响
2.5 β-DG过表达对细胞凋亡相关蛋白的影响分别将pcDGFP-β-DG和pcDGFP(作为对照)瞬时转染至SW620细胞中,约24 h后收集细胞,提取总蛋白后进行Western blot检测,共进行3次重复实验,当用PARP抗体进行免疫印迹时,结果显示空白组、空载体对照组、β-DG过表达组均在113 ku左右的位置出现条带,即为完整的PARP蛋白,相对而言,β-DG过表达组的PARP蛋白含量有所降低,且在约90 ku的位置还出现了另一条带,即为PARP的裂解片断,见图5。表明过表达β-DG能够有效促进细胞凋亡蛋白PARP裂解,即促进SW620结肠癌细胞凋亡。

图5 β-DG过表达对细胞凋亡蛋白PARP的影响
3 讨论
DG是一种跨膜的糖蛋白,β-DG作为其水解衍生物,是组成细胞表面的重要成分,广泛分布于脊椎动物的骨骼肌和其他组织中[7]。β-DG的N端存在着潜在的N-连接糖基化位点,在其C末端存在一个PPXY序列,该序列又与一个含有两个高度保守色氨酸残基的WW结构域相结合,构成了蛋白质相互作用的一种模式,此结合的稳定性取决于抗肌萎缩蛋白的EF-手形结构域。此外,β-DG的胞质尾区能够与包括细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、丝裂原激活的蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)、生长因子受体结合蛋白2(growth factor receptor-bound protein 2,GRB2)等在内的众多信号分子充分结合,进而起到稳定神经肌肉接头,传递细胞信号转导的功能。DG的异常表达是癌症发生的一个重要特征,与肿瘤的发展和转移密切相关[8],这种异常除了与α-DG糖基化水平改变有关外,还与β-DG的异常表达有关。在人类的乳腺癌、前列腺癌、宫颈癌、舌鳞状细胞癌中都发现了β-DG的异常[9-11],这种异常主要表现在其非正常裂解导致的表达量下降。本研究首先利用免疫印迹技术检测了HT29、HCT116、SW480、SW620等常见的结肠癌细胞系中内源性β-DG的表达情况,结果发现各癌细胞系中正常分子量β-DG(43 ku)的表达量均有不同程度的下降,其中SW620下降的最为明显,另外,这些结肠癌细胞系在约31 ku的位置均出现了蛋白条带,这可能是正常β-DG蛋白水解后的胞外结构域,它的产生是由于膜相关基质金属蛋白酶的活化,破坏了DG复合物的结构,最终导致癌症的发生。
本研究首先确定了β-DG在各结肠癌细胞系中呈现低表达状态,接下来选择了低表达程度最高的SW620细胞进行β-DG的过表达研究。利用基因重组技术构建了pcDGFP-β-DG真核表达质粒,并将其转染至SW620细胞中,利用Western blot技术检测了其表达情况,结果发现β-DG能够成功过表达。同时还利用了免疫荧光技术对β-DG在SW620中的细胞定位进行了检测,结果发现GFP-β-DG蛋白主要定位在细胞质中,而且在细胞质中靠近核膜的一周表达量更多,此结果与之前研究的FLAG-β-DG在COS7细胞中的定位结果基本一致[12]。而且根据位置推测,β-DG蛋白定位可能与高尔基体或内质网有着密切的联系,所以在接下来的研究中,可以选择高尔基体或内质网的标志染料麦胚凝集素或刀豆球蛋白A与β-DG进行共定位研究,进一步确定β-DG蛋白的具体亚定位。
本研究旨在探索β-DG对结肠癌细胞系细胞凋亡的影响,细胞凋亡是细胞的一种基本生物学现象,是由基因控制的细胞自主有序的死亡,在生物体的进化、内环境的稳定以及组织系统的发育中起着重要的作用。而细胞凋亡的抑制或减弱与癌症的发生发展有着密切的联系,许多化疗药物发挥作用的机制就是诱导癌细胞的凋亡[13]。因此本研究在确定结肠癌细胞系和β-DG的过表达效果后,便利用流式细胞术检测过表达β-DG对SW620细胞凋亡的影响,结果发现β-DG过表达后能够提高SW620细胞的凋亡率,表明β-DG具有促凋亡功能。为了进一步确定这个结果,又检测了过表达β-DG后SW620细胞中二磷酸腺苷核糖多聚酶(PARP)蛋白水平的变化,PARP为一种依赖锌离子(Zn2+)的真核DNA结合蛋白,可特异性地识别DNA断裂末端并结合,是一种重要的DNA修复酶,在细胞凋亡发生的早期, PARP是含半胱氨酸的天冬氨酸蛋白水解酶家族(如caspase 3和caspase 7)的作用底物,后者可使PARP的DNA 修复功能丧失,并将113 ku的PARP水解为89 ku的片断。因此PARP可以作为细胞凋亡早期的标志物,许多研究便是通过Western blot检测PARP的完整蛋白(113 ku)及其裂解片断(89 ku)的表达量来观察细胞凋亡效果[14]。本研究检测发现β-DG过表达后PARP的完整蛋白(113 ku)含量下降,且裂解片断(89 ku)的表达量升高,同样表明过表达β-DG具有促凋亡功能。
综上所述,β-DG在结肠癌细胞系中异常表达,主要表现在其异常的水解断裂。过表达β-DG能够显著促进SW620细胞凋亡及相关凋亡蛋白的表达,为进一步了解β-DG功能,及其与结肠癌之间的关系提供了细胞学基础。
