槲皮素通过调控CLDN6基因表达量对子宫内膜异位症细胞增殖、迁移和侵袭的影响及其机制研究
2020-10-13黄山鹰唐国玲王佳慧姚秀华罗智华刘庆芝
黄山鹰,唐国玲,王佳慧,姚秀华,刘 剀,罗智华,刘庆芝
子宫内膜异位症是临床常见妇科疾病且育龄女性的发病率较高,应用传统药物治疗子宫内膜异位症效果不佳,患者不良反应较多[1-2]。研究[3]表明槲皮素(quercetin,Que)对大鼠子宫内膜异位症模型的异位内膜具有抑制作用。紧密连接蛋白 6(claudin 6,CLDN6)在子宫内膜癌中高表达,抑制其表达可以降低子宫内膜癌细胞的增殖和迁移[4-5]。Periostin及大黄素可以调控子宫内膜间质细胞和异位子宫内膜间质细胞的增殖、黏附力以及迁移和侵袭能力[6]。研究[7]表明通过构建子宫内膜异位症体外细胞共培养模型有助于研究细胞迁移和侵袭等行为变化。该研究通过分离培养异位子宫内膜间质细胞(ectopic endometrial stromal cells, EcSCs)分析Que对EcSCs增殖、迁移及侵袭的影响,探讨其是否可通过调控CLDN6表达而发挥作用,为Que治疗子宫内膜异位症提供新思路。
1 材料与方法
1.1 主要试剂Que购自中国食品药品检定研究院;DMEM购自美国Sigma公司;胎牛血清(FBS)购自美国Gibco公司;胰蛋白酶购自北京索莱宝科技有限公司;青霉素-链霉素混合溶液与ECL发光液均购自美国Millipore公司;兔抗人Vimentin、E-cadherin、N-cadherin、磷酸化蛋白激酶B(phospho-AKT,p-AKT)、总蛋白激酶B(total-AKT,t-AKT)、整合素连接激酶 (integrin-linked kinase, ILK)、基质金属蛋白酶 (matrix metalloproteinase, MMP) -2、MMP-9、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体均购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔或山羊抗鼠IgG二抗购自北京中杉金桥生物技术有限公司;PVDF膜购自美国PALL公司;LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;siRNA-CLDN6及其阴性对照均购自上海吉玛制药技术有限公司;MTT试剂与DMSO均购自美国Sigma公司;Transwell小室购自美国Corning Coster公司;Matrigel基质胶购自美国BD公司。
1.2 方法
1.2.1病例资料 选取2016年7月~2017年3月本院收治的40例子宫内膜异位症患者,所有患者均进行腹腔镜或宫腹腔镜检查,并经手术病理确诊为卵巢子宫内膜异位症,本研究经本院伦理委员会批准,患者及家属知情且签署同意书。入选标准:年龄25~50岁;月经规律;无性激素相关疾病;术前均未服用避孕药等药物。排除标准:合并恶性肿瘤者;术前接受性激素治疗者。活检时切取异位子宫内膜组织,置于-80 ℃超低温冰箱内保存。
1.2.2EcSCs分离与培养 预冷PBS缓冲液冲洗异位子宫内膜组织,加入Ⅳ型胶原酶溶液后剪碎组织,放入37 ℃恒温振荡器内振荡消化组织,收集消化后的内膜组织置于离心管内,用200目筛网过滤,反复研磨冲洗后离心,制备细胞悬浮液,重悬后的细胞用400目筛网重新过滤,收集滤液并离心(1 000 r/min、10 min),离心后加入含有10% FBS的DMEM完全培养基重悬细胞,将重悬细胞接种于另一培养皿,置于37 ℃、5% CO2恒温培养箱内培养,每2 d更换1次培养液,并置于倒置显微镜下观察细胞生长状态,鉴定EcSCs。待EcSCs生长融合度达到80%~90%时弃培养基进行传代培养,预冷PBS缓冲液冲洗2次×5 min,加入胰蛋白酶消化细胞,当细胞收缩变圆时加入DMEM完全培养基消化,1 000 r/min离心5 min后弃上清液,加入DMEM完全培养液,置于恒温培养箱培养,每2~3 d更换1次培养液,待细胞稳定传代2次后收集细胞进行后续研究。
1.2.3细胞转染、Que处理及分组 将EcSCs细胞接种于24孔细胞培养板,使用不同浓度Que处理EcSCs细胞,剂量分别为0、12.5、25、50 μmol/L,并筛选出Que适宜使用浓度用于后续研究。EcSCs生长融合度达到30%时进行转染,分别将空白质粒(normal control,NC)、阴性对照质粒(si-control)、siRNA-CLDN6质粒转染EcSCs,观察CLDN6表达变化对EcSCs生物学行为的影响。后续实验中为明确Que是否通过抑制CLDN6而影响EcSCs生物学行为,实验分为4组:NC组:未进行任何处理的EcSCs;Que组:EcSCs中加入适宜浓度的Que 作用24 h;Que+pcDNA组:EcSCs中转染pcDNA质粒12 h后加入适宜浓度的Que作用24 h;Que+pcDNA-CLDN6组:EcSCs中转染pcDNA-CLDN6质粒12 h后加入适宜浓度的Que作用24 h。转染6 h后将不含FBS的DMEM培养基更换为含有10%FBS及青霉素-链霉素混合溶液的DMEM培养基。
1.2.4Western blot检测CLDN6、PCNA、MMP-2、MMP-9、上皮-间质细胞转化(epithelial to mesenchy-mal transition,EMT)及ILK信号通路相关蛋白表达 收集各组EcSCs,加入1 ml蛋白裂解液,经12 000 r/ min离心20 min提取细胞总蛋白,加入buffer使蛋白变性,取等量蛋白样品进行SDS-PAGE电泳反应,转膜,脱脂奶粉封闭1 h,4 ℃条件下孵育各蛋白一抗(CLDN6、PCNA、MMP-2、MMP-9稀释比1 ∶1 000)24 h,TBST洗涤4次×5 min,加入二抗(稀释比1 ∶5 000)室温孵育1 h,TBST洗涤3次×5 min,滴加ECL显色,置于成像系统并用Image J软件分析各条带灰度值,同时以目的蛋白条带与β-actin条带灰度值的比值为衡量标准,分析样品中CLDN6、PCNA、MMP-2、MMP-9、EMT及ILK信号通路相关蛋白的相对表达量。
1.2.5MTT检测EcSCs细胞增殖活性 收集对数生长期EcSCs,胰蛋白酶消化后调整细胞密度为5×104个细胞/ml,以每孔体积100 μl接种于96孔板,Que分别干预24、48、72 h时每孔加入20 μl MTT溶液,恒温培养箱内继续培养4 h,弃培养基,加入DMSO(150 μl/孔),振荡混匀10 min,选取490 nm波长应用酶标仪检测各孔光密度(optical density,OD)值。
1.2.6Transwell实验检测细胞迁移 收集各组EcSCs,用不含血清的DMEM培养基重悬细胞,取200 μl细胞悬液接种于Transwell小室的上室(2×105个细胞/孔),同时取600 μl含20%FBS的DMEM培养基加入Transwell小室的下室,置于恒温培养箱内继续培养48 h后,多聚甲醛固定20 min,结晶紫溶液染色15 min,收集Transwell小室的下室内穿膜细胞,显微镜下随机选取5个视野计算穿膜细胞数。实验均设置3次生物学重复。
1.2.7Transwell实验检测细胞侵袭 Matrigel基质胶稀释后铺于Transwell小室底部的上室面,各组EcSCs细胞接种于Transwell小室的上室,Transwell小室的下室中加入含胎牛血清DMEM培养基,继续培养48 h,其余步骤同细胞迁移实验,显微镜下观察侵袭细胞个数。实验均设置3次生物学重复。
2 结果
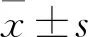
2.1 不同浓度的Que对EcSCs增殖、增殖相关蛋白和CLDN6蛋白表达的影响用不同浓度(0、12.5、25、50 μmol/L)Que处理EcSCs,随着药物浓度的增加细胞增殖活性降低,与0 μmol/L相比,Que浓度为12.5、25、50 μmol/L时细胞增殖活性降低(P<0.05);与12.5 μmol/L相比,Que浓度为25、50 μmol/L时细胞增殖活性降低(P<0.05)。见图1A。Western blot检测细胞增殖相关蛋白及CLDN6蛋白表达,结果显示随着Que浓度的增加,与0 μmol/L相比,PCNA与CLDN6蛋白表达均降低(P<0.05),与12.5 μmol/L比较,PCNA与CLDN6蛋白表达均降低(P<0.05),且呈剂量依赖效应,差异有统计学意义。见图1B、1C。
2.2 不同浓度的Que对EcSCs迁移和侵袭的影响用不同浓度Que处理EcSCs细胞,通过Transwell迁移及侵袭实验检测EcSCs迁移及侵袭能力变化,结果显示(图2A、2B),与0 μmol/L相比,Que不同浓度组EcSCs迁移及侵袭细胞数均减少(P<0.05);与12.5 μmol/L相比,Que浓度为25、50 μmol/L时EcSCs迁移及侵袭细胞数均减少(P<0.05),而25 μmol/L与50 μmol/L比较无明显差异,由此本研究后续实验选用Que浓度为12.5 μmol/L处理EcSCs。Western blot检测结果显示随着Que使用剂量的增加,与0 μmol/L相比较,MMP-2、MMP-9蛋白表达水平降低,差异有统计学意义(P<0.05)。见图2C、2D。
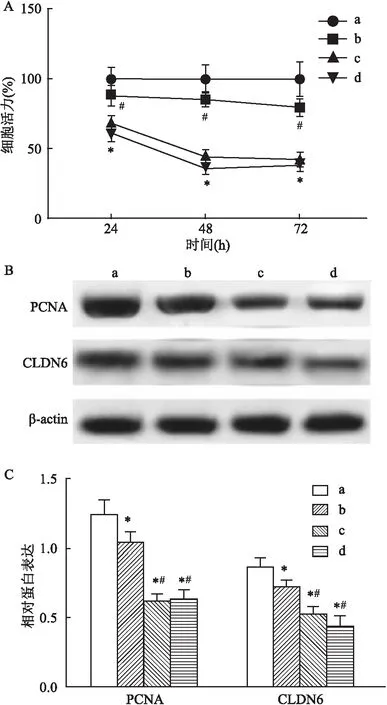
图1 不同浓度Que对EcSCs增殖、增殖相关蛋白和CLDN6蛋白表达的影响
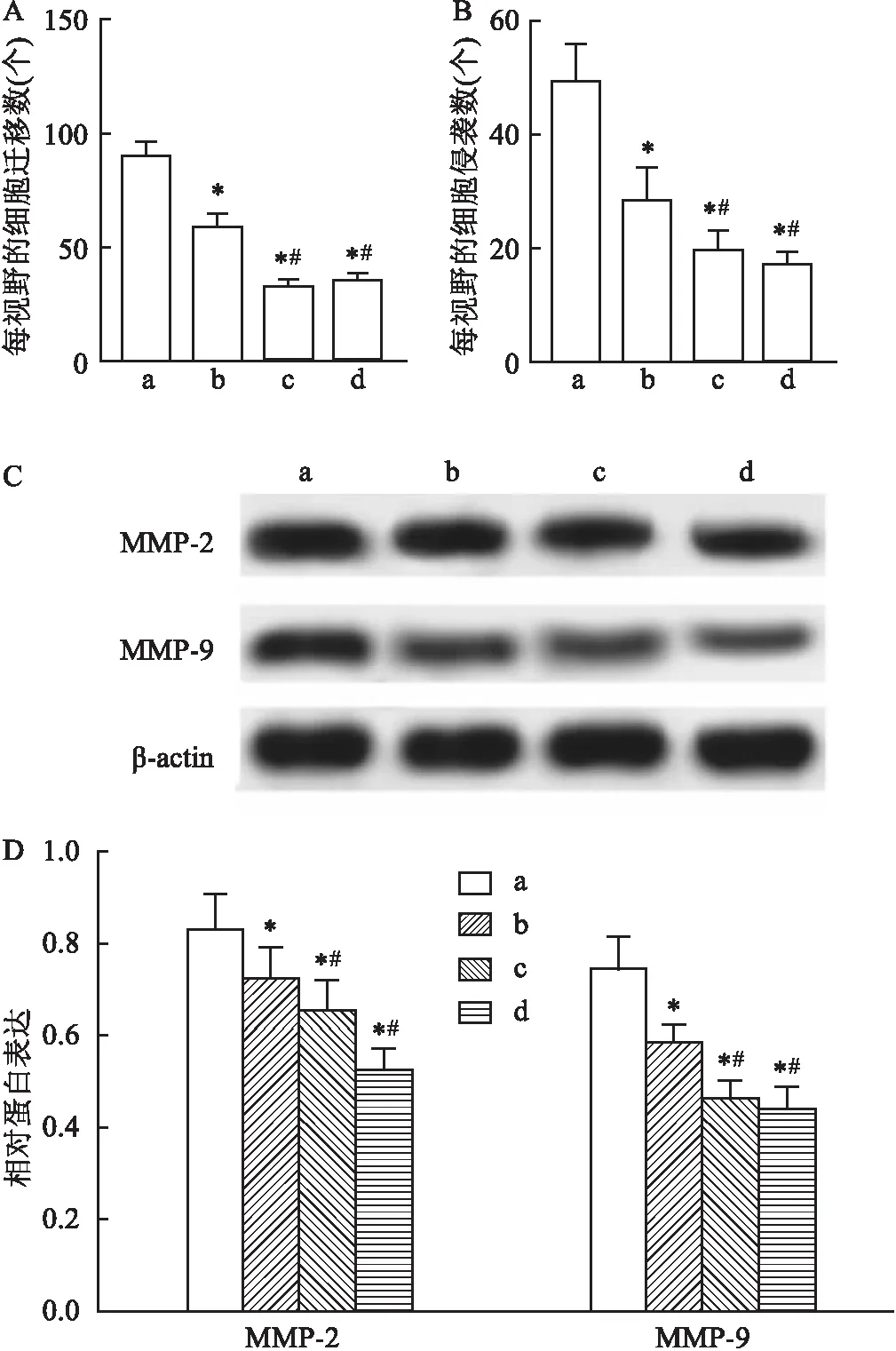
图2 不同浓度Que抑制EcSCs迁移和侵袭
2.3 沉默CLDN6对EcSCs增殖、迁移和侵袭的影响通过脂质体转染技术沉默CLDN6表达并分析其对EcSCs增殖、迁移和侵袭的影响。Western blot检测结果显示si-CLDN6组EcSCs中CLDN6表达水平低于NC组、si-control组(P<0.05),NC组与si-control组比较差异无统计学意义(P>0.05)。与NC组、si-control组比较,si-CLDN6组EcSCs增殖活性降低(P<0.05);与NC组、si-control组比较,si-CLDN6组迁移及侵袭细胞数减少(P<0.05),PCNA、MMP-2、MMP-9蛋白表达水平均降低(P<0.05),差异有统计学意义。见图3。表明沉默CLDN6后能够抑制EcSCs增殖、迁移及侵袭。
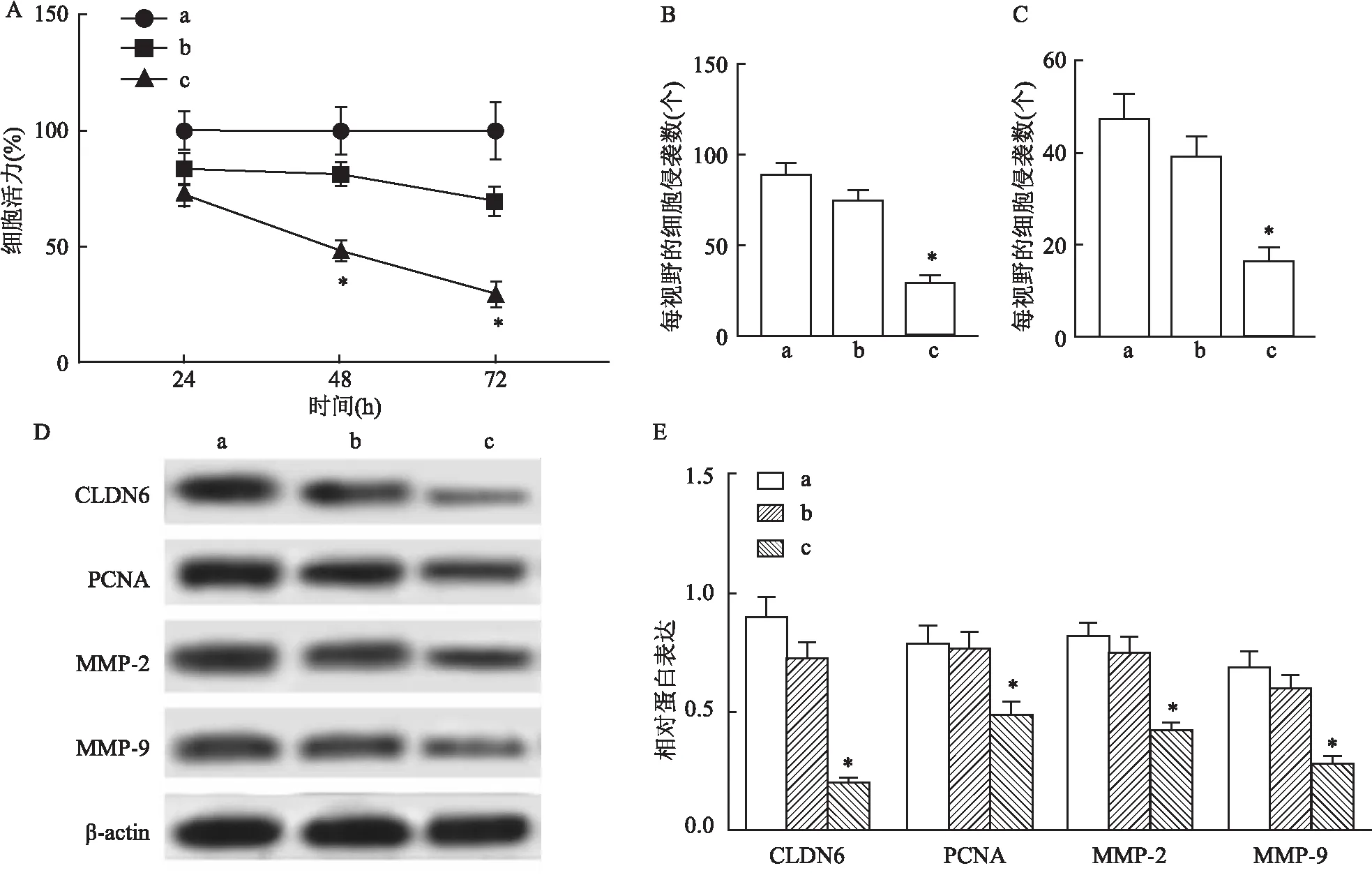
图3 沉默CLDN6抑制EcSCs增殖、迁移和侵袭的影响
2.4 过表达CLDN6与Que对EcSCs增殖、迁移和侵袭的影响为探究Que是否通过抑制CLDN6表达而影响EcSCs增殖、迁移及侵袭,通过构建CLDN6过表达载体并转染EcSCs,随后使用Que处理细胞,结果显示,相较于Que+pcDNA组,Que+pcDNA-CLDN6组EcSCs增殖活性升高(F72h=63.128,P<0.05),迁移及侵袭细胞数均增加(P<0.05),PCNA、MMP-2、MMP-9蛋白表达水平升高(P<0.05),差异有统计学意义。见图4。表明CLDN6可逆转Que对EcSCs增殖、迁移和侵袭的抑制作用。
2.5 过表达CLDN6与Que对EcSCs中EMT发生的影响为探究Que影响EcSCs迁移及侵袭的作用机制,通过Western blot方法检测EcSCs中EMT相关蛋白表达,结果显示(图5),Que处理EcSCs后E-cadherin蛋白表达水平升高(FE-cadherin=7.032,P<0.05),而N-cadherin、Vimentin蛋白表达水平降低(FN-cadherin=21.236,FVimentin=16.665,P<0.05),表明Que可抑制EcSCs细胞EMT转化进程。上调CLDN6表达后Que+pcDNA-CLDN6组EcSCs细胞E-cadherin蛋白表达水平(0.350±0.050)降低(P<0.05),而N-cadherin(0.550±0.050)、Vimentin(0.740±0.080)蛋白表达水平升高(P<0.05)。表明CLDN6过表达可逆转Que对EcSCs细胞EMT发生的抑制作用。
2.6 过表达CLDN6与Que对EcSCs中ILK信号通路的影响探究Que对ILK信号通路的影响,结果发现Que处理后EcSCs中ILK、p-AKT表达水平均降低(FILK=16.405,Fp-AKT=28.090,P<0.05),差异有统计学意义,表明Que可抑制ILK信号通路。过表达CLDN6后发现EcSCs中ILK(0.350±0.050)、p-AKT(0.550±0.050)表达水平较Que+pcDNA组(0.170±0.060;0.320±0.080)升高(P<0.05),差异有统计学意义,而各组间t-AKT表达水平(0.810±0.050;0.830±0.050;0.852±0.050;0.840±0.080)均无明显差异性(FAKT=0.252,P>0.05)。见图6。
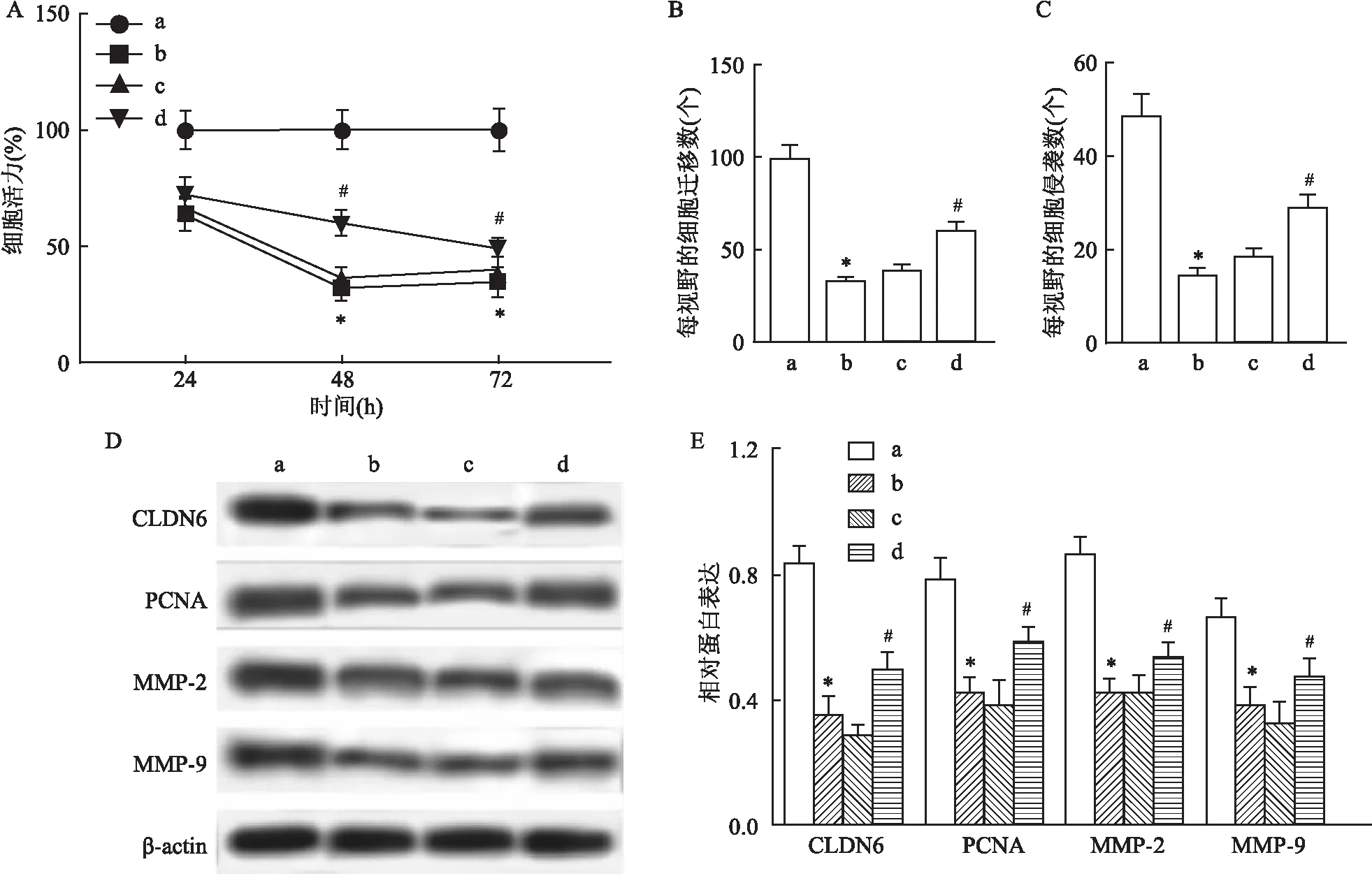
图4 过表达CLDN6逆转Que处理EcSCs增殖、迁移和侵袭的抑制作用
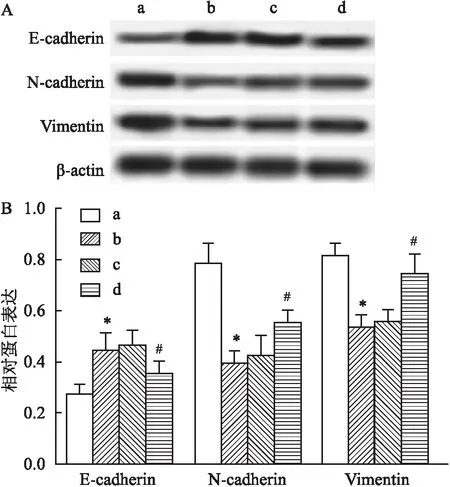
图5 过表达CLDN6与Que对EcSCs中EMT发生的影响
3 讨论
子宫内膜异位症具有极强的侵袭性与复发性,导致其成为临床治疗难点问题[8-9]。普通药物治疗可在一定程度上缓解疼痛但其副作用较多[10]。因此,寻找不良反应小且可明显降低雌激素水平的药物成为临床治疗的重要突破口。
Que还可通过下调MMP-2、MMP-9等基质金属蛋白酶表达进而抑制乳腺癌细胞迁移及侵袭能力[11]。研究[12]指出Que可通过抑制PI3K / AKT信号转导通路进而抑制EMT过程。本研究用不同浓度Que处理EcSCs细胞,结果发现随着Que使用剂量的增加,EcSCs细胞增殖活性降低,PCNA表达明显下调。本研究结果提示Que可能通过抑制PCNA表达而抑制新生血管生成进而抑制子宫异位内膜细胞增殖。本研究结果发现Que处理EcSCs细胞后细胞迁移及侵袭细胞数均明显减少,并可抑制MMP-2、MMP-9蛋白表达,提示Que可能通过抑制MMP-2、MMP-9蛋白表达进而抑制EcSCs细胞迁移及侵袭。
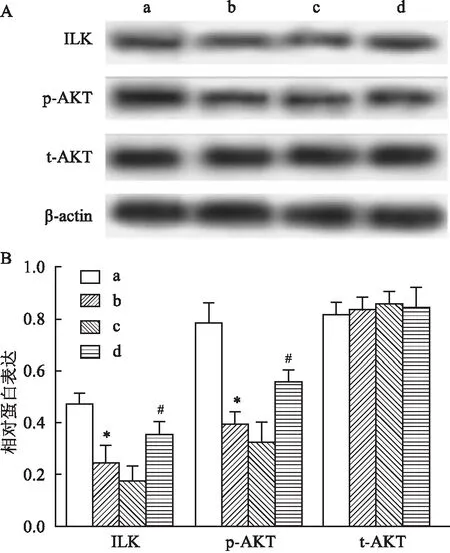
图6 过表达CLDN6与Que对EcSCs中ILK信号通路的影响
CLDN6作为紧密连接蛋白家族成员可在细胞连接及上皮组织通透性等方面均可发挥重要作用,研究[13-14]表明CLDN6异常表达可参与乳腺癌等多种恶性肿瘤发生及发展过程,通过抑制CLDN6表达可抑制乳腺癌细胞迁移及侵袭。本研究结果显示沉默CLDN6表达后EcSCs细胞增殖、迁移及侵袭能力降低,PCNA、MMP-2、MMP-9蛋白表达水平下降,说明沉默CLDN6表达可抑制EcSCs细胞增殖、迁移及侵袭。提示CLDN6基因可能作为治疗子宫内膜异位症的潜在靶点。为验证Que是否可通过抑制CLDN6表达而抑制EcSCs细胞增殖、迁移及侵袭,本研究构建CLDN6过表达载体转染入EcSCs细胞,使用Que处理后发现EcSCs细胞增殖、迁移及侵袭能力均相对增强,提示Que可通过抑制CLDN6表达而减弱EcSCs细胞增殖、迁移及侵袭能力,最终达到治疗目的。本研究结果显示Que处理EcSCs细胞后E-cadherin表达升高,而N-cadherin、Vimentin表达降低,说明Que可通过抑制EMT转化过程而减少异位子宫内膜间质细胞进而抑制子宫内膜异位症进展过程。同时CLDN6过表达后EcSCs细胞E-cadherin表达降低,而N-cadherin、Vimentin表达升高,说明CLDN6过表达可促进EMT进程进而促进子宫内膜异位症发展。提示Que可抑制CLDN6表达并通过抑制EMT转化进而减缓子宫内膜异位症发生及发展。Zheng et al[15]研究表明ILK信号通路可通过促进EMT转换进而增强人子宫内膜基质细胞的迁移和侵袭能力。本研究结果表明Que处理EcSCs细胞后ILK、p-AKT蛋白表达均降低,说明Que可抑制EcSCs细胞ILK信号通路激活进而抑制EMT转换过程。进一步研究发现上调CLDN6表达后ILK、p-AKT蛋白表达均升高,说明上调CLDN6表达可激活ILK信号通路激活进而促进EMT转换过程。本研究结果提示Que可抑制CLDN6表达并通过抑制ILK信号通路进而抑制EMT转换过程最终抑制EcSCs细胞增殖、迁移及侵袭。
综上所述,Que对EcSCs细胞增殖、迁移及侵袭具有抑制作用,其作用机制为通过下调CLDN6表达,抑制ILK信号通路及EMT转换过程而发挥作用,Que有望成为治疗子宫内膜异位症的理想新药。但子宫内膜异位症患者临床服用效果及其在体内实验中的作用效果是否一致均需进一步证实。
