和厚朴酚对过氧化氢诱导的人神经母细胞瘤细胞损伤的保护作用及机制研究
2020-10-13钱保进
钱保进,王 玉
内质网(endoplasmic reticulum,ER)在真核细胞胞质内广泛分布,是细胞内合成蛋白质并进行折叠、寡聚化加工的重要场所,可维持内环境稳定;同时内质网在脂类代谢中起着核心作用。内质网在受到高糖、高脂等多种因素刺激时,生理功能发生紊乱,称为内质网应激(endoplasmic reticulum stress, ERS);持续的ERS可能通过激活凋亡途径造成神经元细胞的损伤和凋亡。目前在多种神经退行性疾病中发现了ERS导致神经元细胞凋亡的现象,比如帕金森病(Parkinsons disease, PD)[1]。研究[2-4]表明PD主要的病理改变为多巴胺神经元变性死亡以及由应激诱发的神经元凋亡。其患者黑质内的神经细胞凋亡被过度激活[5]。PD的发生发展与神经细胞ERS相关的凋亡有密切联系[1,6]。和厚朴酚(honokiol, HNK)是传统中药厚朴中分离出的有效成分之一,是一种含有酚羟基的活性物质, 具有一定的心脑血管保护功效[7-8]。此外,研究[9-10]表明HNK具有抑制氧化应激和神经炎症等的神经保护作用。但HNK对神经细胞的ERS相关的凋亡作用目前尚不清楚。该实验用过氧化氢(H2O2)处理人来源神经母细胞瘤细胞(SH-SY5Y)构建细胞损伤模型,探讨HNK对神经元细胞ERS损伤的保护作用及其可能机制。
1 材料与方法
1.1 材料人神经母细胞瘤细胞(SH-SY5Y)SCSP-5014购于中科院上海细胞库;HNK购于成都德锐可生物科技有限公司;DMEM培养液和胎牛血清购于美国Hyclone公司;PBS购于美国GIBCO公司;胰蛋白酶、CCK-8、流式试剂盒购于美国Sigma公司;Bcl-2、Bax抗体购于美国CST公司;Caspase-3、β-actin、BIP、CHOP、Caspase-12抗体、羊抗兔IgG二抗辣根过氧化物酶(HRP)标记购于上海中杉金桥生物技术有限公司。
1.2 细胞培养SH-SY5Y细胞用含有10%胎牛血清的DMEM培养基在37 ℃、5% CO2恒温培养箱中进行培养,使其贴壁生长,每日更换培养基1次。通过倒置显微镜观察,当细胞覆盖到培养瓶85%左右时用胰酶消化进行传代。
1.3 实验分组实验分为4组。① 保护组:先加入10 μmol/L HNK于DMEM培养液孵育6 h,再加入H2O2;② 溶剂组:培养液加入与保护组HNK等体积的DMSO;③ 对照组:只添加培养液;④ 损伤组:培养液加入终浓度为400 μmol/L的H2O2。
1.4 建立模型当SH-SY5Y细胞处于对数生长期时,以3×104个/ml的密度接种于96孔板中,每孔100 μl,孵育12 h后,再加入梯度浓度的H2O2(0、50、100、200、400、800 μmol/L)孵育24 h,每孔加入10 μl CCK-8,37 ℃孵育1 h,通过酶标仪于450 nm波长下,测量每孔吸光度值。用对照组的百分比来表示细胞活性从而筛选出H2O2的终浓度。
1.5 CCK-8比色法筛选HNK浓度当SH-SY5Y细胞处于对数生长期时,稀释到3×104个/ml的密度后接种于96孔板中,每孔100 μl,孵育12 h后,对照组和损伤组中加入的培养液含10%胎牛血清;HNK组和溶剂组分别加入不同浓度(0、1、5、10、20、50 μmol/L)HNK及等体积DMSO孵育6 h。孵育结束吸取掉上清液,对照组再加入DMEM培养液,损伤组和不同浓度的HNK组加400 μmol/L的H2O2,37 ℃条件下孵育24 h,然后每孔加入10 μl CCK-8,最终筛选出HNK的适宜浓度。
1.6 免疫荧光染色观察SH-SY5Y细胞凋亡细胞用6孔板接种,每组按分组要求给予不同处理后,吸出上清液,经清洗、4%多聚甲醛固定、0.1% Triton X-100通透、3% H2O2灭活内源性过氧化物后滴加5% BSA于37 ℃封闭30 min。清洗后滴加合适浓度的一抗,接着在湿盒中4 ℃条件下孵育过夜,再用PBS清洗。加入荧光二抗37 ℃孵育1 h,PBS清洗3次,每次间隔5 min。加入DAPI进行细胞核染色,室温避光条件下孵育10 min后用PBS清洗3次,每次间隔5 min。接着滴加抗荧光淬灭剂后封片,并迅速用荧光显微镜下观察。
1.7 流式细胞仪检测SH-SY5Y细胞凋亡细胞用6孔板接种,每组按分组要求给予不同处理后,消化细胞,制成单细胞悬液,收集细胞于流式管内,再用预冷PBS洗3次。在EP管中将细胞重悬浮于200 μl结合缓冲液里,每管常规加入10 μl荧光素FITC标记的膜联蛋白V(AnnexinV-FITC)和 5 μl碘化丙啶(PI)进行染色,混匀后避光室温孵育15 min,再加入300 μl结合缓冲液后立即检测。根据AnnexinV-FITC及PI的荧光强度,流式细胞仪检测细胞凋亡率(%),同样操作重复3次。
1.8 Western blot检测凋亡和内质网应激相关蛋白表达收集各实验组处理的细胞,PBS清洗1次后加入适当细胞裂解液。常规提取细胞蛋白,再用BCA法对蛋白含量进行定量测定。取20 μg蛋白样品进行聚丙烯酰胺凝胶电泳;再通过湿转法将蛋白条带印迹到PVDF膜上;用5%脱脂奶粉封闭1 h;再分别用特异的细胞抗体(Bcl-2、Bax、Caspase-3、BIP、CHOP、Caspase-12、内参GAPDH)孵育,在4 ℃冰箱中过夜;隔天洗膜15 min×3次;相应的二抗在室温条件下孵育1 h;洗膜8 min×3次;显色。
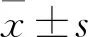
2 结果
2.1 不同浓度H2O2对SH-SY5Y细胞活性的影响不同H2O2浓度(0、50、100、200、400、800 μmol/L)作用于SH-SY5Y细胞后,细胞活性分别为(2.64±0.23)、(2.50±0.57)、(2.37±0.35)、(1.97±0.42)、(1.50±0.34)、(1.11±0.23),各组间差异有统计学意义(F=47.01,P<0.001),见图1。可见在一定范围内,细胞损伤程度逐渐增加,细胞活性明显下降。当H2O2的浓度为400 μmol/L时,细胞损伤接近50%,因此选取400 μmol/L作为造细胞损伤模型的浓度。
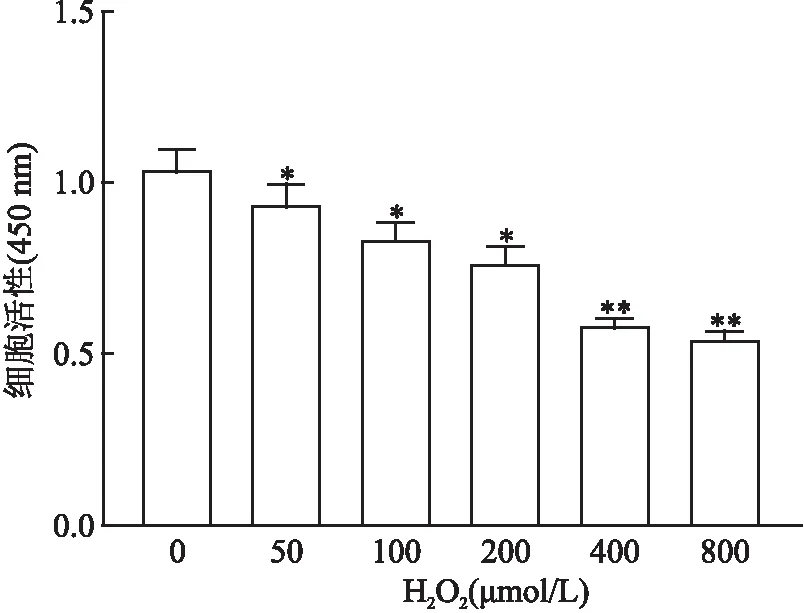
图1 不同浓度(50、100、200、400、800 μmol/L)H2O2对SH-SY5Y细胞活性的影响
2.2 不同浓度HNK对H2O2诱导的SH-SY5Y细胞活性的影响进一步实验观察不同浓度的HNK对SH-SY5Y细胞凋亡的作用,图2中细胞活性分别为(1.98±0.91)、 (1.23±0.09)、(1.32±0.13)、(1.40±0.10)、(1.56±0.13)、(1.78±0.19)、(1.54±0.17)、(0.91±0.17), 各组间差异有统计学意义(F=28.87,P<0.001)。实验结果提示,低浓度时,HNK对H2O2诱导的SH-SY5Y细胞凋亡有一定保护作用,在10 μmol/L时保护作用最佳;随着浓度升高保护作用减弱,达到50 μmol/L时甚至产生损伤作用。因此,选取10 μmol/L作为观察HNK对SH-SY5Y细胞保护作用的浓度。
2.3 HNK对H2O2诱导的SH-SY5Y细胞凋亡的影响免疫荧光法结果发现,与对照组比较,损伤组经过400 μmol/L H2O2处理SH-SY5Y细胞24 h后,凋亡细胞增多,Caspase-3的荧光较强。与损伤组比较,保护组凋亡细胞减少,Caspase-3的荧光强度减弱(图3)。此外,溶剂组与损伤组比较,H2O2诱导的SH-SY5Y细胞凋亡情况差异无统计学意义。
在流式细胞检测仪上AnnexinV-PI双染色显示,与对照组比较,损伤组的细胞凋亡率升高,差异有统计学意义(P<0.01);与损伤组比较,保护组的细胞凋亡率下降,差异有统计学意义(P<0.01),见图4。溶剂组与损伤组比较,H2O2诱导的SH-SY5Y细胞凋亡率差异无统计学意义。
2.4 HNK对Bcl-2/Bax比值的影响损伤组较对照组Bcl-2/Bax比值明显降低(P<0.01),保护组较损伤组比值增高,差异有统计学意义(P<0.01),见图5。溶剂组与损伤组比较,HNK对Bcl-2/Bax比值差异无统计学意义。
2.5 HNK对Caspase-3蛋白表达的影响与对照组相比,损伤组Caspase-3蛋白表达增加,而保护组Caspase-3蛋白表达降低,差异均有统计学意义(P<0.01),见图6;与损伤组比较,溶剂组HNK对Caspase-3蛋白表达的影响差异无统计学意义。
2.6 HNK对ERS的影响损伤组BIP、CHOP及Caspase-12表达上调,差异有统计学意义(P<0.01),提示ERS增加。加入低浓度HNK保护后,ERS相关指标下调,差异有统计学意义(P<0.01),见图7。溶剂组与损伤组比较,HNK对BIP、CHOP及Caspase-12蛋白表达的影响差异无统计学意义。
3 讨论
ERS过度可以干扰细胞正常功能,或通过ERS 相关的凋亡途径引起细胞凋亡,导致疾病的发生。研究[1]表明ERS介导的凋亡信号传导途径可能与多种中枢退行性疾病如PD 的发病有关。HNK是中药厚朴中有效活性成分之一,有研究[11]报道HNK具有抗炎、抗肿瘤和抗氧化的作用。但HNK对神经元ERS的作用尚不十分清楚。本研究主要探究HNK对H2O2诱导神经母细胞瘤SH-SY5Y细胞损伤的保护作用及其可能机制。
Caspase-12是起始Caspase,是ERS的特异性凋亡成员,其诱导Caspase-3激活[12-13]。CHOP是ERS 条件下诱导的转录因子,可引起细胞周期停滞及DNA 损伤,使细胞发生凋亡,已经被广泛视为ERS 的凋亡标志[14]。目前认为CHOP 可以通过下调Bcl-2 的表达而促进ERS 诱导的细胞凋亡。因此通过药物干预后研究Caspase-12和CHOP表达可以初步了解药物对ERS 的作用。
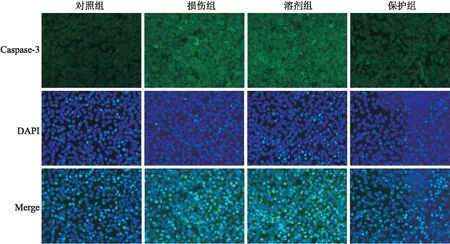
图3 免疫荧光观察SH-SY5Y细胞的Caspase-3表达情况 ×50
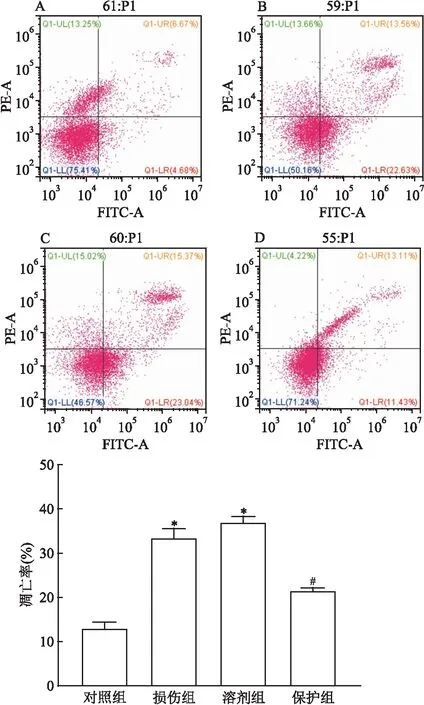
图4 流式细胞术测定SH-SY5Y细胞的凋亡情况
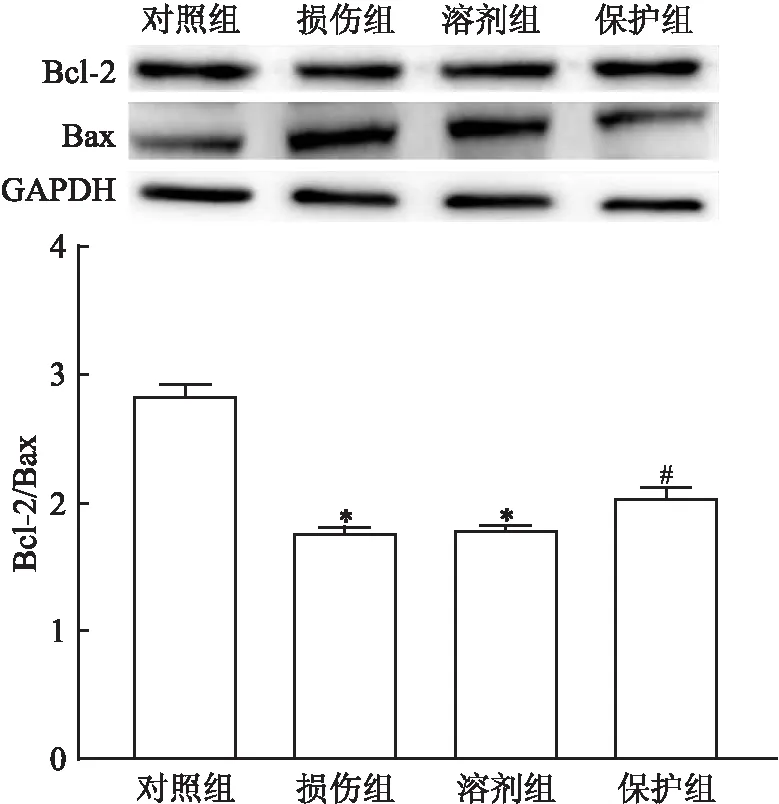
图5 Bcl-2/Bax比值情况
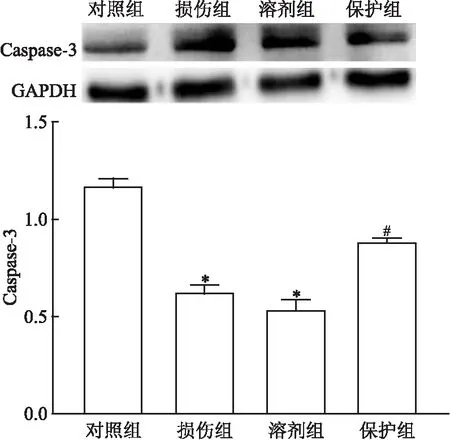
图6 Caspase-3蛋白表达情况
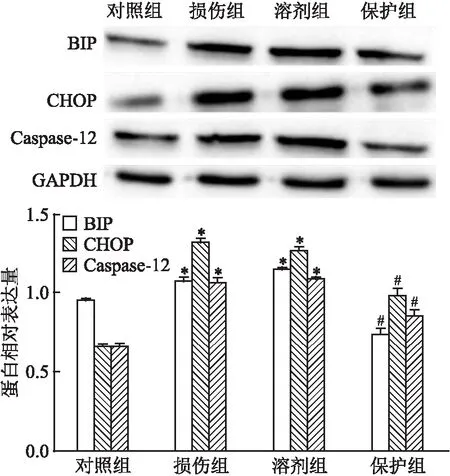
图7 BIP、CHOP及Caspase-12蛋白表达情况
本研究中,与对照组比较,H2O2刺激后造成SH-SY5Y细胞损伤(P<0.01),导致细胞凋亡,同时Bcl-2/Bax比值显著降低,Caspase-3蛋白水平增加(P<0.01),此外BIP、CHOP及Caspase-12蛋白表达升高(P<0.01),提示H2O2刺激的神经细胞ERS损伤模型成功。溶剂组与损伤组比较,HNK对BIP、CHOP及Caspase-12蛋白表达的影响差异无统计学意义,提示溶剂DMSO不会对研究造成影响。与损伤组比较,10 μmol/L HNK保护组凋亡细胞减少,Caspase-3的荧光强度减弱,同时蛋白表达结果也验证了这一结论,提示HNK可以抑制H2O2诱导的SH-SY5Y细胞凋亡。此外,HNK能明显下调BIP、CHOP及Caspase-12蛋白表达,减少SH-SY5Y细胞的凋亡,说明HNK能够抑制H2O2诱导的SH-SY5Y细胞ERS相关的凋亡。
综上,HNK可以在H2O2诱导的神经细胞损伤中发挥保护作用,其机制可能与抑制ERS相关的细胞凋亡有关,因此HNK可能对ERS导致的神经损伤性疾病如PD的防治具有潜在的改善和保护作用。
