慢性肾脏病3-5期患者病情程度与α-Klotho、FGF23及钙、磷相关性研究
2020-10-09程虹李颖霞王小琴
程虹 李颖霞 王小琴
[摘要] 目的 探討慢性肾脏病(CKD)3~5期患者α-Klotho、成纤维细胞生长因子23(FGF23)和钙磷水平的变化情况及CKD病情与α-Klotho、FGF23和钙磷代谢水平的相关性。 方法 选择2018年6—12月在湖北省中医院肾病科就诊的CKD 3~5期患者20例作为CKD组,另选择22名健康人作为正常组。检测两组血清中α-Klotho、FGF23、甲状旁腺激素(PTH)、估算肾小球滤过率(eGFR)和钙、磷水平变化。 结果 CKD组血清磷、PTH及FGF23水平高于正常组,钙及α-Klotho、eGFR水平低于正常组,差异有统计学意义(P < 0.05)。与CKD3期比较,CKD4期及5期患者血清钙、α-Klotho、eGFR水平降低,而磷、FGF23、PTH升高,差异有统计学意义(P < 0.05)。CKD3~5期患者病情程度与磷、PTH、FGF23与呈正相关(r = 0.706、0.963、0.915,P < 0.05),与钙、eGFR、α-klotho呈负相关(r = -0.821、-0.865、-0.718,P < 0.05)。 结论 CKD 3~5期患者骨矿物质代谢紊乱逐渐加重,且病情程度与α-Klotho、FGF23、钙磷水平有密切相关性。
[关键词] 慢性肾脏病;α-Klotho;成纤维细胞生长因子23;钙;磷
[中图分类号] R692 [文献标识码] A [文章编号] 1673-7210(2020)08(a)-0078-04
[Abstract] Objective To investigate the changes of α-Klotho, fibroblast growth factor 23 (FGF23) and calcium and phosphorus levels in patients with stage 3-5 chronic kidney disease (CKD) and the correlation between CKD and α-Klotho, fibroblast growth factor-23 (FGF23) and calcium and phosphorus metabolism. Methods A total of 20 patients with CKD three to five stage who were admitted to the Department of Nephrology of Hubei Provincial Hospital of Traditional Chinese Medicine from June to December 2018 were selected as the CKD group. Another 22 healthy people were selected as the normal group. The serum levels of α-Klotho, FGF23, parathyroid hormone (PTH), estimation of glomerular filtration rate (eGFR) and calcium and phosphorus were measured in the two groups. Results The serum levels of phosphorus, PTH and FGF23 in the CKD group were higher than those in the normal group, and the levels of calcium, α-Klotho and eGFR were lower than those in the normal group, with statistically significant differences (P < 0.05). Compared with CKD3 stage, serum calcium and α-Klotho levels and eGFR in patients with stage 4 and 5 CKD stage decreased, while phosphorus, FGF23 and PTH levels were increased, with statistically significant differences (P < 0.05). The degree of CKD 3-5 stage disease was positively correlated with phosphorus, PTH, and FGF23 (r = 0.706, 0.963, 0.915, P < 0.05), and negatively correlated with calcium, eGFR, and α-Klotho (r = -0.821, -0.865, -0.718, P < 0.05). Conclusion The bone mineral metabolism disorder in patients with stage CDK 3-5 gradually worsened, and the severity of the disease is closely related to the levels of α-Klotho, FGF23 and calcium and phosphorus.
[Key words] Chronic kidney disease; α-Klotho; Fibroblast growth factor-23; Calcium; Phosphorus
慢性肾脏病(CKD)最早是由Bright、Heberden和Abercrombie于19世纪提出[1],主要表现为持续性出现肾脏结构或者功能异常,其病情具有独立、不可逆等特性,可逐渐发展为终末期肾脏疾病(ESRD),导致心脑血管疾病的发生率和死亡率显著升高[2-3]。目前,对于CKD的治疗主要包括调整生活方式,营养治疗,控制蛋白尿,控制血压、血糖、血脂等,若病情发展到有尿毒症临床表现和体征时,可行透析治疗[4]。近年来,关于CKD的研究越来越深入,李颖霞等[5]研究发现血清中成纤维细胞生长因子23(FGF23)的水平与CKD患者肾功能衰竭的程度存在一定的关系。Leone等[6]研究发现高Klotho通过抑制细胞凋亡起到保护肾功能的作用。本研究以CKD中晚期患者為研究对象,通过研究CKD中晚期患者α-Klotho,FGF23及钙磷代谢水平的变化来探讨中晚期CKD与α-Klotho、FGF23及钙磷的相关性,为进一步明确中晚期CKD血管钙化的发病机制及如何治疗提供一定的参考。
1 资料与方法
1.1 一般资料
选择2018年6—12月中国CKD队列-湖北省中医院(以下简称“我院”)分中心20例CKD3~5期非透析患者为研究对象。纳入标准[14]:①年龄18~<74岁;②肾小球滤过率<60 mL/(min·1.73m2)。排除标准:①有严重的合并症,如严重的心功能不全、肝硬化、获得性免疫缺陷综合征、单纯性血尿、器官移植;②由系统性疾病、自身免疫性疾病引起的CKD,如系统性红斑狼疮;③近6个月内使用过免疫抑制剂;④近两年内有肿瘤的化学治疗;⑤妊娠或哺乳期妇女;⑥遗传性肾脏病;⑦正参与临床试验者。根据中国CKD筛查诊断及防治指南[15]的分期指标:G1期[≥90 mL/(min·1.73m2)]、G2期[60~89 mL/(min·1.73m2)]、G3期[30~59 mL/(min·1.73m2)]、G4期[15~29 mL/(min·1.73m2)]、G5期[<15 mL/(min·1.73m2)]。将20例患者分为CKD 3期(11例)、CKD 4期(5例)和CKD 5期(4例)。另选择22名健康人员作为正常组,正常组纳入标准:①社会上招募的健康志愿者;②血常规、尿常规、肝肾功能正常。排除有CKD病史及家族史者。正常组男12名,女10名;平均年龄(48.74±12.36)岁。CKD3组其中CKD3期11例,其中男7例,女4例,平均年龄(51.5±13.03)岁;CKD4期5例,其中男3例,女2例,平均年龄(57.17±10.41)岁;CKD5期4例,其中男2例,女2例,平均年龄(64.58±5.21)岁。两组性别、年龄比较,差异无统计学意义(P > 0.05),具有可比性。本研究经我院医学伦理审查委员会审查通过并批准(批件号:2011[363]),所有患者及家属均签署知情同意书。
1.2 方法
相关生化指标检测:所有患者均空腹抽静脉血5 mL,室温下静置30 min后,3000 r/min离心5 min,吸取上层血清并置于-80℃冰箱中保存备用,采用全自动生化检测仪(贝克库尔曼特AU5800)检测血清中钙、磷、甲状旁腺激素(PTH)及估算肾小球滤过率(eGFR)的含量。
α-Klotho及FGF23水平检测:采用酶联免疫吸附试验法(ELISA)对血清中α-Klotho及FGF23的含量进行测定。首先将α-Klotho和FGF23 ELISA试剂盒(Bio-Swamp,HM10697,HM10784)中的标准品按说明书稀释成1000.0、500.0、250.0、125.0、62.5 pg/mL,绘制标准曲线。然后进行加样、加酶,用封板膜封板后于37℃恒温箱中孵育30 min,然后进行洗涤,加入显色剂,终止反应后,将酶标板置于酶标仪中于450 nm波长下测定各孔的吸光度(OD值),根据浓度曲线对相应样品浓度进行计算。
1.3 统计学方法
采用SPSS 18.0统计学软件进行数据分析。符合正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用t检验;多组间比较采用单因素方差分析,多组均数间的两两比较采用SNK-q检验;相关检验采用Pearson检验。以P < 0.05为差异有统计学意义。
2 结果
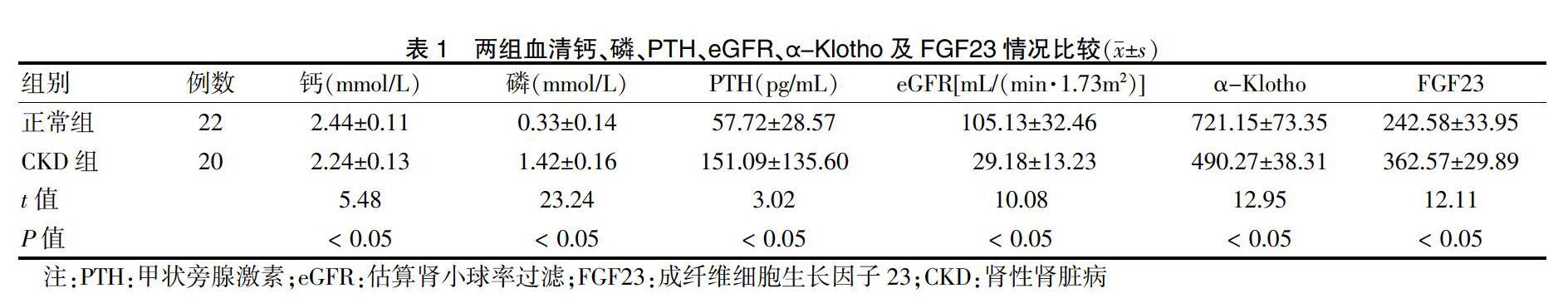
2.1 两组血清钙、磷、PTH、eGFR、α-Klotho及FGF23比较
CKD组血清磷、PTH及FGF23水平高于正常组,钙及α-Klotho、eGFR水平低于正常组,差异有统计学意义(P < 0.05)。见表1。
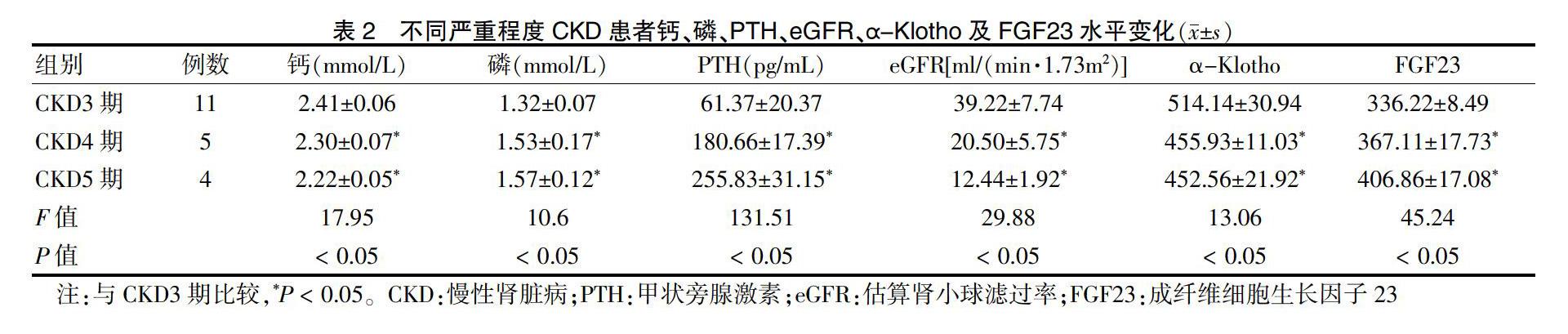
2.2 不同严重程度CKD患者血清钙、磷、PTH、eGFR、α-Klotho及FGF23水平变化
CKD各期患者血清钙、磷、PTH、α-Klotho、FGF23差异有统计学意义(P < 0.05);其中与CKD3期比较,CKD4期及5期患者血清钙、α-Klotho、eGFR水平降低,而磷、FGF23、PTH升高,差异有统计学意义(P < 0.05)。见表2。
2.3 CKD3~5期患者病情程度与α-Klotho、FGF23及钙、磷的相关性
Pearson分析结果显示,CKD3~5期患者病情程度与磷、PTH、FGF23与呈正相关(r = 0.706、0.963、0.915,P < 0.05),与钙、eGFR、α-Klotho呈负相关(r = -0.821、-0.865、-0.718,P < 0.05)。
3 讨论
骨矿物质代谢紊乱是CKD常见并发症,严重影响着患者的生存质量。一项横截面人群研究显示[10],随着患者肾小球滤过率的不断下降,血清中磷的水平也相应的持续性上升。茅宇烽等[16]等发现,CKD患者在CKD 4期后钙磷代谢出现紊乱,钙磷沉积逐渐升高,且这种现象与是原发性肾病还是继发性肾病无关。本研究中,CKD患者血钙、血磷水平与正常人群存在显著差异,且随着CKD的进展,血磷水平不断升高,血钙水平不断降低。
近年来,Klotho基因和FGF23是CKD骨矿物质代谢紊乱的研究热点。FGF23是成纤维细胞生长因子家族的一员,具有调节能量代谢及矿物质代谢的作用[17],生理状态下FGF23能够通过抑制近端肾小管中的钠磷转运体从而促进磷的排泄[5]。Klotho基因,又被称之为衰老基因[18],主要表达于近端和远端肾小管的细胞膜上[19-20]。众多证据显示,CKD的进展与Klotho水平的下降显著相关[18,21]。王君等[22]通过对160例CKD患者进行分析后发现,随着CKD病程的进展,FGF23水平逐渐上升,Klotho水平降低,血清中磷的浓度升高,因此,中晚期CKD患者往往会出现高磷血症,而高浓度的血磷又可以反过来促进FGF23的合成[10]。本研究也同樣观察到,CKD中晚期患者血清中磷、PTH、eGFR及FGF23水平显著增加,钙及α-Klotho水平明显下降。
PTH是由颈部甲状腺旁细胞分泌的一种能使钙磷浓度维持稳定,从而保持机体内环境稳定的多肽类激素[23-24]。Silver等[25]发现,FGF23与PTH的分泌也存在一定的关联,FGF23水平增高可以一定程度上促进PTH的分泌,而高水平的PTH反过来也可以促进FGF23的合成。Hu等[18]实验显示,Klotho蛋白缺失小鼠和CKD受试者表现出相似的疾病表型,提示Klotho蛋白与CKD的致病机制密切相关。正常生理情况下,骨骼分泌的内分泌因子FGF23与肾脏klotho结合后,抑制近曲小管刷状缘2a型及2c型钠磷协同转运体,从而促进磷的排泄[26]。CKD患者,血磷升高,刺激FGF23生成,FGF23抑制PTH及1,25-(OH)2D3的生成,而PTH刺激FGF23及1,25-(OH)2D3的生成,升高的1,25-(OH)2D3反过来抑制PTH的生成,进一步刺激FGF23及Klotho蛋白的产生,间接抑制PTH的生成,由此,形成了骨-肾-甲状旁腺之间的正负反馈轴。研究证实[27-29],Klotho蛋白可以通过抑制NF-κB等炎症因子的表达,抑制PTH的分泌和磷的重吸收,增强FGF23与其受体的结合,从而延缓病情的发展。本研究中,随着CKD病情的发展,肾功能的下降,钙、eGFR、α-Klotho水平逐渐降低,磷、FGF23、PTH的水平逐渐升高。即便在CKD3期,血钙血磷尚在正常范围时,FGF23、α-Klotho已出现异常。故检测FGF23、α-Klotho等对早期诊断CKD 钙磷代谢紊乱有重要意义。
综上所述,中晚期CKD患者血清磷、PTH、及FGF23水平显著增加,钙及α-Klotho、eGFR水平明显下降,并且与CKD病情的严重程度关系紧密。α-Klotho、FGF23、PTH、eGFR及钙、磷可以作为中晚期CKD患者血管钙化的预测指标和潜在治疗靶点。
[参考文献]
[1] Ferenbach DA,Bonventre JV. Acute kidney injury and chronic kidney disease:From the laboratory to the clinic [J]. Nephrol Ther,2016,12 Suppl 1(Suppl 1):S41- S48.
[2] 王海燕.肾脏病学[M].北京:人民卫生出版社,2016:1746-1758.
[3] Go AS,Chertow GM,Fan D,et al. Chronic kidney disease and the risks of death,cardiovascular events,and hospitalization [J]. N Engl J Med,2004,351:1296-1305.
[4] Mikhail A,Shrivastava R,Richardson O,et al. Renal association clinical practice guideline on Anaemia of Chronic Kidney Disease [J]. BMC Nephrology,2017,118(S1):c101-c124.
[5] 李颖霞,程虹,王小琴.FGF23在慢性肾脏病中作用的研究进展[J].中国中西医结合肾病杂志,2018,19(8):741-743.
[6] Leone F,Lofar D,Giqliotti P,et al. Soluble Klotho levels in adult renal transplant recipients are modulated by recombinant human erythropoietin [J]. J Nephrol,2014,27(5):577-585.
[7] 李婉莎,余毅.慢性肾脏病患者钙磷代谢紊乱及其治疗策略[J].世界临床药物,2018,39(3):204-210.
[8] 张宇,陈卫东.慢性肾脏病患者钙磷代谢紊乱的研究进展[J].安徽医学,2017,38(8):1088-1091.
[9] 王丹,巴应贵.慢性肾脏病钙、磷代谢相关影响因素的研究进展[J].世界最新医学信息文摘,2016,16(89):21,187.
[10] Suki WN,Moore LW. Phosphorus regulation in chronic kidney disease [J]. MDCVJ,2016,12(4 Suppl):6-9.
[11] 吴艺青,高银龙,陶静,等.黄芪对慢性肾脏病大鼠钙磷代谢及FGF23-Klotho轴的影响[J].南京中医药大学学报,2018,34(2):118-122.
[12] 王毅.FGF23介导钙磷代谢与慢性肾脏病关系的研究进展[J].世界最新医学信息文摘,2017,17(97):23-24.
[13] 黄泳璋,肖洁.成纤维细胞生长因子23与慢性肾脏病患者肾功能及钙磷代谢的关系[J].中国实用医药,2017, 12(29):41-42.
[14] Yuan J,Zou XR,Han SP,et al. Prevalence and risk factors for cardiovascular disease among chronic kidney disease patients: results from the Chinese cohort study of chronic kidney disease(C-STRIDE) [J]. BMC Nephrology,2017,18(1):23.
[15] 上海慢性肾脏病早发现及规范化诊治与示范项目专家组.慢性肾脏病筛查诊断及防治指南[J].中国实用内科杂志,2017,37(1):28-30.
[16] 茅宇烽,朱淳.慢性肾病钙磷代谢状况分析[J].创伤与急危重病医学,2018,6(5):267-269.
[17] Kuroo M. Endocrine FGFs and Klothos: emerging concepts [J]. Trends Endocrinol Metab,2008,19(7):239-245.
[18] Hu MC,Kuro-o M,Moe OW. Klotho and chronic kidney disease [J]. Contrib Nephrol,2013,180:47-63.
[19] Komaba H,Kaludjerovic J,Hu DZ,et al. Klotho expression in osteocytes regulates bone metabolism and controls bone formation [J]. Kidney Int,2017:S00852538173 01205.
[20] Hu MC,Shi M,Zhang J,et al. Renal Production,Uptake,and Handling of Circulating alphaKlotho [J]. J Am Soc Nephrol,2016,27(1):79-90.
[21] Lindberg K,Amin R,Moe OW,et al. The kidney is the principal organ mediating klotho effects [J]. J Am Soc Nephrol,2014,25(10): 2169-2175.
[22] 王君,姜晓燕,丁秀霞.慢性肾脏病患者血清Klotho蛋白、成纤维细胞生长因-23水平与疾病严重程度的相关性分析[J].国际检验医学杂志,2017,38(15):2079-2081.
[23] 安书强,杨倩,史长生,等.血液灌流串联血液透析滤过改善肾性骨营养不良效果研究[J].武警后勤学院学报:医学版,2013,22(6): 468-472.
[24] 叶坚旭.老年血液透析患者NT-proBNP水平在干体重评估中的临床意义[J].中国医药科学,2020,10(1):292-294.
[25] Silver J,Navehmany T. FGF-23 and secondary hyperparathyroidism in chronic kidney disease [J]. Nat Rev Nephrol,2013,9(11):641-649.
[26] Miyamoto K,Ito M,Tatsumi S,et al. New aspect of renal phos- phatereabsorption:The type IIc sodium-dependent phosphate transporter [J]. Am J Nephrol,2007,27(5):503-515.
[27] 车琳,戴慧莉,严玉澄.Klotho蛋白在肾脏疾病中的研究进展[J].中国中西医结合肾病杂志,2013,14(11):1028-1030.
[28] 李佳,魏善斋,孙杰,等.血液透析患者血清klotho蛋白水平与营养状况的关系[J].中国医药导报,2019,16(34):96-99.
[29] 张宝玉,赵冬,夏维波.成纤维细胞生长因子-23和α-Klotho蛋白在慢性腎脏病中的作用[J].中华骨质疏松和骨矿盐疾病杂志,2015,8(4): 367-373.
(收稿日期:2020-03-24)
