抑制炎症小体活化产物caspase-1对大鼠急性肝衰竭的保护作用
2020-10-09仵永枫张玉林画伟
仵永枫 张玉 林画伟

[摘要] 目的 探討抑制半胱氨酸天冬氨酸特异性蛋白酶(caspase)-1对大鼠急性肝衰竭(ALF)的保护作用。 方法 将60只健康雄性Wistar大鼠体重150~180 g,采用随机数字表法将其分为对照组、模型组和干预组,每组20只。对照组取血清和肝组织;模型组采用大鼠腹腔联合注射1200 mg/kg D-氨基半乳糖(D-GalN)及100 μg/kg脂多糖(LPS)建立ALF模型,并且分别于造模24 h后取血清及肝组织;干预组造模前2 h予大鼠尾静脉注射6 mg/kg caspase-1特异性抑制剂氟甲基酮,造模时同模型组剂量予D-GalN及LPS,造模24 h后取肝组织及血清。肝脏组织进行HE染色观察,并对血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBil)和白细胞介素(IL)-1β进行检测。 结果 HE染色结果提示模型成功。模型组ALT、AST、TBil和IL-1β水平均高于对照组,差异均有高度统计学意义(均P < 0.01),干预组大鼠ALT、AST、TBil及IL-1β水平均低于模型组,差异均有高度统计学意义(均P < 0.01)。 结论 caspase-1所导致的炎症反应是ALF损伤的重要原因之一,有望成为ALF的预测因子和未来的治疗靶点。
[关键词] 急性肝衰竭;炎症小体;氟甲基酮;半胱氨酸天冬氨酸特异性蛋白酶1
[中图分类号] R575.3 [文献标识码] A [文章编号] 1673-7210(2020)08(a)-0008-04
[Abstract] Objective To investigate the protective effect of inhibiting cysteinyl aspartate-specific proteinase (caspase)-1 on acute liver failure (ALF) in rats. Methods A total of 60 healthy male Wistar rats, weighing about 150-180 g, were divided into the control group, the model group and the intervention group by random number table method, with 20 rats in each group. In the control group, serum and liver tissue were collected. In the model group, rats were intraperitoneally injected with 1200 mg/kg D-galactosamine (D-Galn) and 100 g/kg liponolysaccharide (LPS) to construct the ALF model. Serum and liver tissue were collected 24 h after modeling. In the intervention group, rats were injected with 6 mg/kg of thespecific inhibitor of caspase-1, fluoromethylketone by tail vein in the two hours before modeling. The D-GalN and LPS were given to the same dose as the model group during modeling. Serum and liver tissue were collected in the 24 hours after modeling. The liver tissues were observed by HE staining, and serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), total bilirubin (TBil) and interleukin (IL) -1β were measured. Results HE staining results indicated that the model was successful. ALT, AST, TBil and IL-1β levels in the model group were higher than those in the control group, the differences were all highly statistically significant (all P < 0.01), and ALT, AST, TBil and IL-1β levels in the intervention group were lower than those in the model group, the differences were all highly statistically significant (all P < 0.01). Conclusion The inflammatory response caused by caspase-1 is one of the important causes of ALF injury and is expected to be a predictor of ALF and a future therapeutic target.
[Key words] Acute liver failure; Inflammasome; Fluoromethylketone; Caspase-1
急性肝功能衰竭(acute liver failure,ALF)是指由病毒或藥物引起的严重肝功能损害。具有起病急,肝细胞损伤严重,死亡率高的特点[1-2]。
炎症小体是一种由生理和致病性刺激反应而形成的多聚体。炎症小体根据结构特征可划分为核苷酸结合区样受体(nucleotide-binding domain-like receptors,NLRs)(又称作NALP)、黑色素瘤2样受体(melanoma 2-like receptors,ALRs)等。这些受体具有活化半胱氨酸天冬氨酸特异性蛋白酶(cysteinyl aspartate-specific proteinase,caspase)-1家族的能力[3-4]。炎症小体可通过影响caspase-1的活化,对ALF的进展发挥重要的作用。Kim等[5]发现在小鼠ALF模型中,NLRP3基因表达升高,继而caspase-1、白细胞介素(interleukin,IL)-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)基因表达随之明显升高。本研究通过建立大鼠ALF模型,并通过给予caspase-1特异性抑制剂,观察抑制caspase-1对ALF是否有保护作用,期待为防治ALF提供新思路。
1 对象与方法
1.1 实验动物
60只健康Wistar雄性大鼠,清洁级,5周,体重150~180 g。确保无病,体重相近,皮毛光泽,有精神,反应灵活,购买自中国医学军事科学院动物中心,生产许可证号SCXK(军)2009-003。本研究方案在首都医科大学动物伦理委员会审批后实施。于室温20~25℃饲养,标准鼠食,自由饮水,1周后用于实验,实验前禁食12 h。
1.2 主要仪器与试剂
D-氨基半乳糖(D-GalN)(批号:G0500)、脂多糖(LPS)(批号:L2880)购自美国Sigma公司;大鼠血清IL-1β酶联免疫吸附测定(ELISA)试剂盒(批号:ab100768)购自美国abcam公司,Model 550酶标仪(BioRad公司,美国),光学显微镜(Olympus公司,日本)。
1.3 实验动物分组与处理
采用随机数字表法将60只大鼠分成3组:对照组(n = 20),取血清和肝组织;模型组(n = 20),予大鼠腹腔联合注射1200 mg/kg D-GalN及100 μg/kg LPS建立ALF模型,并且于造模24 h后取血清及肝组织;干预组(n = 20):予大鼠尾静脉注射6 mg/kg caspase-1特异性抑制剂氟甲基酮(Z-YVAD-fmk),2 h后予模型组相同剂量的D-GalN及LPS,24 h后取肝组织及血清。
1.4 观察指标及检测方法
1.4.1 病理学检查 取大鼠肝组织,10%福尔马林固定,石蜡包埋,切片,常规HE染色,光镜下进行组织病理学观察。造模成功判断标准参考肝衰竭诊治指南2018版[6]:肝组织内细胞大块坏死(坏死范围超过肝实质的2/3),亚大块坏死(占肝实质的1/2~2/3)或桥接坏死(较广泛的融合性坏死并破坏肝实质结构),伴存活肝细胞严重变性,肝窦网状支架塌陷或部分塌陷。
1.4.2 血生化指标 血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)和总胆红素(total bilirubin,TBil)的测定由首都医科大学佑安医院门诊临床检验中心实施。
1.4.3 ELISA法检测大鼠血清的IL-1β的含量 从-80℃冰箱内取出各组大鼠血清,采用双抗体夹心ELISA法测定大鼠血清的IL-1β的含量,操作过程严格按照说明书进行。
1.5 统计学方法
采用SPSS 16.0统计学软件对所得数据进行分析,计量资料采用均数±标准差(x±s)表示,多组样本均数比较采用One-way ANOVA 分析,组间两两比较方差齐者用LSD-t检验,方差不齐者用Games-Howell法。以P < 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝功能的变化
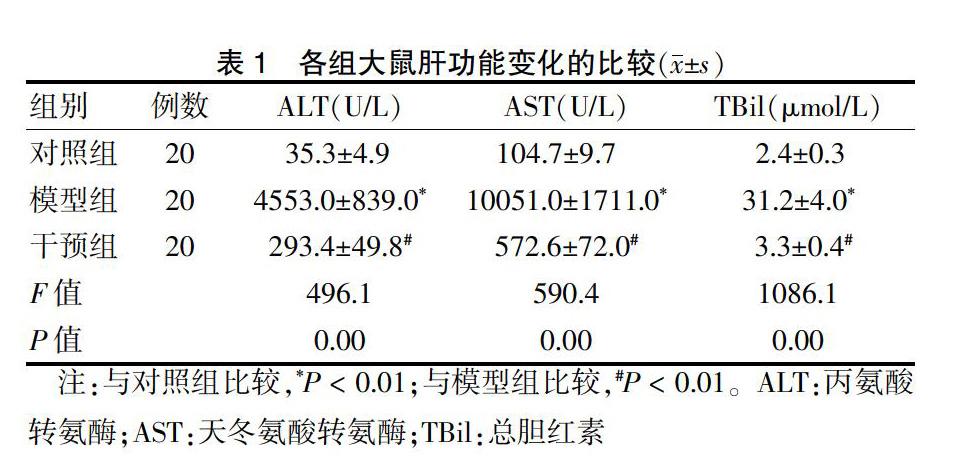
三组ALT、AST、TBil整体比较,差异有高度统计学意义(P < 0.01),模型组ALT、AST、TBil较对照组明显升高,干预组ALT、AST、TBil较模型组明显降低,差异均有高度统计学意义(均P < 0.01)。见表1。
2.2 各组大鼠肝组织病理变化
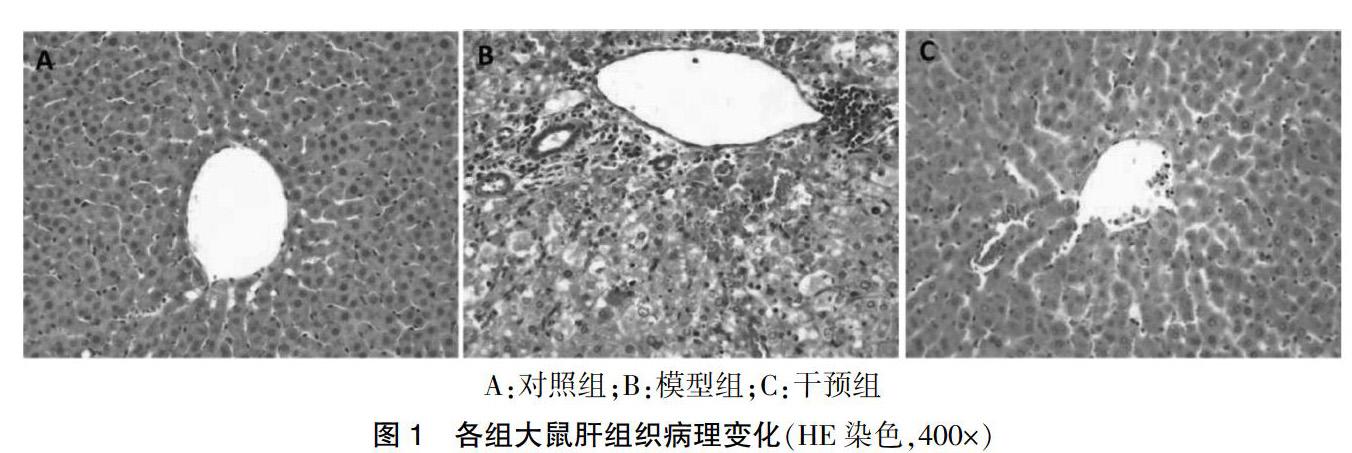
对照组大鼠肝组织小叶结构清晰,肝细胞围绕中央静脉呈放射状排列(图1A)。模型组肝组织中肝细胞坏死严重,镜下可见2/3以上面积的肝细胞坏死,并形成大片、亚大片及桥接坏死(图1B)。而干预组大鼠肝组织中肝细胞无明显的细胞坏死,仅细胞轻度肿胀伴有炎症细胞浸润,肝组织病理损伤减轻(图1C)。
2.3 各组大鼠血清IL-1β浓度的变化
三组IL-1β浓度整体比较,差异有高度统计学意义(P < 0.01),模型组IL-1β浓度较对照组明显升高,干预组IL-1β较模型组明显降低,差异均有高度统计学意义(均P < 0.01)。见表2。
3 讨论
ALF是临床危重疾病之一,治疗效果不理想,预后较差。炎症小体是一组蛋白复合物的统称,目前发现的炎症小体有NLRP1、NLRP3、NLRC4和AIM2等。它们可以激活caspase-1前体成为有活性的caspase-1,进而促进IL-1β及IL-18等前炎症因子的生物学成熟,参与固有免疫反应[7-8]。
目前研究发现炎症小体的活化与多种肝脏疾病相关。有研究认为,NLRP3炎症小体信号通路的激活在非酒精性脂肪性肝炎的发生发展起重要作用[9-11]。在肝脏缺血再灌注损伤的过程中,NLRP3炎症小体的活化加重肝脏的损伤[12]。在D-GalN/LPS诱导的大鼠ALF中caspase-1和IL-18表达升高[13]。LPS和脂肪酸可导致IL-1β的产生和NLRP3的强烈激活[14-15]。此外,诱导caspase-1蛋白水解有保肝的效果[16]。炎症小体在肝纤维化的进展过程中起着重要作用[17]。
caspase-1特异性抑制剂在大鼠急性大脑中动脉阻塞模型以及大鼠急性胰腺炎模型中,均可起到保护作用[18-19]。另外,在LPS诱导的急性肺损伤的鼠模型中,敲除caspase-1基因,可延缓细胞凋亡及炎症细胞的聚集[20]。
本研究采用Z-YVAD-fmk予造模前2 h对大鼠进行尾静脉注射,并予D-GalN/LPS造模24 h后比较观察大鼠肝功能的变化水平,发现干预组肝功能指标水平较模型组显著降低。与此同时,病理变化方面,Z-YVAD-fmk干预后干预组大鼠肝脏病理改变与模型组比较,其肝组织损伤较轻,未出现弥漫性的大片、亚大片及桥接坏死,肝小叶结构存在,小叶和汇管区内的炎细胞浸润明显减少。此外,予大鼠腹腔联合注射D-GalN/LPS后,大鼠血清IL-1β浓度升高,予Z-YVAD- fmk干预后,检测大鼠血清IL-1β浓度,干预组明显低于模型组大鼠血清IL-1β浓度,可证实在本实验中,Z-YVAD-fmk有效抑制了caspase-1的活性。由此可见,抑制caspase-1的活性,可明显改善肝功能、减轻肝脏损伤。故推测炎症小体通路可能参与ALF的病理生理过程,而阻断该途径可对ALF发挥重要的保护作用。
[参考文献]
[1] Buechter M,Manka P,Heinemann FM,et al. Potential triggering factors of acute liver failure as a first manifestation of autoimmune hepatitis-a single center experience of 52 adult patients [J]. World J Gastroenterol,2018,24(13):1410-1418.
[2] Karvellas CJ,Cardoso FS,Gottfried M,et al. HBV-associated acute liver failure after immunosuppression and risk of death [J]. Clin Gastroenterol Hepatol,2017,15(1):113-122.
[3] Sharma D,Kanneganti TD. The cell biology of inflamma-somes:Mechanisms of inflammasome activation and regulation [J]. J Cell Biol,2016,213(6):617-629.
[4] Sakimoto T. Implications of Inflammasomes in Human Diseases:NLRP3 Inflammasome and Animal Models [J]. Cornea,2018,37 Suppl:S86-S90.
[5] Kim SJ,Lee SM. NLRP3 inflammasome activation in D-galactosamine and lipopolysaccharide-induced acute liver failure: role of heme oxygenase-1 [J]. Free Radic Biol Med,2013,65:997-1004.
[6] 中華医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南(2018年版)[J].中华临床感染病杂志,2018,11(6):401-410.
[7] Younossi ZM,Loomba R,Rinella ME,et al. Current and future therapeutic regimens for nonalcoholic fatty liver disease and nonalcoholic steatohepatitis [J]. Hepatology,2018,68(1):361-371.
[8] Mangan MSJ,Olhava EJ,Roush WR,et al. Targeting the NLRP3 inflammasome in inflammatory diseases [J]. Nat Rev Drug Discov,2018,17(8):588-606.
[9] Wree A,Eguchi A,McGeough MD,et al. NLRP3 inflammasome activation results in hepatocyte pyroptosis,liver inflammation,and fibrosis in mice [J]. Hepatology,2014, 59(3):898-910.
[10] Schuster S,Johnson CD,Hennebelle M,et al. Oxidized linoleic acid metabolites induce liver mitochondrial dysfunction,apoptosis,and NLRP3 activation in mice [J]. J Lipid Res,2018,59(9):1597-1609.
[11] Xu B,Jiang M,Chu Y,et al. Gasdermin D plays a key role as a pyroptosis executor of non-alcoholic steatohepatitis in humans and mice [J]. J Hepatol,2018,68(4):773-782.
[12] Kamo N,Ke B,Ghaffari AA,et al. ASC/caspase-1/IL-1β signaling triggers inflammatory responses by promoting HMGB1 induction in liver ischemia/reperfusion injury [J]. Hepatology,2013,58(1):351-362.
[13] 张示渊.IL-18和caspase-1在大鼠急性肝衰竭模型中表达及其意义[J].第三军医大学学报,2011,33(19):2034-2036.
[14] Csak T,Ganz M,Pespisa J,et al. Fatty acid and endotoxin activate inflammasomes in mouse hepatocytes that release danger signals to stimulate immune cells [J]. Hepatology,2011,54(1):133-144.
[15] Ganz M,Csak T,Nath B,et al. Lipopolysaccharide induces and activates the Nalp3 inflammasome in the liver [J]. World J Gastroenterol,2011,17(43):4772-4778.
[16] Menzel CL,Sun Q,Loughran PA,et al. Caspase-1 is hepatoprotective during trauma and hemorrhagic shock by reducing liver injury and inflammation [J]. Mol Med,2011,17(9/10):1031-1038.
[17] Watanabe A,Sohail MA,Gomes DA,et al. Inflammasome-mediated regulation of hepatic stellate cells [J]. Am J Physiol Gastrointest Liver Physiol,2009,296(6):G1248-G1257.
[18] Rabuffetti M,Sciorati C,Tarozzo G,et al. Inhibition of caspase-1-like activity by Ac-Tyr-Val-Ala-Asp-chloromethyl ketone induces long-lasting neuroprotection in cerebral ischemia through apoptosis reduction and decrease of proinflammatory cytokines [J]. J Neurosci,2000, 20(12):4398-4404.
[19] 朱人敏,張晓华,李兆申,等.Caspase-1抑制剂对实验性重症急性胰腺炎的治疗作用[J].解放军医学杂志,2005,30(4):283-285.
[20] Rowe SJ,Allen L,Ridger VC,et al. Caspase-1-deficient mice have delayed neutrophil apoptosis and a prolonged inflammatory response to lipopolysaccharide-induced acute lung injury [J]. J Immunol,2002,169(11):6401-6407.
(收稿日期:2020-03-12)
