基于非线性动力学的锂沉积形貌模拟与预测
2020-09-29林振康乔耀璇王伟袁洪樊铖孙克宁
林振康,乔耀璇,王伟,袁洪,樊铖,孙克宁
(1 北京理工大学化学与化工学院,北京100081; 2 北京理工大学前沿交叉科学研究院,北京100081;3清华大学化学工程系,北京100084)
引 言
商用锂离子电池正式问世以来广受关注,能量密度逐年增长,近些年已接近极限[1−2]。为了满足日益增长的移动储能需求,开发高能量密度的电源体系势在必行。金属锂具有极高的理论比容量(3860 mA·h/g)和极低的还原电势[-3.04V( vs.标准氢电极)],是最具潜力的新型负极材料之一[3−4]。然而金属锂在沉积过程中容易生成树枝状形貌[5−7],不仅导致金属锂与电解液的副反应增多,库仑效率下降,而且容易刺穿隔膜造成电池短路,引发安全问题。枝晶问题成为锂金属负极工程化应用的最大障碍,对枝晶生长机制的认知是解决这一问题的关键。
锂沉积过程涉及多种物理过程,影响因素复杂,对界面原位监测的难度大。为探究锂枝晶的生长机理,国内外研究者将有限元分析的方法应用于这一领域,取得了一些初步的结论。Aryanfar 等[8−9]认为锂枝晶的生长是在Li−Li 结合能与能垒影响下的热力学结果。他们采用粗晶Monte Carlo 模型(CG−MC)模拟了锂离子在溶剂中以及锂原子在电极表面的迁移过程,认为锂原子在界面上的迁移能力对沉积形态起关键作用,并成功预测了脉冲充电时枝晶长度[9]。Ely等[10]通过相场理论描述了异相成核时的晶核生长动力学以及基底对沉积形貌的影响,考虑了体系转化自由能、电解质−枝晶界面能以及黏附功。结果表明,集流体对锂的润湿性影响沉积形貌,较小的接触角和电流密度有利于获得均匀的锂层和较高的库仑效率。Chen 等[11]建立了热力学一致的相场模型,考虑非线性反应动力学,讨论了电压与电极表面对枝晶生长的影响。Zhang 等[12]讨论了SEI 膜的不均匀性诱导枝晶生长的机制,认为不均匀的SEI引起的表面沉积速率差异是枝晶形貌产生的重要原因之一。张睿等[13−14]采用相场理论,对三维骨架锂金属负极进行了建模,定量分析和探究比表面积对金属锂沉积过程的作用机制,发现了比表面积调控金属锂沉积的两阶段作用机理,并提出了基于比表面积参数的三维骨架负极设计与优化方向。上述模型在一定程度上解释了枝晶生长的原因,但影响锂沉积的因素是复杂的,除了界面能、表面SEI 膜[15−16]的不均匀性之外,锂离子在电解液中的传质[17−18]、锂离子溶剂化与脱溶剂化[19−20]、电极/电解液界面的电荷转移[21]、初始表面形状[22]以及温度[23]等均对沉积形貌有重要的影响。从某种角度来说,电化学性质对沉积形貌的影响更广泛、更本征,而目前这方面的报道较欠缺。
本文基于三次电流[24−26]理论,全面考虑了电迁移、扩散、非线性反应动力学等电化学特性,通过有限元方法模拟三次电流模型,分析了操作条件、电化学性质对沉积均匀性的影响,并根据模拟结果总结了锂沉积倾向的判据。
1 模拟与计算
1.1 模型描述与假设
本模型基于电化学性质建模,考虑了锂离子在电解液中的扩散、电迁移以及在电极/电解液界面的电化学反应对浓度场与电化学反应的影响。采用Fick第二定律来描述锂电池工作时内部电解质溶液中的锂离子的扩散,以Nernst−Einstein 方程和电中性 假 设 描 述 电 迁 移[24−26],通 过 浓 度 依 赖Bulter−Volmer方程[27−28]描述在电极/电解液界面发生的电化学反应。同时,制作工艺、锂成核[29]等因素导致电极表面凸凹不平,这种微米级甚至是纳米级的凸起在只有几十微米的电解液空间中不可忽略,会对体系的电场分布产生很大影响。表面性质的影响在物理建模时加以考虑,如图1所示。
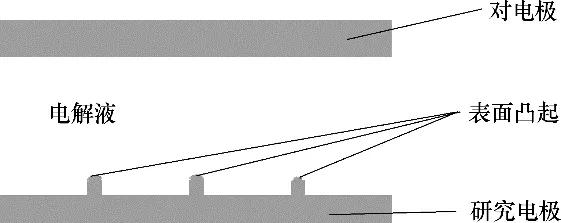
图1 锂对称电池二维模型示意图Fig.1 Two−dimension scheme of Li symmetric cell
为了简化计算过程,本文的其他假设如下:(1)忽略欧姆电阻与副反应的热效应,电池内部的温度不随时间变化;(2)忽略外部场导致的对流传质;(3)忽略金属锂与电解液之间的副反应;(4)忽略集流体电阻。
1.2 模型方程
1.2.1 质量守恒与电荷守恒 在电场作用下,电解液中阴阳离子定向移动产生的离子传质通量[28]可由式(1)表示
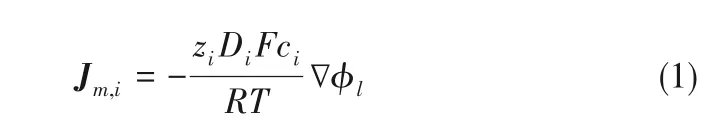
在电解液的浓度梯度驱动下,锂离子的扩散通量[28]可由式(2)表示

则,包含Nernst−Planck 方程的电解液电流密度可表示为式(3)
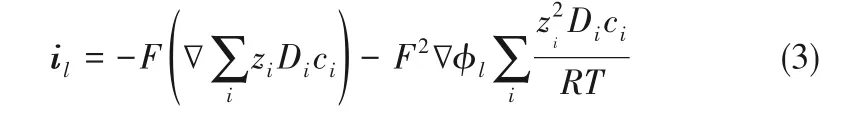
当满足电中性假设时,∑izici= 0。结合式(1)~式(3),电解液中锂离子浓度随时间的变化则可表示为式(4)

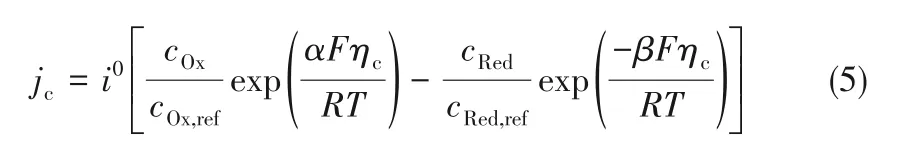
1.2.2 电极反应动力学 在电极电解液界面发生氧化还原反应,伴随着电流的产生、离子浓度的变化、电极表面发生变形,电极表面的电流密度用来表示发生电化学反应的速率,其动力学过程由Bulter−Volmer 方 程 表 示,式(5)[28,30]表 示 阴 极 电 流密度
i0与离子浓度、化学反应常数相关,式(6)表示

阴极过电位可由式(7)表示
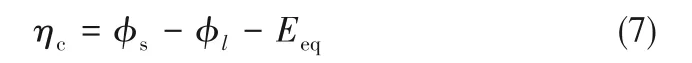
1.2.3 初始条件与边界条件 锂在电极表面发生沉积引起电极表面的变形,带来电极/电解液界面的变化。电极表面的变形速度由式(8)表示

在锂电池中,初始时刻,电解液中的离子浓度处处相等,电解液中的初始电位为0。采用恒电位充电对应的边界条件为阴极电极电位与阳极电极电位互为相反数。
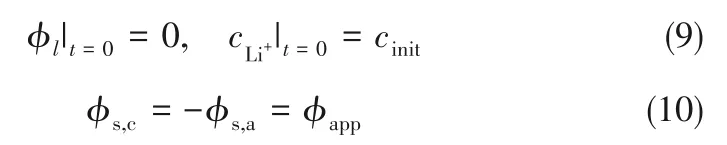
1.3 模型参数与计算
本文模型使用基于商业有限元软件COMSOL Multiphysics 5.4 的三次电流模块和变形几何模块进行求解。相关参数如表1所示。
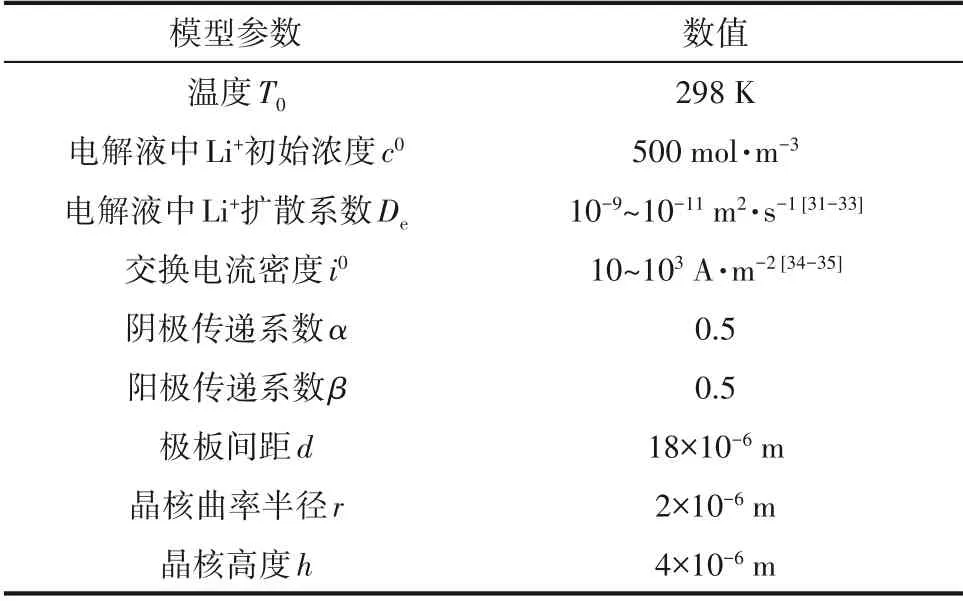
表1 仿真参数表Table 1 Parameters in the model
2 结果与讨论
2.1 操作电流对电极过程的影响
电池恒流充放电时,电极/电解质界面处的电化学反应使电极附近的锂离子浓度发生变化,而在电解质中锂离子扩散能力有限的情况下,溶液内部产生了浓度梯度,电势梯度也随之改变。图2(a)~(c)展示了外电流密度为80、400、720 A·m−2时电解液中锂离子的浓度分布。当电流较小时,体系中锂离子的浓度分布窄,浓差极化小;当电流升至720 A·m−2时,电解液本体中的锂离子仍接近初始浓度,而电极表面的锂离子浓度几乎降至0,晶核顶部与底部浓度相差5 倍以上。图2(d)~(f)展示了外电流密度为80、400、720 A·m−2时的电解质电位分布,规律与浓度分布一致。由于浓度分布、电位分布的共同影响,导致锂在电极表面不同位点的沉积速率不同,最终演化为沉积形貌的差异。如图2(a)、(d)所示,当外电流密度为80 A·m−2时,锂在晶核的顶部与底部的沉积速率几乎相同,在一定时间之后晶核的形貌未发生变化;图2(c)、(f)则显示了外电流密度为720 A·m−2时锂的沉积形貌逐渐向针状演化,这是因为晶核顶部的生长速率远高于底部,呈现出顶端生长的状态。
Butler−Volmer 方程[式(5)]揭示了局部沉积速率与浓度、过电位之间的定量关系。局部沉积速率,也就是局部电流密度,与局部浓度正相关,与过电位的指数函数呈正比。即,局部电流密度的差异并不是完全由浓度差决定的,过电位的差异也促进了不均匀沉积。
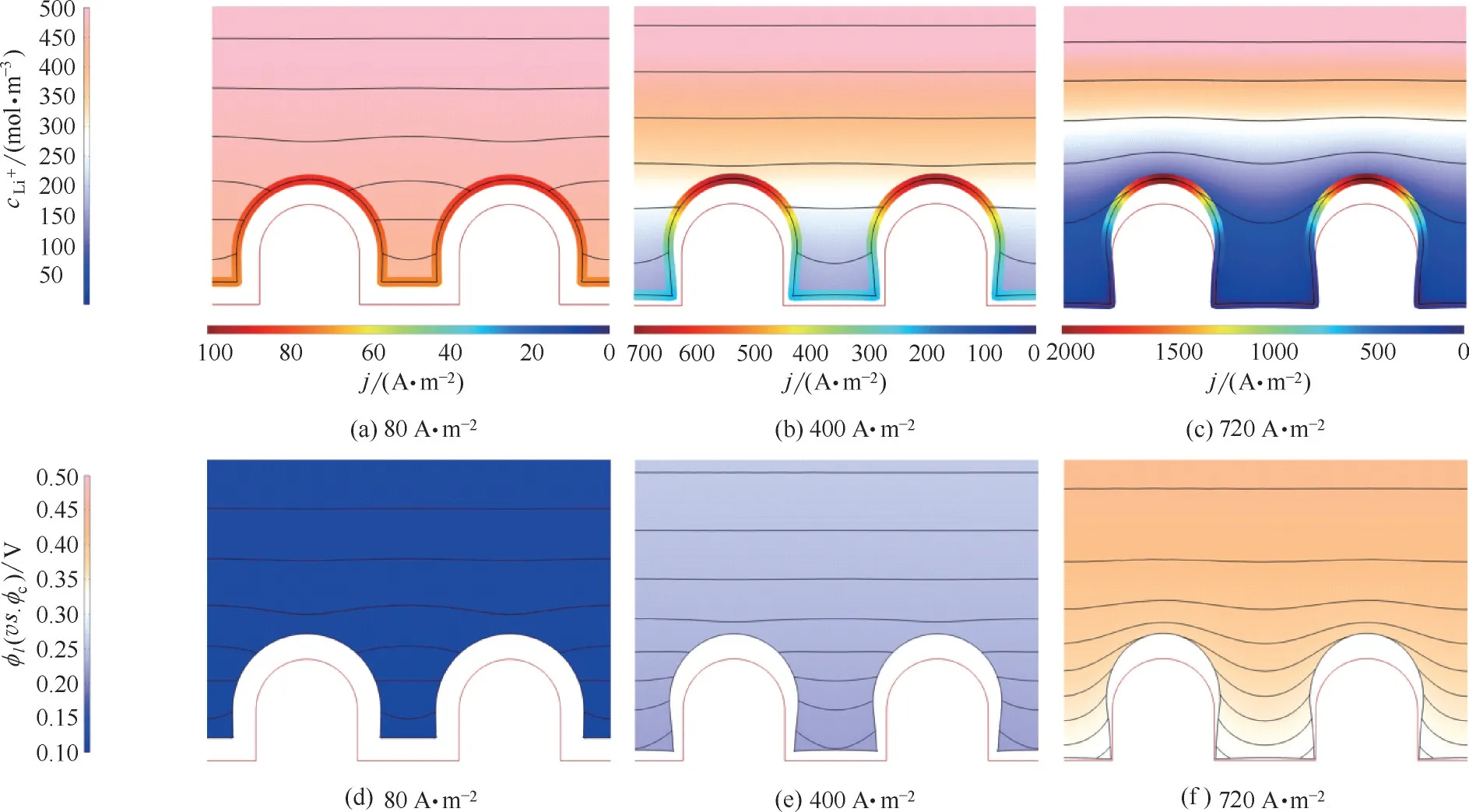
图2 不同外加电流时,电解液的浓度与电位分布Fig.2 Distributions of Li+ion concentration and potential at different currents
为了表征浓度、过电位对沉积形貌的影响权重,定义不均匀系数fu,j、fu,c、fu,η(分别表示局部电流密度、局部浓度、局部过电位的不均匀性,fu,j由Butler−Volmer 方程推导而来,fu,j= fu,cfu,η),如式(11)~式(13)所示。
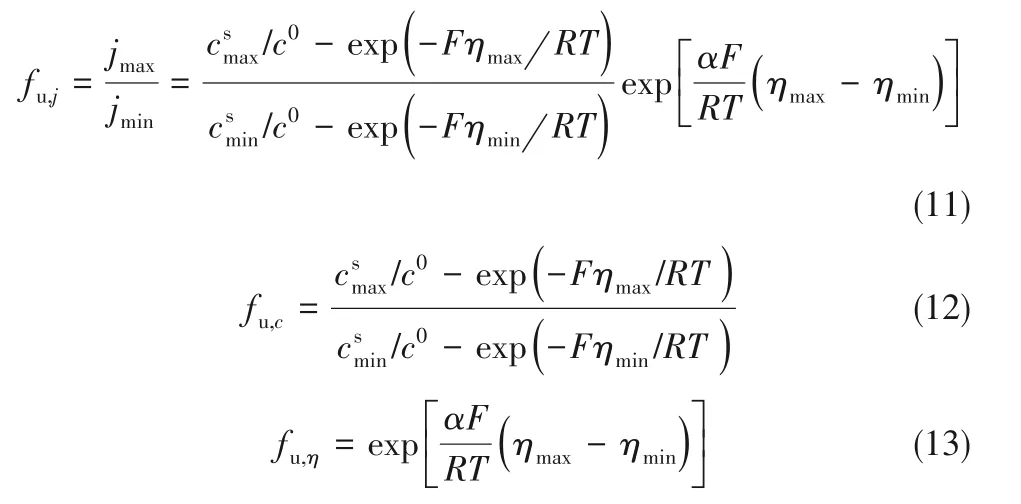
根据物理模型仿真得到的不同操作电流下的不均匀系数,如图3(a)所示。若操作电流较小,锂离子在电解液中的扩散速率与电化学反应导致的电极表面附近锂离子浓度变化速率相当,电解液与电极表面附近的浓度不均匀度fu,c小;图2(a)、(d)所示的外加电流80 A·m−2即为此类情况。若操作电流较大,锂离子在电解液中的扩散速率限制了电极表面附近的锂离子浓度变化速率,电解液与电极表面附近的浓度不均匀度fu,c大,电势不均匀度fu,η也随之升高,电极表面不同位点的生长速率差异较大,顶端生长效应明显;图2(c)、(f)所示的外加电流720 A·m−2即为此类情况。
显然,浓度和过电位共同决定电流密度的均匀性,任一项的不均匀都将导致锂的不均匀沉积。图3(a)所示的不均匀度随外加电流的变化趋势,能较好地反映如图2所示的不同条件下的沉积形貌。值得注意的是,图3(a)的不均匀度为根据模拟结果而计算得到的,其数值随体系性质、操作条件而变化,不属于体系的本征特性,不具备预测功能。而图3(b)所示的阴极极化曲线只与电化学反应速率常数、扩散系数、电解质浓度等性质有关,反映了体系的本征性质。对于一个确定的电池体系来说,实际电流与电极电压一一对应,阴极极化曲线体现的正是体系过电位与电流密度之间的关系。随着过电位的增加,电流密度随之增长,曲线上每个点即对应一个操作条件。从图3 中可以看出,80 A·m−2的外加电流对应极化曲线中接近原点的位置,此时体系主要为电化学极化控制,对应不易生长枝晶的条件;400 A·m−2的外加电流对应极化曲线的中间位置,此时体系为电化学极化、浓差极化混合控制,有向枝晶形貌发展的趋势;720 A·m−2的外加电流对应极化曲线的平台位置,此时,电流密度接近完全浓差极化时的电流密度(Imax),电解质中离子传递过程受限,在电极表面形成较大浓度梯度,体系为浓差极化控制,电极表面高点与低点之间产生浓度、电位差异并加剧沉积电流不均匀性,对应枝晶状沉积。由此可见,极化曲线的不同区域可以在一定程度上反映锂的沉积形貌,具有一定的预测作用。操作电流越接近Imax,对金属锂的均匀沉积越不利,越倾向于枝晶形貌;操作电流越小,锂在不同位点的生长速率越一致,越倾向于非枝晶形貌。

图3 操作电流对沉积过程的影响Fig.3 Influence of applied current
2.2 扩散系数对电极过程的影响
扩散系数决定了锂离子在电解液中的扩散、迁移速率,也决定了电极表面附近因电化学反应而产生的浓度梯度与溶液本体中的离子浓度达到平衡所需的时间。当电极发生阴极反应时,溶液中的锂离子被还原为金属锂沉积在电极表面,使界面处电解质浓度下降,更远处的离子在电场和浓度场的驱动下定向移动,形成的电解质浓度梯度与电解质溶液传递锂离子的能力负相关。若扩散系数较小,在浓度场驱动下的离子传质速率比反应生成/消耗离子的速率慢,将加剧电极表面附近的浓差极化;若扩散系数较大,离子液相传质的速率比反应速率快,有利于削弱电极表面附近的浓差极化,使电极表面附近的浓度场、电场更加均匀。扩散系数对浓度场与电场分布的影响,也将影响到锂离子的沉积形貌。
图4(a)~(c)显示了扩散系数为1×10−9、1×10−10、1×10−11m2·s−1时电解液内的浓度分布、电极表面的电流分布以及锂沉积的形貌。从图4 中可以看出,锂离子传质能力的差异使体系表现出不同的沉积形貌趋势。如图4(c)所示,当电解质溶液锂离子扩散系数较小时,电解质传导锂离子能力弱,离子扩散以及电迁移过程主导了电极动力学过程,电极/电解液附近浓度梯度、边界层区域大,则晶核顶部与底部的锂离子浓度、电势差异较大,导致了顶端生长速率远大于底端,促进了枝晶形貌的生成。
图4(d)展示了不同扩散系数时的浓度、电场与电流不均匀度,印证了图4(a)~(c)的沉积倾向。根据不同传质能力体系的极化曲线[图4(e)],当电解液传质能力较弱时,体系能达到的最大电流密度越小,而且电流密度更加容易达到饱和,在这种情况下金属锂沉积极度不均匀、耐过充能力弱,安全性与功率均不如传质能力强的电解质溶液体系。
常见的锂电池液态电解质De为10−12~10−10m2·s−1[31−33];而金属锂负极与电解液反应生成的固态界面层,其De在10−16~10−12m2·s−1[36−38]。固态界面层的生成使锂离子在电极表面附近的传质能力显著降低,极大地诱导了枝晶的生成。因此,提高电解质溶液的传质能力是锂金属负极工业应用的关键问题之一。
2.3 交换电流密度对电极过程的影响
在电极反应中,交换电流密度(i0)体现了电化学反应的本征速率。过电位是电化学反应的推动力,过电位越小表明电极反应更接近平衡状态。锂电极上正向的阴极电流与反向的阳极电流同时存在,如果反应的i0越大,其电极电位越接近平衡电极电位,此时反向的阳极电流产生的影响不可忽略,现象上体现为电流密度对电位、浓度更敏感。当浓度、电位分布不均匀时,更接近平衡电极电位意味着电极表面的电流密度浮动更大,造成不均匀沉积。
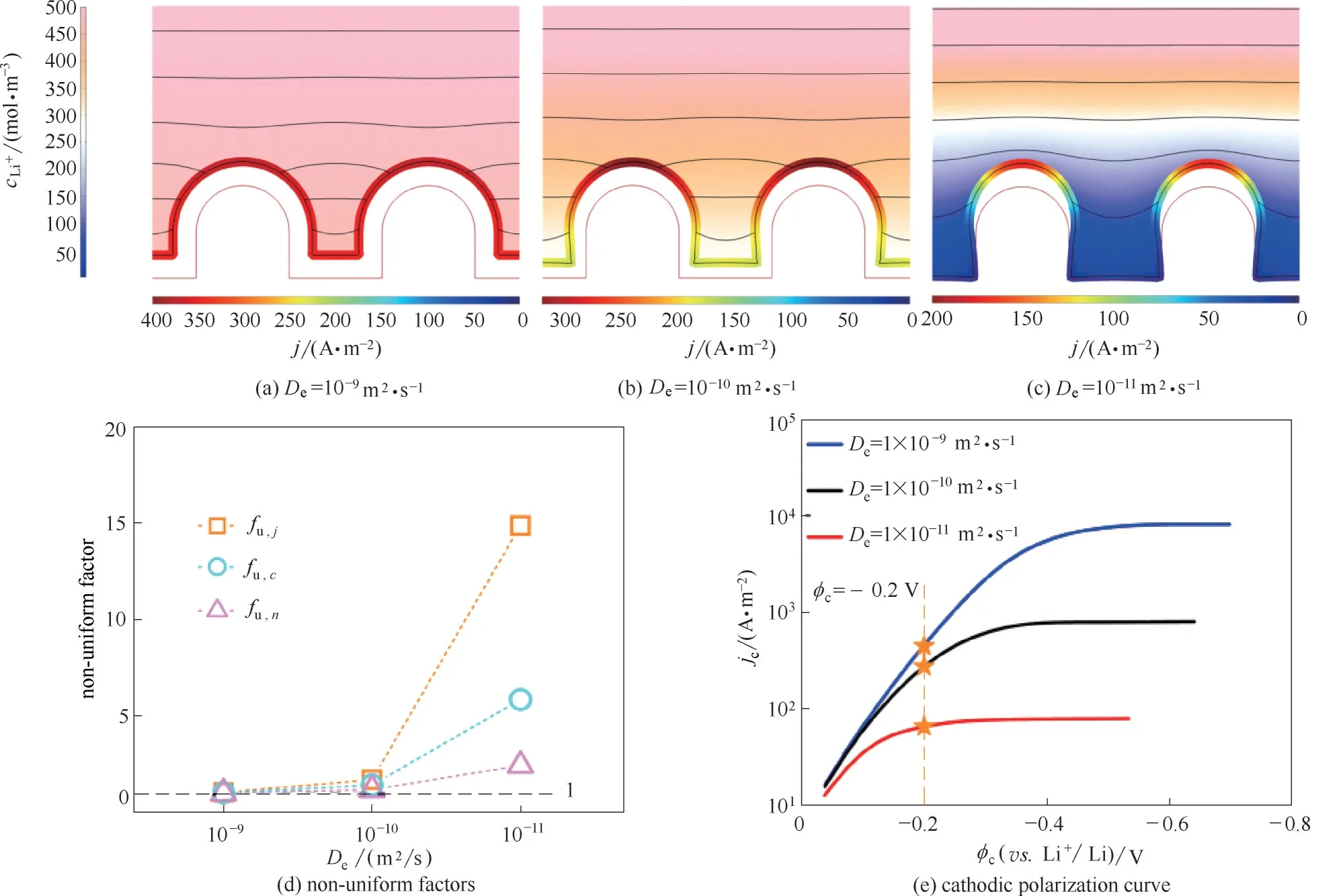
图4 i0为10 A·m−2时不同De体系恒电位沉积模拟Fig.4 Potentiostatic simulations of cells with different De and the same i0 of 10 A·m−2
通过对不同交换电流密度体系进行仿真,当施加相同操作电流密度时,电解液中浓度梯度与电位梯度均较为缓和,图5(a)~(c)分别表示i0为10、200、1000 A·m−2时的沉积形貌。当电极过电位较大时,exp(−Fη/RT)≪cs/c0,fu,c≈csmax/csmin,由于操作电流远未达到Imax电解液中的离子浓度更加均匀,fu,c与fu,η均接近1,晶核顶部与底部的沉积速率接近,图5(a)即为这种情况。而如果当电极电位接近平衡电极电位时,此时exp(−Fη/RT)≈cs/c0,则fu,c≫csmax/csmin,相比之下不均匀系数急剧增加,沉积形貌表现出针状生长,如图5(c)所示。
图5(d)展示了不同交换电流密度体系的不均匀度,虽然溶液中Li+浓度差异不大,但更大的i0使过电位接近0,会使fu,c增大,在这种情况下,仍会产生不均匀电流。图5(e)包含不同i0体系的极化曲线,可以看出,随着i0的增大,极化曲线整体向平衡电位方向移动,沉积电流对反应条件更加敏感,从而形成枝晶形貌。据文献[34−35]报道,Li+/Li 的交换电流密度为5~10 A·m−2,这一数值与扩散系数(10−12~10−10m2·s−1)[31−33]相比不匹配,因而降低交换电流密度是另一个提升锂沉积均匀性的方向。
2.4 极化曲线预测锂沉积形貌
图6总结了扩散系数、交换电流密度对浓度、电场、局部电流密度不均匀性的影响。当i0较小时电化学过程受限,随着扩散系数减小,电极表面的浓度与电势的差异变得越来越明显,此时过电位与浓度差异共同导致不均匀电流;当i0很大时,过电位差异不明显,但仍然存在很大电流差异,这是因为电位接近平衡电极电位其阴极极化中的阳极电流不可忽略,还原反应与氧化反应的速率接近,溶液中更低的离子浓度导致还原电流减小,使净电流随浓度变化率增加。
由此可以看出,当扩散过程受限而电化学过程不受限时,电极局部电流密度随浓度差异的变化幅度增大,诱导枝晶形貌沉积;而当电化学过程受限、传质过程不受限时,局部电流密度对浓度、电场反应不敏感,表面沉积速率相当,诱导非枝晶形貌沉积。
更大的电解液离子扩散系数有利于提升电池体系最大沉积电流,决定了沉积电流的上限Imax,更小的交换电流有利于降低电化学反应对化学环境的敏感性,有利于保持锂沉积过程中的稳定性、弱化电解质浓差导致的不均匀沉积行为。动力学参数与沉积均匀性的联系可通过极化曲线来反映、预测。

图5 De为10−10 m2·s-1时不同i0体系恒电流沉积模拟Fig.5 Galvanostatic simulations of cells with different i0 and the same De of 10−10 m2·s-1
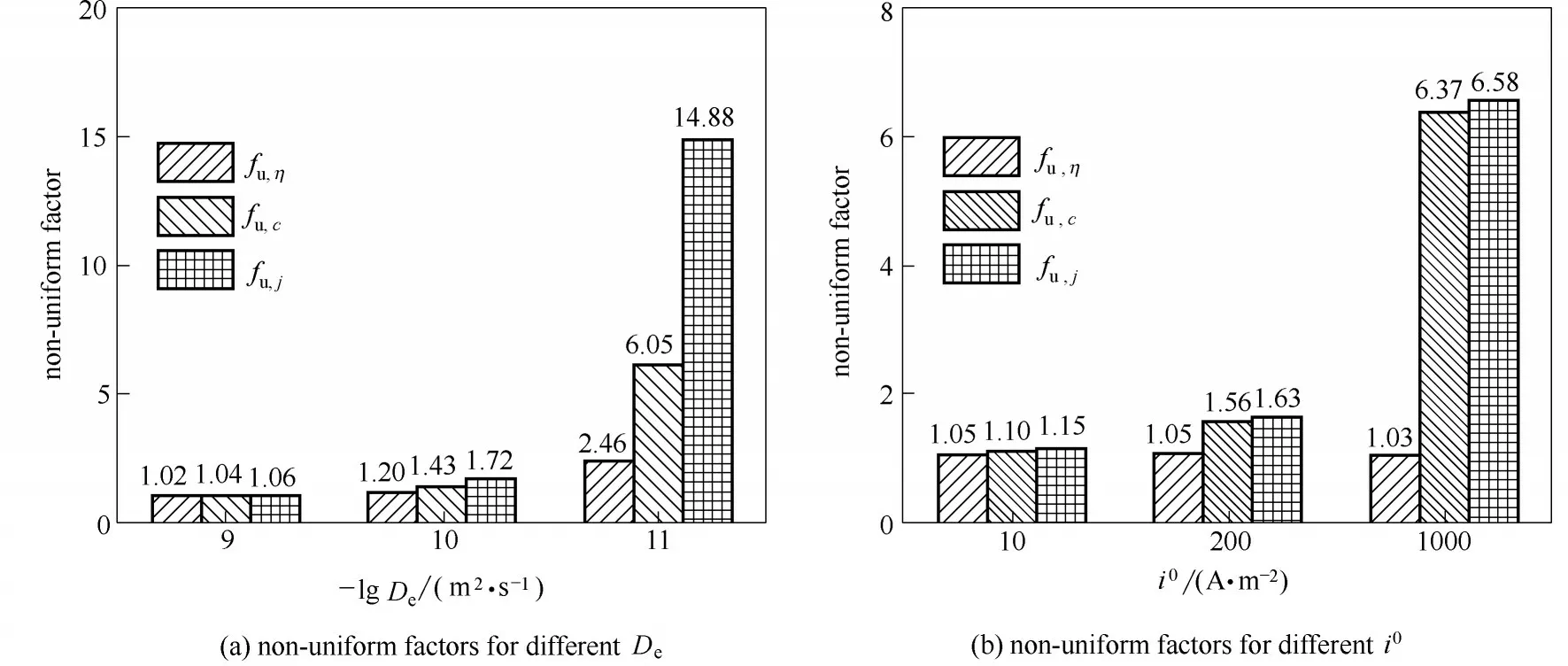
图6 不均匀电流影响因素Fig.6 Factors in non−uniform current density
如图7 所示,通过极化曲线能够对沉积形貌进行预测。传质与反应的相对关系对电解液中的浓度分布有很大影响[39],不发生浓差极化时,体系中锂离子浓度均匀,表现为均匀沉积,极化曲线可用于判断电极极化的状态。当处于电化学极化状态时dlgjc/dηc为常数,而当发生浓差极化时,由于浓度项的变化使得dlgjc/dηc逐渐减小,体现在极化曲线(lgjc−ηc)即为斜率。中部斜直线段即表示不发生浓差极化的操作区域,而过电势较大区域的弧线则表示浓差已对锂沉积产生影响,体现为不均匀沉积,与本文观测到的模拟结果均相符。极化曲线的平台区,电极过程接近完全浓差极化,当操作条件接近在此处时,电解液锂离子浓度分布极度不均匀,极易诱导枝晶。此外,当曲线接近平衡电极电位时,界面反应对浓度、电位敏感,相同的浓度差异下,更易诱导枝晶。大量已报道的实验结果与本文模拟的枝晶生长趋势与规律一致[14,39−40]。因此在实际操作中,既要降低界面反应的敏感性,也要避免溶液中形成较大浓度梯度,因此将操作条件控制在极化曲线的中间斜直线区域有望减缓或抑制枝晶的生成,此区域越宽也意味着对应体系具有更宽的均匀沉积操作窗口。
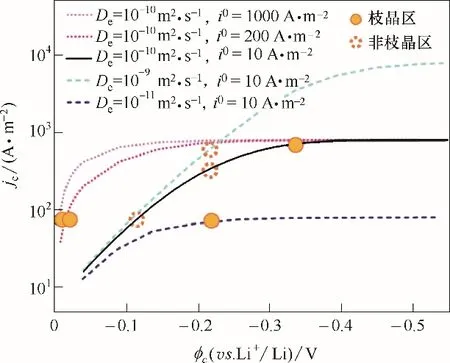
图7 极化曲线Fig.7 Polarization curve
3 结 论
本文基于非线性动力学,采用数值模拟的方法研究了操作电流、锂离子扩散系数、交换电流密度对锂沉积均匀性的影响,确定其均匀沉积的判据。研究结果表明:
(1)操作电流密度较大时,锂沉积受传质过程控制,电解液中不均匀的浓度场和电场极易诱导枝晶形貌。
(2)电解液锂离子扩散系数越大,电极表面附近的浓度场、电场越均匀。提高电解液锂离子扩散系数有助于提升锂沉积的均匀性。
(3)交换电流密度越大,极化过电位则越小,电化学反应对浓度更加敏感,倾向于形成枝晶。减小交换电流密度能够减弱电化学反应对微观化学环境的敏感性,从而抑制枝晶生长。
(4)极化曲线有助于预测锂的沉积形貌。当沉积操作条件处于极化曲线斜直线区间时,体系倾向于均匀沉积,此操作区间越大,越不容易形成枝晶。
符 号 说 明
cOx,cOx,ref,cRed,cRed,ref——分别为氧化态浓度、氧化态参比浓度、还原态浓度、还原态参比浓度,mol·m−3
ci,cs,c0——分别为i 离子的浓度、电极/电解质界面浓度、电解液中Li+初始浓度,mol·m−3
De,Di——分别为Li+、离子i在电解液中扩散系数,m2·s−1
Eeq——反应平衡电极电位,V
F——法拉第常数,C·mol−1
fu,c,fu,j,fu,η——分别为浓度、电流、过电位的不均匀度
GR——化学反应生成i离子的速率,mol·m−3·s−1
i0——交换电流密度,A·m−2
iapp——操作电流密度,A·m−2
il——电解液电流密度(矢量),A·m−2
Jm,i,Jd,i——分别为离子i 迁移通量和扩散通量(矢量),mol·m−2·s−1
j——电极的局部电流密度,A·m−2
jc——阴极界面电极侧电流密度,A·m−2
k——化学反应常数
MLi——锂的摩尔质量
n——电极边界的法矢
R——气体常数,J·mol−1·K−−1
T——热力学温度,K
vn——沿电极边界法向的变形速度,m·s−1
z——参与反应电子数
zi——i离子带电数
α,β——分别表示阴极、阳极反应的传递系数
η——过电位,V
ηc——阴极过电位,V
ρLi——金属锂的密度,kg·m−3
φs,φl,φc——分别为电极电势、电解液电势、阴极界面电极侧电势,V
下角标
app——操作条件
c,a——分别为阴极、阳极过程
max,min——分别为界面参数的最大值、最小值
