合成生物学方法改造电活性生物膜研究进展
2020-09-29徐静由紫暄张君奇陈正吴德光李锋宋浩
徐静,由紫暄,4,张君奇,陈正,吴德光,李锋,4,宋浩,4
(1 天津大学化工学院,天津300072; 2 天津大学合成生物学前沿科学中心和系统生物工程教育部重点实验室,天津300072; 3 天津大学化工协同创新中心合成生物学研究平台,天津300072; 4 天津大学青岛海洋工程研究院,山东青岛266000; 5 茅台学院,贵州仁怀564501)
引 言
能源危机和环境污染已经成为当前社会两大焦点问题。 多用途生物电化学系统(bioelectrochemical systems, BES)作为绿色新能源生产方式实现了很多应用[1−3],如用于从有机废物和生物质中获取生物电能的微生物燃料电池(microbial fuel cell,MFC)[4−5]、生产有价值化学品的非平衡电发酵[6−7]、微生物电解制氢电池[8−9]用于二氧化碳固定以及生物材料生产的微生物电合成[8−9]等。然而,用于生物电化学催化剂的电能细胞群体的胞外电子传递(extracellular electron transfer,EET)效率低,严重制约了BES 系统的实际应用。因此,开发具有高效EET能力的电能细胞是解决问题的关键。
电能细胞在发挥功能过程中普遍以群体形式出现,通过单个细胞分泌的黏附素、多糖和DNA 等聚合物在细胞间相互交联形成导电细胞群体,即电活性生物膜[10−12]。在自然条件下的电活性生物膜往往表现出厚度薄、生物量少以及结构不稳定等缺点,进而导致胞外电子传递效率低下。因此,合理地改造电能细胞,增强电活性生物膜的导电能力是提高胞外电子传递的重要方法之一。
本文围绕利用合成生物学策略对产电菌进行工程改造以形成高效电活性生物膜这一目标,系统综述了近五年国际上最新研究成果。并通过解析多种基因对生物膜形成的调控、单个细胞在生物膜形成过程中扮演的角色以及生物膜与电极之间的电子传递途径,为未来高效电活性生物膜的设计构建、改善微生物的电催化应用提供思路。
1 生物膜的形成过程和电子传递机制
通常,微生物电催化有三个连续过程:(1)在电能细胞内部生物催化过程,通过氧化还原反应消耗底物进而产生电子。(2)通过不同途径跨膜方式实现电子向胞外传递。(3)阴极或阳极上的电催化过程。电极需要为微生物的生长和营养供应提供良好的环境,而微生物应该能够运输大量的细胞外电子,以便在电极上进行快速的氧化还原反应。在这种情况下,微生物电催化过程要求微生物和电极要有高强度的电子传递效率,电极上能否形成高电活性生物膜在促进微生物电催化方向上具有重大的意义。
1.1 电活性生物膜的形成过程
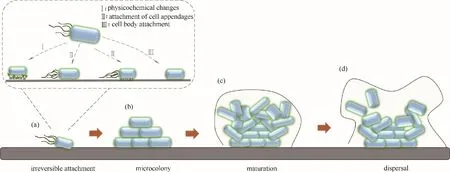
图1 生物膜形成过程Fig.1 The formation process of electroactive biofilm
电活性生物被膜的形成过程(图1)可以分为四个阶段:阶段一涉及细胞与电极表面的可逆附着。即电极附近微环境的离子强度、渗透压、pH 和营养条件等均不同于液体环境,浮游的细菌细胞识别出将要附着的电极表面并启动附着过程。首先细菌细胞表面会表现出理化性质的改变;随后,细菌细胞的鞭毛和菌毛先后进行附着,鞭毛和菌毛不仅增强与电极表面的黏附,同时起信号传递作用,促进胞内第二信使的产生,使细菌胞内对这种黏附作出响应;在起始附着阶段后期,基于酸碱作用力、范德华力、静电力等作用,菌体在接触电极表面后引起细胞膜形变,最终完成与电极表面的可逆附着[13]。在生物膜形成的第二阶段,在群体感应信号分子的表达和细胞外聚合物的形成介导下,细菌细胞不可逆地附着在基质表面。第三阶段涉及形成具有三维结构的成熟生物膜,该生物膜包含堆积成簇的细胞,簇之间具有通道,允许水和养分的运输以及代谢废物的排出。在阶段四,细菌细胞生物膜逐渐分离和分散,并开启新的生物膜形成。分散的细胞在形态上更类似于浮游细胞,并非成熟的生物膜细胞,浮游细胞对于再次发展成新的生物膜至关重要[14]。
1.2 电活性生物膜的电子传递机制
电能细胞依靠生物膜基质大量地附着在电极周围,如图2 微生物和电极之间的胞外电子传递主要有两种方式:(1)直接接触式电子传递;(2)间接接触式电子传递[15−17]。直接接触式电子传递是指微生物细胞与电子受体/供体(电极)之间的直接接触,通过外膜细胞色素和导电菌毛直接与电极传递电子。间接接触式电子传递是通过可溶性电子载体(如黄素、吩嗪等)或导电介质(如氢气、甲酸等),在细菌细胞和电极之间携带电子,而电子传递载体或导电介质可以是微生物自身分泌的有机或无机分子,也可以添加人工介质来进行电子转移。
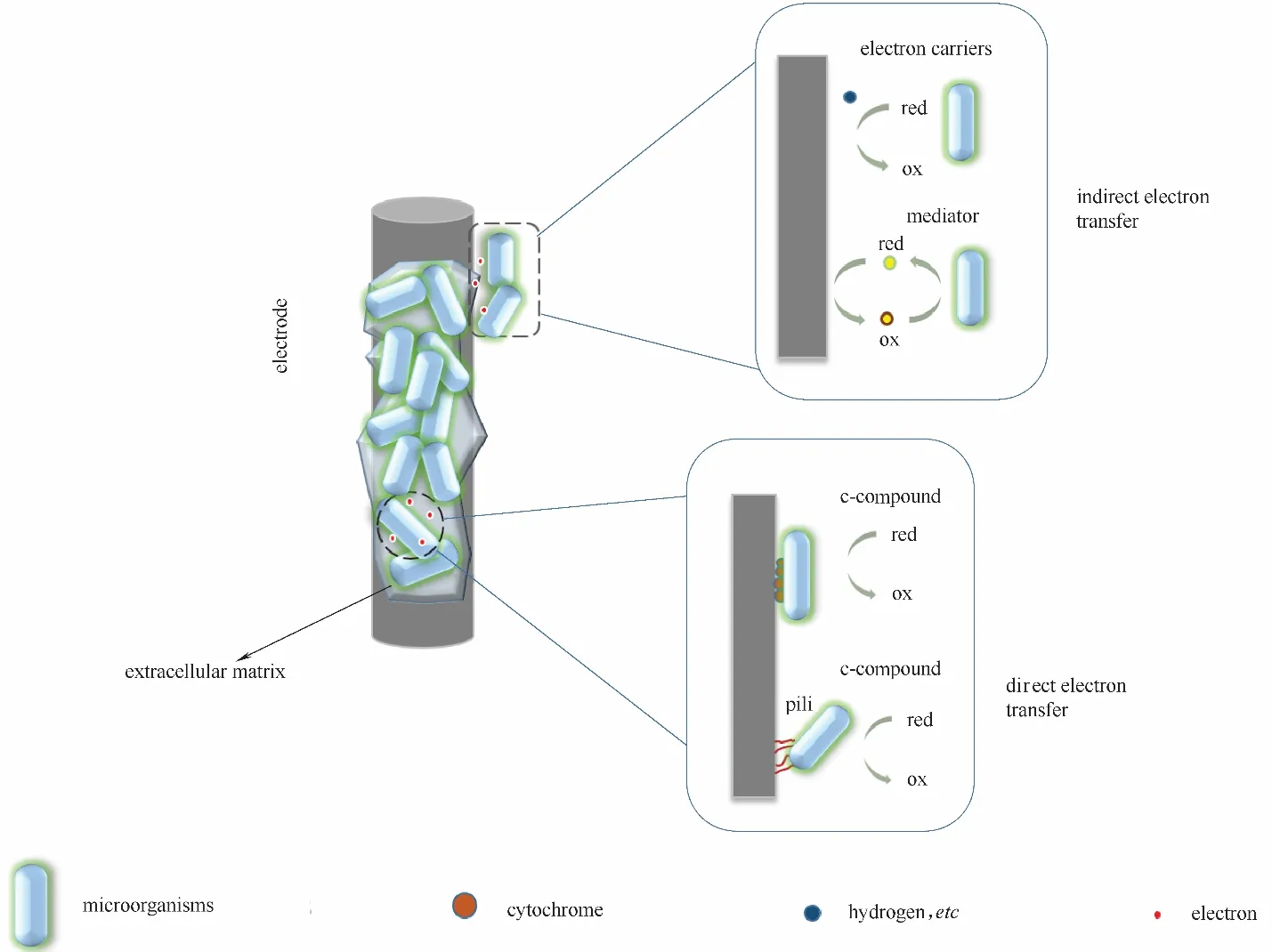
图2 电活性生物膜的电子传递机制Fig.2 Electron transfer mechanism of electroactive biofilm:direct electron transfer and indirect electron transfer
地杆菌Geobacter sulfurreducens 和希瓦氏菌Shewanella oneidensis 是微生物电催化最具有代表性的模式菌株,已具备完整的基因组序列信息和成熟的基因编辑技术。在G.sulfurreducens中具有多种类型的c 型细胞色素(c-Cyts)被认为是直接电子传递的主要通道之一,它可以使电子从细胞膜醌池直接转移到细胞外不溶性受体。c-Cyts 在EET 过程中特别是外膜(OM)c-Cyts 中不可或缺的作用已得到充分验证。例如,OmcZ(电极上G. sulfurreducens 生物膜中富含的OM c−Cyts)的缺失导致电流下降70%~90%[18−19]。 对 于S. oneidensis,由mtrDEF-omcAmtrCAB 基因簇编码的Mtr 色素系统,被确定为向胞外电子受体传递电子的直接接触途径[20−23]。缺少c−Cyts 基因的S. oneidensis 突变菌株产生的电流比野生型菌株少20%,相反在野生型中过表达mtrC 细胞色素时,观察到的电流增加了35%[24]。但是当氧化还原活性蛋白和电极表面之间的距离大于一定数值,电子传递速率就会随着其距离的增加而呈指数式下降[25],这表明由OM c-Cyts 控制的直接接触途径只能发生在生物膜最内层的微生物种群中。在大多数情况下,由于微生物通常在电极上形成一层厚厚的生物膜,位于生物膜表层的菌还可以通过外膜延伸部分的距离促进较厚生物膜的电子转移[26−29]。
除通过OM c-Cyts 和纳米导线进行直接电子传递外,电能细胞还可以通过自身分泌的可溶性氧化还原活性化合物(包括初级和次级代谢产物)和胞外的氢气、甲酸、Fe2+、NH3等作为电子介体,促进MFC 中阳极微生物的胞外电子间接式电子传递。这种电子传递机制随内源性电子介体和外生电子性质变化,如Shewanella 和假单胞菌Pseudomonas 都可以进行间接电子传递[30−34]。Shewanella 胞外电子传递的70%以上的电荷是由黄素类化合物作为介质进行传递的[35−37],黄素类(包括黄素单核苷酸和核黄素)已被确定为主要的胞外电子传递载体[37−41]。另外,Pseudomonas 能够自身分泌吩嗪类化合物(例如吩嗪−1−羧酸,吩嗪−1−羧酰胺和绿脓菌素)作为电子传递载体[32−33,42]。Rabaey 等[32]揭示了绿脓菌素和吩嗪−1−羧酰胺能极大地促进铜绿假单胞菌株KRP1 的胞外电子传递速率,吩嗪分泌不足能导致突变菌株的功率输出降低近95%。此外,在混合菌培养中分泌的吩嗪不仅可以被假单胞菌自身使用,而且还可以被其他细菌利用,也能显著提高功率输出和胞外电子传递效率[33,42]。
2 合成生物学改造生物膜
在自然状态下,电能细胞形成的生物膜因厚度、结构稳定性、生物量等因素限制,严重制约了电子传递效率。近年来,借助合成生物学手段,通过改进扩展现有生物学工具、重构基因调控线路、引入新功能模块等方式来改善电活性生物膜仍是国际研究的热点。本节综述了近五年国内外利用合成生物学方法从生物膜的结构成分、稳定性和导电性三大方面进行改造的研究进展。
2.1 合成生物学改造胞内信号分子
2.1.1 c−di−GMP 合 成 及 调 控 环 状 二 核 苷 酸(cyclic dinucleotides, CDNs)是一种高度通用的信号分子,控制着细菌中各种重要的生物学过程[43],环二鸟苷酸(cyclic diguanylate, c−di−GMP)作为最广泛研究的CDNs,是一种几乎无处不在的第二信使分子,参于调控细菌生长和生理生化的各个方面,包括活力、毒性、生物膜的形成和细胞周期。细胞内含有GGDEF 结构域的蛋白与底物GTP 结合,催化c−di−GMP 生成。游离的c−di−GMP 进而可以抑制鞭毛的合成,促进胞外多糖的分泌以及Type Ⅳ型菌毛的表达[44−45]。此外,c−di−GMP 作为细胞内一个关键的调节器,通过浓度变化调节细胞附着和分离状态进而控制生物膜的稳定性[46]。
Liu 等[47]在S.oneidensis 中采用构建IPTG 诱导型和组成型两种启动子方案来过表达控制c−di−GMP生物合成的基因ydeH,通过提高S.oneidensis胞内c−di−GMP 浓度增强了工程菌的生物膜形成能力[图3(a)]。相对于野生菌,工程菌在电极上形成了致密的生物膜,并且极大地加强了以c 型细胞色素介导的直接接触式胞外电子传递效率。最终工程菌株的MFCs 实现了167.6 mW/m2的功率密度,是野生型的2.8 倍。生物膜的增长通过促进生物量的增加来加快胞外电子传递速率,此方法为合成生物学工程改造生物膜提供了思路。表达相关合成基因提高产电菌胞内c−di−GMP 的浓度可以增强菌的生物催化能力,反之通过表达降解基因可以减弱生物催化能力,Benedetti 等[48]通过表达第二信使相关合成基因yedQ 和降解基因yhjH 控制恶臭假单胞菌Pseudomonas putida 中c−di−GMP 的水平,yedQ 的表达提高了c−di−GMP 的浓度从而促进了菌株生物膜的形成,yhjH 的表达可以增强第二信使分子向GMP转化,降低生物膜形成,由此来调控P.putida在浮游状态和生物膜状态之间切换[图3(b)]。这些结果表明,通过设计基因线路,可实现对微生物的生物催化能力的调控。
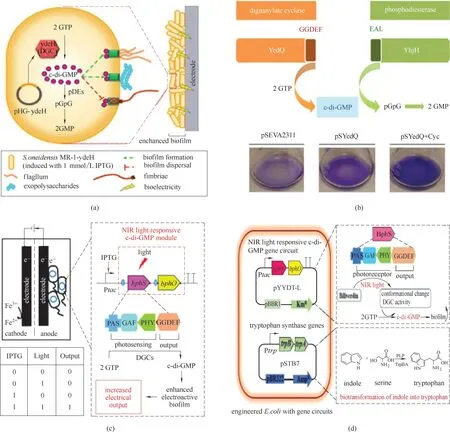
图3 合成生物学改造胞内信号调控分子(a)细胞内第二信使分子c−di−GMP调节细胞表面的成分,促进电活性生物膜的形成[47];(b)c−di−GMP浓度控制细菌生物膜的形成和降解,生物膜的产量直接影响细菌的生物催化能力[48];(c)光信号和诱导剂共同控制细胞内信号分子产生电活性生物膜[49];(d)利用光信号增强生物膜增加色氨酸的产量[50]Fig.3 Synthetic biology methods to engineer intracellular signaling molecules(a)The intracellular second messenger molecule c−di−GMP regulates the components on the cell surface and promotes the formation of electroactive biofilms[47];(b)The concentration of c−di−GMP controls the biofilm formation and degradation of bacteria,and the yield of biofilm directly affects the biocatalytic capacity of bacteria[48];(c)Optical signals and inducers jointly control intracellular signal molecules to produce electroactive biofilm [49];(d)Increased production of tryptophan by photosignal enhanced biofilms [50]
此外,除表达第二信使分子相关的合成基因,也可以利用光响应来控制菌内c−di−GMP 水平。Hu等[49]在E.coli 中利用近红外光响应c−di−GMP 模块构建一种基于生物膜的新型逻辑门,用诱导剂IPTG和近红外光谱光作为输入信号并输出电信号供给MFCs[图3(c)]。该模块包括工程蛋白BphS(一种菌体光敏色素c−di−GMP 合成酶)和BphO(一种异源发色团胆绿素合成酶)。BphS 包含两个主要结构域,一个是光感受器域(PAS−GAF−PHY),它与吸收光的发色团胆绿素结合,一个是DGC输出域(GGDEF),可以合成胞内c−di−GMP 增强生物膜的形成。在近红外光谱下激活DGC 活性,IPTG 诱导直接控制人工bphS−bphO 操纵子。因此,当IPTG 和近红外光同时存 在 时,表 达 的BphS 具 有DGC 活 性,导 致c−di−GMP 水平升高,进而增强阳极生物膜的形成,增加胞外电子传递。
在绿色化学合成中,Hu 等[50]使用近红外光响应基因电路调控胞内c−di−GMP 的浓度来调节生物膜形成,通过生物膜催化吲哚转化为色氨酸,近红外光谱增强生物膜的形成促使色氨酸产量增加30%[图3(d)]。这表明利用光谱进行调节生物膜的形成可以影响膜结构催化化学生产的可行性,光谱调控c−di−GMP 的合成能力进而影响生物膜形成的方法将在未来促进以生物膜介导的生物电催化提供广阔的借鉴方法。
2.1.2 QS 系统调控生物膜形成 细菌群体感应(quorum sensing,QS)是细菌细胞之间通过感受自诱导物来调控细菌群体行为的现象。这种细胞间通过群体感应进行的通讯最早发现在海洋生物发光细菌费氏弧菌中[51]。群体感应信号分子在革兰阳性细菌和革兰阴性细菌中有所不同,主要分为三类:①LuxI/R型信号系统。大部分革兰阴性细菌中的信号分子N−酰基高丝氨酸内酯(N−acyl−homoserine lactones, AHLs)参与群体感应,AHLs 由LuxI 酶合成,在细胞内不断累积后利用特定的传输系统向胞外分泌,其浓度达到一定阈值后就会与相应的受体蛋白LuxR 结合,启动下游基因的表达[52]。②小分子多肽介导的信号分子。存在于革兰阳性细菌中的寡肽型群体感应,该系统主要利用修饰后的小分子多 肽(anto−inducing peptides, AIPs)作 为 信 号 分子[53]。③luxS/AI−2 型信号分子。在两种菌属间参与的群体感应luxS调控信号分子(autoinducer 2,AI−2)[54]。QS 系统在生物膜的形成、胞外多糖的合成、细胞的运动性和趋化性方面起着至关重要的作用,这对于细菌在降解环境污染物中的应用必不可少[55]。因此,QS 系统的遗传调节将有助于BES 的生产,以及制造具有高效环境适应性的工程化生物膜。
Monzon 等[56]在高盐MFCs 中添加喹诺酮类微量诱导物(外源QS 信号)分子来促进细胞群体感应。转录组分析证实了群体感应是通过增加多糖相关生物合成基因的表达,多糖是维持细菌细胞在生物膜基质结构的主要成分,增强的表面附着力和抗性促进了生物膜的形成。该研究中100 nmol/L 的添加量使生物膜质量增加了95%,产生的功率密度持续增加了30%。在共聚焦显微镜观察下,细菌附着在阳极表面能力明显增强。这些结果表明,添加QS信号获得高电活性生物膜的方法能够对高盐分废水等进行生物处理,并且可以在将来扩大MFCs 在其他领域的应用范围。Zhou 等[57]研究还发现,革兰阴性细菌最常见的QS 信号分子(AHL)对混合培养的电活性生物膜,尤其是细胞外聚合物和利用EAB 内部直接电子转移机制的影响。结果表明,外源性和内源性AHL 均起着调节剂的作用。内源性AHL 调控下的MFCs 能量回收率从20.5%±3.9%增加到28.3%±4.1%,外源性AHL 调控下能量回收率进一步提高到36.2%±5.1%,并且在内源性AHL 调控下MFC 的启动时间从13 d 缩短到10 d,存在外源性AHL 的情况下进一步减少至4 d。外源性和内源性的AHL 改善了电极上的生物量、生物膜致密性和活/死细胞比例,从而获得了优异的电活性生物膜。
2.2 合成生物学改造电活性生物膜结构成分
微生物的聚集状态主要是通过胞外聚合物(extracellular polymeric substances,EPS)形成的网状结构连接聚合在一起,是维持生物膜结构的胞外基质,将生物膜内单个菌体结合在一起保护它们免受外界恶劣环境的影响,生物膜基质成分包括多聚糖、蛋白质,胞外DNA(extracellular DNA, eDNA)等[58−59],占EPS 有机物总量的70%~80%。EPS 在电活性微生物的生存和生长过程中起着重要作用,EPS 有助于电能细胞附着于电极表面。此外,EPS还为生物膜内细胞提供保护,使其免受各种环境压力的影响,例如pH 变化、渗透压和紫外线辐射等[60]。在本节中,分别综述了EPS 的主要成分在合成生物学中的改造研究进展。
2.2.1 胞外多糖 胞外多糖是EPS基质中的主要组成部分。 如在铜绿假单胞菌(Pseudomonas aeruginosa)中,与生物膜形成相关的多糖主要是Psl、Pel和海藻酸盐多糖[61],Psl是富含半乳糖的胞外多糖,而Pel 是富含甘露糖的胞外多糖,分别由多糖合成基因座的psl和pel编码[62]。然而,已经发现并非所有多糖都有助于附着。细胞外聚合物基质的主要作用是促进微生物细胞附着在生物或非生物表面上。Zhang 等[63]开发了合成基因电路,利用CRISPRi/ dCas9 调节胞外多糖基因wcaf 来控制大肠杆菌生物膜厚度,wcaF 编码合成大肠杆菌中荚膜异多糖酸,它是大肠杆菌EPS 中的关键多糖。当抑制wcaF 时,生物膜的形成被抑制,并且在一段时间内生物膜的厚度可以保持在一定水平。该方法表明可以通过调控基质中多糖来控制和维持生物膜厚度,即根据所需在相关应用中智能控制生物膜厚度具有巨大的潜力。
2.2.2 eDNA eDNA 是EPS 主要成分之一,它是细菌通过自身分泌、细菌裂解等作用释放到胞外的核酸分子。对细菌在固体表面形成生物膜的初始黏附性,以及生物膜的空间结构稳定性具有重要作用[64−65]。因此,改造eDNA 可以获得更理想的生物膜。已有研究证明eDNA 可由群体感应来调控[66],Das等[67]通过调节N−乙酰高丝氨酸内酯的浓度和假单胞菌喹诺酮信号(PQS)介导的群体感应系统来控制eDNA 的释放。eDNA 还与胞外基质中的菌毛、蛋白质交织在一起共同维持生物膜的空间结构[64,68]。
大量研究表明eDNA 与EPS 其他基质成分之间存在复杂的相互作用。例如,①eDNA 结合蛋白,在胞外黏性蛋白可作为eDNA 之间的连接点[69−70];②β毒素,一种分泌的毒力因子,在eDNA 存在下交联并形成不溶的核蛋白复合物[71];③Type Ⅳ型菌毛结合eDNA 并引导运动;④多糖与eDNA 共定位[72];⑤eDNA 与生物膜来源的膜囊泡相互作用;⑥绿脓菌素嵌入eDNA以促进细胞间相互作用[73]。
2.2.3 curli curli是许多肠杆菌科产生的细胞外复杂基质的主要蛋白成分,在生物膜形成过程中是细胞外基质的重要组成部分,具有调节细胞表面的吸附能力、促使成熟的生物膜形成、细胞间相互作用和稳定三维结构等重要功能[74]。近年来,curli 被应用于电能细胞导电生物膜。Seker 等[75]通过使用可诱导合成的核糖体调节电路,将自组装的curli 纤维与金纳米粒子等无机材料连接,从而使生物膜具有导电性能[图4(A)]。利用导电肽序列实现导电生物膜的合成,使不导电的大肠杆菌生物膜转换成可导电形式与电极连接[76]。Yong 等[77]建立了一种新的合成生物学方法来加强细胞和电极的相互作用,将融合了金属结合域的纳米curli 杂化纤维均匀表达于细胞表面,实现了与不锈钢电极的高效结合,使阳极输出功率提高了约420 倍,并大大提高了阴极库仑效率[图4(B)]。这对微生物电催化解决与环境和能源相关的问题提供了一个前沿解决方案。此外,生物膜作为生产自组装功能材料的生物平台[78],Joshi 等[79]提出了生物膜集成纳米纤维显示作为细菌细胞外基质材料的策略,在大肠杆菌生物膜中占主导地位的蛋白组分−淀粉样蛋白CsgA上添加肽结构域,CsgA 是大肠杆菌生物膜curli 的主要成分,这些工程CsgA 融合蛋白被成功地分泌并在细胞外自组装成淀粉样纳米纤维网络,从而保留了肽结构域的功能,并促进纳米颗粒生物模板化、底物黏附和位点特异性蛋白在结合系统上的固定。利用结合赋予生物膜基质多种人工功能,为细胞外聚合物基质创造新的电活性生物膜方法奠定了基础。
2.2.4 胞外蛋白 生物膜基质中包含有大量的胞外蛋白,且质量可能远远超过胞外多糖含量。Zhou等[80]发现了S.oneidensis MR−1 中生物膜形成的分子机制,并发现编码此过程涉及的7 种蛋白质的基因簇。首次详细研究了三个关键蛋白BpfA,BpfG 和BpfD。发现BpfA 以细胞外“胶水”的形式直接参与生物膜的形成;BpfG 直接影响BpfA 的分泌,而且还可以将BpfA 转变成活性形式参与生物膜分散。BpfD 可能参与对信号分子c−di−GMP 的响应,通过与BpfA 和BpfG 相互作用来调节生物膜的发育。S.oneidensis COAG 菌株是S.oneidensis MR−1的高度聚集突变体[81],与野生型相比,COAG 在玻璃载体材料上的生物膜形成增加。通过DNA 微阵列和蛋白质组学分析COAG 中外膜蛋白的表达变化,并与MR−1 进行了比较,发现细菌高度聚集状态与凝集蛋白aggA 的分泌有关。aggA 蛋白以成团和絮凝体的形式调节微生物的聚集,成团的菌体使生物膜在电极表面更加稳定,从而持续增强生物膜的电活性。
2.3 合成生物学改造电活性生物膜的导电性
2.3.1 基于导电细胞色素的改造 改造电能细胞的导电色素系统能促进电活性生物膜在MFCs 电极上的形成[24],电活性生物膜促进电能细胞直接接触电子传递,同时在胞内表达电子传递载体化合物(核黄素、吩嗪和醌类),实现两种电子传递机制共同促进高电活性生物膜的形成。Shewanella 总胞外电子传递的70%以上的电荷是由电子传递载体作为介质进行传递的[35−37],异源引入电子传递载体合成链能极大增强产电微生物的产电能力,同时会增强电活性生物膜的形成,二者共同促进电能细胞的胞外电子传递。例如,Min 等[82]在S.oneidensis MR−1 共同表达了黄素生物合成基因簇(ribD-ribCribBA-ribE)和色素生物合成基因簇(mtrC-mtrAmtrB),与对照菌株相比,工程菌株能在电极上形成厚的电活性生物膜,在微生物燃料电池和恒电位控制的电化学电池中表现出更好的胞外电子传递能力,最大电流密度增加了约110%和87%(图5)。改造的工程菌直接促进了直接电子传递和间接电子传递两种机制,该耦合表达的研究结果也为未来改造厚的电活性生物膜提供了有效策略。这对电活性生物膜在环境修复、废水处理和废弃物生物能源回收中的应用至关重要。
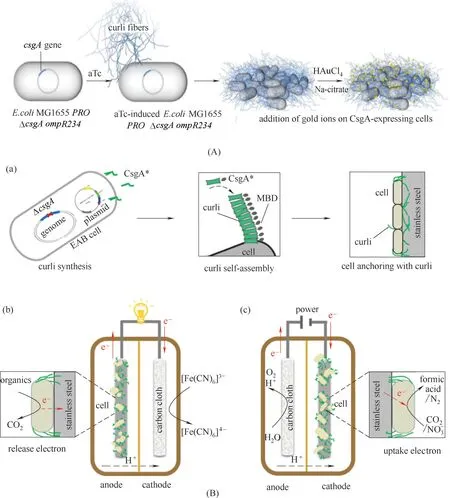
图4 合成生物学改造基于curli的电活性生物膜(A)基于卷曲纤维形成的导电生物膜的原理图,使用核调控的CsgA电路以及在卷曲纤维上存在柠檬酸钠和金(III)氯化物的情况下控制金纳米颗粒的形成[75];(B)合成curli生产电催化电活性生物膜[77];(a)电活性细菌中curli合成的示意图;(b)带有用于发电的不锈钢阳极的电活性生物膜;(c)具有用于CO2还原或反硝化的不锈钢阴极的电活性生物膜Fig.4 Engineering curli−based electroactive biofilm by synthetic biology methods(A)Schematic of the conductive biofilm based on curli fiber formation using a riboregulated CsgA circuitry along with controlled gold nanoparticle formation in the presence of sodium citrate and gold(III)chloride on curli fibers[75];(B)Synthetic curli produces electrocatalytic electroactive biofilms[77];(a)Schematic of the curli synthesis in electroactive bacteria;(b)Electroactive biofilms with stainless steel anode for electricity production;(c)Electroactive biofilms with stainless steel cathode for CO2 reduction or denitrification
2.3.2 基于胞间电子传递介质的改造 电能细胞可以利用无机(H2、H2S、Fe3+等)或有机化合物(黄素、吩嗪等)作为电子传递载体,介导细胞与电极表面之间的电子传递[83]。例如,S.oneidensis 合成的核黄素(RF)、黄素单核苷酸(FMN)等黄素类物质和P.aeruginosa合成的吩嗪−1−羧酸、绿脓素(PYO)等吩嗪衍生物均可作为电子高效传递的载体。Marsili 等[84]证明,从产电菌生物膜中去除黄素类物质可使胞外电子传递降低70%,表明黄素类化合物在可溶性氧化还原反应中起着将电子从细胞表面转移到阳极的作用。最近的电化学分析表明,S.oneidensis MR−1 自分泌的黄素不仅作为电子载体,还可作为与外膜型细胞色素结合的氧化还原辅因子,导致胞外电子传递动力学显著增强。
促进电子传递载体的生物合成和分泌是提高生物膜导电性的有效途径。大量的黄素将电子从外膜传递到细胞外基质,有研究表明色素系统通过瞬时结合核黄素在胞外电子传递中起作用[41],色素系统是实现其他胞外电子传递途径的重要通道。Yang 等[85]将枯草芽孢杆菌中编码核黄素合成的核心基因簇(ribADEHC)在S.oneidensis MR−1中异源表达,经过IPTG 的诱导工程菌分泌的黄素(核黄素和黄素腺嘌呤二核苷酸)浓度增加25.7 倍,直接提高了电子传递载体的胞外电子传递,同时电极上的生物附着量提高了近一倍,促进了以色素系统等直接接触式的电子传递路径。该黄素合成模块显著增强MR−1 双向电子传递能力,使得微生物燃料电池的最大输出功率增加了13.2 倍,向内电流增加了15.5倍,结果表明,加强电子传递载体的生物合成和分泌是提高生物膜导电性和胞外电子传递效率的有效策略。
2.3.3 基于导电菌毛的改造 导电菌毛(pili)对菌在固体表面的黏附、振颤运动和生物膜的形成都有很重要的作用,也对电能细胞的胞外电子传递具有直接的作用,增强pili 的导电性能促进菌的直接接触电子传递,提升生物膜的导电性能。在之前的研究中,Ajo−Franklin等[86]将S.oneidensis的胞外电子传递色素蛋白(CymA、MtrA、MtrB、MtrC)引入非产电菌大肠杆菌中,成功实现E.coli 产电,随后Lienemann等[87]在这个基础上引入能结合甘露糖的pili,将细胞附着在甘露糖涂层材料上形成电活性生物膜[图6(a)]。在电活性生物膜内部,表达的色素系统持续地将电子传递到胞外,促进了以色素系统为直接接触的电子传递能力。基于pili 构建导电生物膜的方法为新型的微生物电催化提供了良好的思路。
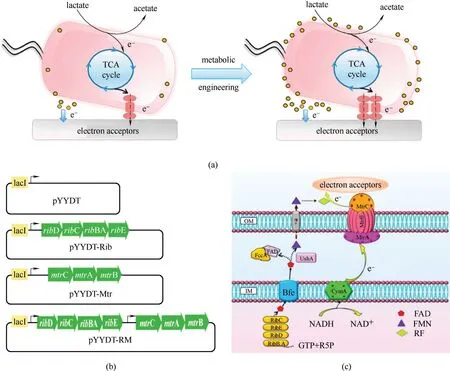
图5 合成生物学改造生物膜的导电性[82](a)通过耦合改善黄素合成和细胞色素来提高生物膜的导电性;(b)表达载体的质粒示意图;(c)黄酮和细胞色素介导的MR−1的EET通路示意图;胞内电子通过CymA和MtrA到达外膜细胞色素c(OmcA和MtrC);外膜与胞外电子受体之间的界面电子转移可以通过直接接触的EET、外膜细胞色素c或纳米导线进行,也可以通过黄素作为电子穿梭物介导的间接EET进行Fig.5 Engineering electrical conductivity of biofilms by synthetic biology approaches [82](a)Enhancing electrical conductivity of biofilms through coupling improved flavin synthesis and cytochrome;(b)Schematic plasmid maps of expression vectors;(c)Schematic illustration of the flavin and cytochrome mediated EET pathway in S.oneidensis MR−1;Intracellular electrons flow through CymA and MtrA and come to outer membrane cytochrome c(OmcA and MtrC);The interfacial electron transfer between outer membrane and extracellular electron acceptors may occur by direct contact−based EET,via outer membrane cytochrome c or nanowires,or indirect EET mediated by flavin as electron shuttles
Tan 等[88]将G. metallireducens 中 编 码Type Ⅳ型pili 菌毛基因PilA 在G. sulfurreducens 中进行异源表达,得到一种导电性较好的导电菌毛(e−pili)。Geobacter 本身的pili 导电性较差,改造过后的菌株产生了大量的菌毛,提高了pili 的电导率。高电导率的菌毛是因为形成了高密度的芳香族氨基酸,G.sulfurreducens 菌毛末端羧基序列的特殊芳香氨基酸具有导电性[89],这是沿菌毛进行电子传递的重要组成部分。这些合成元件被设计用来调节电子传输,模仿自然电活性细菌的蛋白质附属物。在P.aeruginosa 中PilA 编码组装的pili 也具有高导电性[90],通过增加P.aeruginosa 的pili 末端的芳香氨基酸数量,可以显著提高菌毛的电导率。因此,如果能对pili 的外表面进行修饰,使其具有新的传感能力或增强与其他材料的结合,那么从G.sulfurreducens 菌中获得的导电蛋白纳米线的潜在应用可能会大大扩展。Ueki等[91]开发了一个简单的策略,表面暴露肽使e−pili 功能化。对组装pili 单体的基因进行了修饰,使其在单体的羧基端添加肽标签,制备了具有暴露在外表面的肽标签合成e−pili。添加肽标签并没有降低e−pili 的电导率,反而这种修饰可以按照需求合理控制表达,合成pili 可以帮助菌更紧密附着在电极表面,从而开发高导电生物膜[图6(b)]。
3 展 望
随着现代生物技术不断更新,对电活性生物膜的解析越来越多,包括代谢机理和区别于单个细胞群落的新特性,生物膜应用在未来将会更加广泛。目前对生物膜的研究仍不够系统、彻底,可以从以下几个方面作进一步思考:(1)开发基因编辑工具,进行多基因表达调控;(2)结合系统生物学技术,在多组学指导下进行特异性合成生物学改造;(3)从生物膜厚度、导电性、稳定性、内部代谢和结构均质性等角度协同工程化改造导电生物膜。
合成生物学的方法在指导生物膜改造上具有很多的技术优势性和便捷性,微生物强大的生物膜形成能力、自身的膜结构强度以及高效率的性能对任何的领域应用都有显著的促进作用。但是,调控生物膜的合成生物学方法仍处于早期阶段。在生物膜发育的不同阶段,多种因素同时或串联起作用,而不是单个基因或信号分子。因此,可能需要多阶段和多目标策略来实现所需水平的生物膜控制,这可通过模拟自然生物膜的形成和扩散过程来实现。不断增加的合成生物学工具以及对生物膜调控的持续研究将为生物膜控制策略及其在医疗、食品加工、农业、工业和环境领域的应用提供见解。
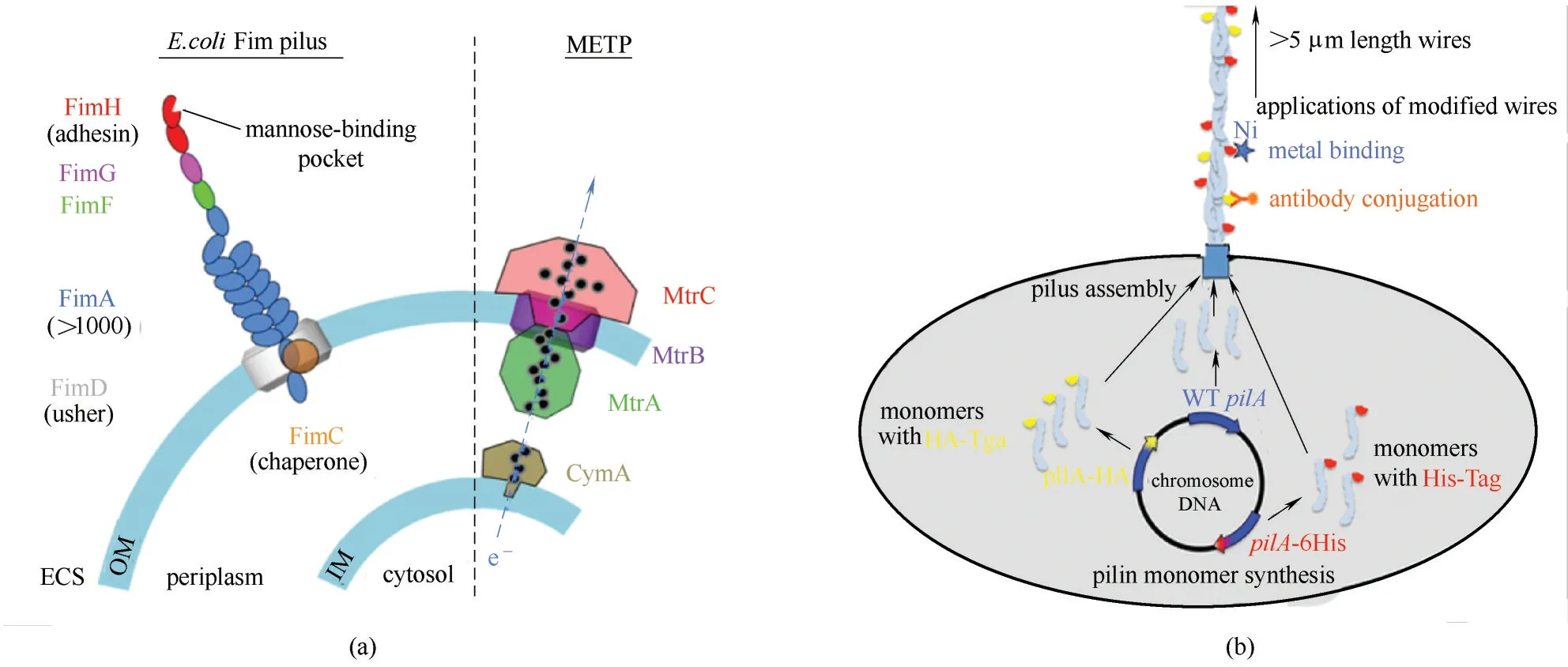
图6 合成生物学改造基于pili的电活性生物膜(a)构建的大肠杆菌系统的细胞包膜示意图[87];外膜上的pili促进与细胞色素系统直接接触的电子传递;(b)通过改变pili的外表面获得高导电性的生物膜[91];通过在单体的羧基端添加肽标签制备具有暴露表面的肽标签,合成了e−piliFig.6 Engineering electroactive biofilm based on pili by synthetic biology methods(a)Schematic of cell envelope of the constructed E.coli system[87];The pili on the outer membrane promotes electron transport in direct contact with the cytochrome system;(b)Highly conductive biofilm was obtained by modifying the outer surface of pili[91];e−pili was synthesized by adding a peptide tag to the carboxyl end of a monomer to prepare a peptide tag with an exposed surface
展望未来,开发出优异的生物膜将赋予细菌在生产纳米生物材料产业化成为可能,并有可能扩展到化学品绿色合成领域。例如,将生物膜3D打印技术与合成遗传控制技术相结合,细菌的3D打印用来创建基于生物膜的功能材料用于生物修复和生物医学应用;具有较高产量和对有毒抑制剂耐受性的生物膜能作为微生物细胞工厂,用于生产诸如乙醇、丙酮、丁醇和琥珀酸等化学品。合成生物膜群落在工业生化生产中将变得越来越重要,在21世纪合成生物学方法改造上也必将开拓出革命性的成果。
