谷红注射液促进骨折大鼠模型骨愈合作用研究①
2020-09-29陈朝祥周淑平王郑钢伍俊星
陈朝祥 周淑平 王郑钢 张 卫 向 亮 侯 威 伍俊星
(南华大学附属南华医院关节运动科,衡阳 421002)
骨折愈合是一个极其复杂的组织学和生物化学变化过程。研究显示,临床约有5%~10% 患者出现骨折愈合延迟,需进一步手术治疗,给患者及其家庭带来负担[1,2]。谷红注射液为中西药复方制剂,其主要成分为红花提取物及乙酰谷酰胺。其中乙酰谷酰胺是谷氨酰胺乙酰化的衍生物,属于一种神经肽,作为临床上广泛应用的脑功能改善辅助剂,已得到一系列临床试验的证实[3,4];而红花主要功效为祛瘀止痛、活血通经,对跌打损伤以及关节疼痛等症状治疗效果显著,目前关于谷红注射液对大鼠骨折愈合作用研究较少。本研究通过制备骨折大鼠模型,观察谷红注射液对其骨矿物质密度(BMD)、血清碱性磷酸酶(ALP)、成纤维细胞生长因子2(FGF-2)等的影响,为初步确定和评判谷红注射液促进骨折愈合的作用提供药理实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 选取清洁级SD 大鼠72只,雄性,8~10周龄,体质量(200±20)g,许可证号:SCXK(湘) 2013-0005,由湖南斯莱克景达实验动物有限公司提供。本研究通过南华大学附属南华医院伦理委员会审查。
1.1.2试药与仪器 谷红注射液(通化谷红制药有限公司);复方骨肽注射液(南京新百药业有限公司,批号 170522);FGF-2免疫组化试剂盒 (美国 HyClone-PIERCE公司);ALP检测试剂盒(德国 Roche Diagnostics GmbH);FGF-2试剂盒(ELISA,上海抚生实业有限公司);X线骨密度仪和ELISA 酶标仪(德国Roche 公司)。
1.2方法
1.2.1大鼠骨折模型制作 大鼠采用10%水合氯醛麻醉,右侧小腿胫骨常规消毒后切开约2 cm,向外分离皮肤,然后在胫骨结节下1 cm截断胫骨,制造横行骨折,髓内采用0.8 mm医用配药针头固定骨折断段,关闭切口。
1.2.2分组与给药 造模成功后,将SD大鼠随机分为对照组(生理盐水灌胃)、谷红注射液组[谷红注射液,10 ml/(kg·d)腹腔注射],阳性药组[复方骨肽注射液,5 ml/(kg·d)腹腔注射],每组24只。
1.2.3影像学检查 分别于建模后第2、4、6周各组随机选取8只大鼠,脱颈法处死大鼠,采用X线机观察骨折情况。影像学条件:柯达底片,大鼠后肢距胶片距离25 cm,曝光时间1.25 s,放大倍率约33%,进行X线扫描拍片。骨折愈合评分采用Garrett等骨折愈合影像学标准[5]。
1.2.4BMD检测 影像学检查后切开大鼠骨折处皮肤暴露胫骨,断离右下肢保留胫骨全长,拔除髓内针,将胫骨周围软组织剥离,注意保护骨折端愈合的骨痂组织,防止骨折端分离,进行离体BMD测量。
1.2.5HE染色 大鼠在不同时段分批进行BMD 检测后,将右侧胫骨于4%多聚甲醛中固定,PBS冲洗后转入乙醇固定,进行骨组织脱钙,大鼠胫骨置于脱钙液中脱钙3周。脱钙完成后用蒸馏水冲洗两遍,酒精梯度脱水,二甲苯透明,石蜡包埋切片,干燥后进行HE染色,显微镜下观察并拍照。
1.2.6ALP及FGF-2检测 造模后第2、4、6周时,各组随机选取8只大鼠进行尾静脉取血,离心5 min,室温放置,8 h内完成血清ALP浓度检测。检测采用日立7600全自动生化仪检测,所有实验均按说明书进行操作;同时,采用ELISA法对血清中FGF-2进行检测,严格按照说明书进行操作,记录酶标仪OD值。
1.2.7免疫组化检测 造模后第2、4、6周时,各组随机选取8只大鼠,脱颈法处死大鼠,取右侧胫骨,进行骨组织脱钙,大鼠胫骨置于脱钙液中脱钙3周。脱钙完成后用蒸馏水冲洗,酒精梯度脱水,透明12 h,骨组织包埋切片,干燥后进行免疫组化染色,显微镜下观察,使用 Image J 图像分析软件对所有视野进行平均光密度(MOD)值测定。

2 结果
2.1影像学检查结果 2周时,GHI组和阳性药组较对照组出现部分软骨痂,均无明显骨连接。4周时,GHI组和阳性药组较对照组出现的骨连接增多,见图1;根据Garrett评分标准,与对照组相比,第2、4周时GHI组和阳性药组评分均升高,而术后6周,基本进入塑形期,见表1。

图1 各组大鼠骨折后X线情况Fig.1 Condition of X-ray after fracture in rats of each group

表1 各组大鼠骨组织评分
2.2骨密度测定 在术后3个时段测定BMD值结果显示,GHI组和阳性药组BMD值均高于对照组(P<0.05),但GHI组与阳性药组组间差异无统计学意义,见图2。

图2 各组大鼠骨密度值Fig.2 Done mineral density of rats in each groupNote:n=8.Compared with control group,*.P<0.05.
2.3骨组织HE染色结果 第2周时,GHI组和阳性药组HE切片软骨细胞数量多于对照组,同时部分出现不成熟骨小梁,而对照组无骨小梁。4周时,对照组骨折端仍以软骨组织为主,少数切片存在纤维组织。GHI组和阳性药组的软骨组织及纤维组织逐渐被不成熟骨组织替代,甚至部分出现较成熟骨小梁结构。6周时对照组和GHI组以软骨组织与不成熟骨组织交替为主,而阳性药组出现部分成熟骨组织,3组间无明显差异,见图3。

图3 HE染色观察骨组织变化Fig.3 Changes of bone tissues observed by HE
2.4血清ALP及FGF-2检测结果 在术后2周,表现出阳性药组ALP含量高于GHI组及对照组。但在第4、6周,对照组、阳性药组和GHI组间ALP 含量差异无统计学意义(P>0.05)。而GHI组和阳性药组血清中FGF-2含量在第2、4、6周时均明显高于对照组(P<0.01),见图4。
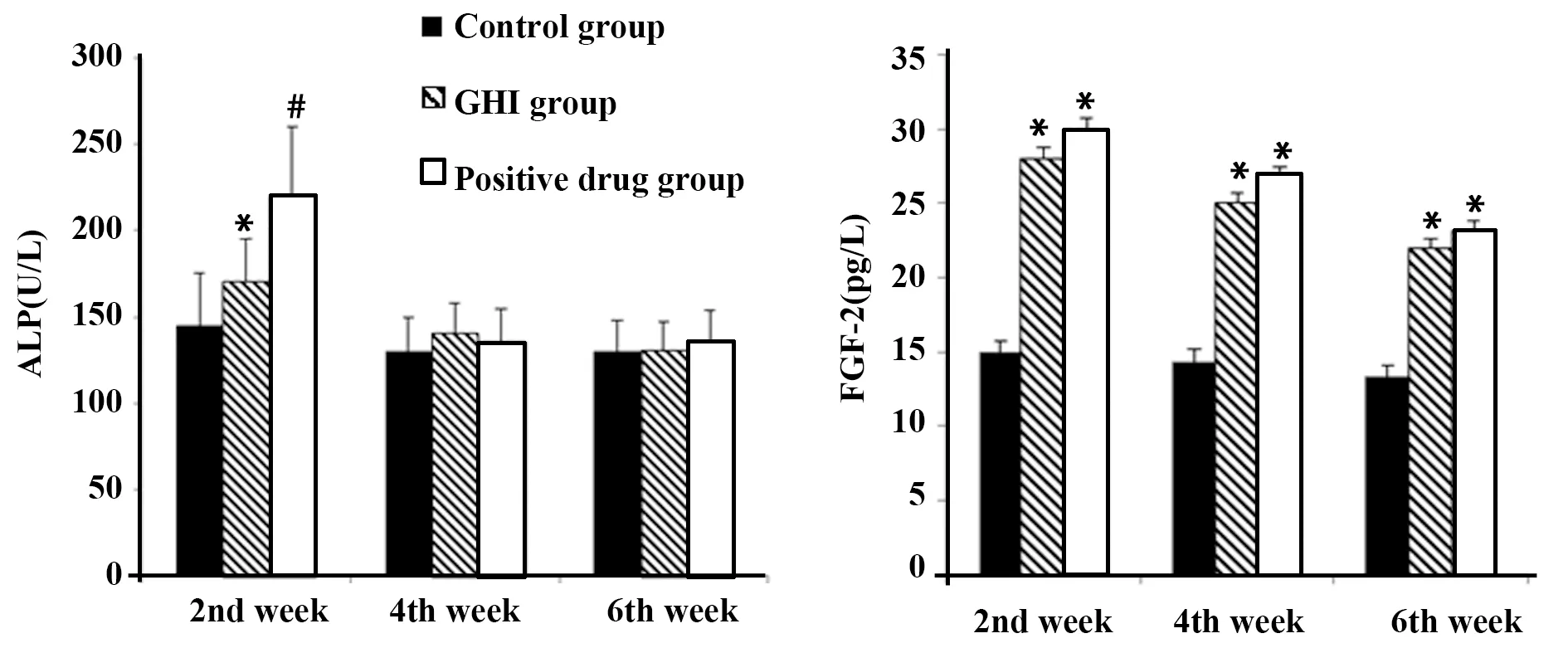
图4 各组大鼠血清ALP及FGF-2变化Fig.4 Changes of serum ALP and FGF-2 in each groupNote:Compared with control group,*.P<0.05,#.P<0.01.
2.5骨组织FGF-2表达结果 在造模成功后第2周GHI组和阳性药组MOD值均较对照组高,组间比较差异均有统计学意义(P<0.01);第4周时各组FGF-2的MOD值较第2周均下降,但GHI组和阳性药组MOD值均比对照组高(P<0.01),GHI组和阳性药组间差异具有统计学意义(P<0.05);术后第6周,3组间MOD值差异无统计学意义(P>0.05),见图5。

图5 各组大鼠不同时段FGF-2表达变化Fig.5 Changes of FGF-2 expression in different periods of rats in each groupNote:n=8.Compared with control group,*.P<0.05;#.P<0.01.
3 讨论
骨折愈合被认为是骨重建过程,在骨的形成和再吸收过程中破骨细胞和成骨细胞发挥重要作用,而骨细胞通过调节骨的形成和再吸收,影响破骨细胞和成骨细胞[6,7]。目前对GHI在骨折愈合方面的研究较少,同时缺乏验证其疗效的国际公认的影像学及组织学评判标准。因此本研究目的是观察不同时段GHI对FGF-2表达的影响以及促骨折愈合的效果。
骨肽注射液含有多种骨代谢的活性肽类,具有促进骨细胞增殖和破骨细胞凋亡的作用[8,9],因此本实验将骨肽注射液作为阳性对照药物;谷红注射液是由乙酰谷酰胺和红花提取液制成的灭菌水溶液,红花提取液含有红花黄色素及红花苷类等有效成分,具有抗氧自由基、抑制血小板凝聚、改善微循环及降血脂等作用,但有关骨折方面研究甚少[10,11]。
影像学结果显示,2周时,GHI组和阳性药组较对照组出现部分软骨痂,均无明显骨连接。4周时,GHI组和阳性药组较对照组出现的骨连接更多。根据Garrett评分标准,与对照组相比,第2、4周时GHI组和阳性药组评分均升高,术后6周,基本进入塑形期。说明GHI组和阳性药组具有促进早期骨折愈合效果;BMD检查结果显示,在不同的时段GHI组和阳性药组BMD值均高于对照组,说明GHI组具有增加骨矿含量的作用;骨组织HE染色结果显示,第4周时,对照组骨折端仍以软骨组织为主,GHI组和阳性药组的软骨组织及纤维组织逐渐被不成熟骨组织替代,这说明谷红注射液能有效促进骨愈合;ALP检测结果显示,在术后2周,GHI组ALP含量高于对照组(P<0.05),这说明GHI刺激 ALP 活性,促进成骨细胞增殖,与增强骨钙素转录和胶原的分泌等密切相关[12]。在第4、6周,3组大鼠ALP含量变化不明显。这可能原因是:ALP被认为是骨矿化早期标记物,因此GHI对早期ALP刺激作用明显,而对后期ALP刺激作用减弱,导致ALP表达下降。ALP、BMP增加可能促进成骨细胞分化和骨基质分泌,进而促进骨折愈合。
FGF-2广泛存在于人体内,参与器官创伤修复,属于创伤愈合因子之一。FGF-2能通过趋化作用使巨噬细胞、成纤维细胞等细胞向创伤部位聚集,从而促进创伤的愈合,同样在骨折愈合中也起到重要作用[13,14]。实验结果显示在血清和骨组织中,GHI能促进FGF-2表达,在骨折造模后第 2 周FGF-2血清含量和蛋白表达到达高峰,GHI组和阳性药组MOD值均较对照组高(P<0.01),而在第4、6周FGF-2表达均逐渐下降,与文献报道结果基本一致[15]。而且GHI组大鼠骨折部位FGF-2表达较对照组明显增加,提示GHI促进骨折端FGF-2表达与大鼠骨折愈合相关,且GHI可能通过FGF-2的作用,在骨折愈合早期促进血管的形成,促进骨折愈合。
综上所述,本实验通过建立骨折大鼠模型,在不同时段从影像学、组织学等方面进行评估,证实GHI能促进大鼠骨折愈合,其机制可能与促进 FGF-2 表达有关,但具体机制需要进一步研究。